Francium Element Feiten
Het chemische element francium wordt geclassificeerd als een alkalimetaal. Het werd in 1939 ontdekt door Marguerite Perey.

Data Zone
| Classificatie: | Francium is een alkalimetaal |
| Kleur: | zilvergrijs-metallic (verondersteld) |
| Atoom gewicht: | (223), geen stabiele isotopen |
| Staat: | solide |
| Smeltpunt: | 27 oC, 300 K |
| Kookpunt: | 677 oC, 950 K |
| Elektronen: | 87 |
| Protonen: | 87 |
| Neutronen in de meest voorkomende isotoop: | 136 |
| Elektronenschalen: | 2, 8,18,32,18,8,1 |
| Elektronenconfiguratie: | 7s1 |
| Dichtheid @ 20oC: | 1.873 g / cm3 |
Meer weergeven, inclusief: Heats, Energies, Oxidation,
Reacties, verbindingen, stralen, geleidbaarheid
| Atoomvolume: | 71,07 cm3 / mol |
| Structuur: | wordt verondersteld bcc te zijn: body-centered cubic |
| Hardheid: | – |
| Specifieke warmtecapaciteit | – |
| Warmte van fusie | 2 kJ mol-1 |
| Vernevelingswarmte | 73 kJ mol-1 |
| Verdampingswarmte | 64 kJ mol-1 |
| 1e ionisatie-energie | 384 kJ mol-1 |
| 2e ionisatie-energie | – |
| 3e ionisatie-energie | – |
| Elektronenaffiniteit | – |
| Minimum oxidatiegetal | 0 |
| Min. gemeenschappelijk oxidatienummer | 0 |
| Maximaal oxidatiegetal | 1 |
| Max. gemeenschappelijke oxidatie nr. | 1 |
| Elektronegativiteit (Pauling-schaal) | 0,7 |
| Polariseerbaarheid volume | 48,7 Å3 |
| Reactie met lucht | – |
| Reactie met 15 M HNO3 | – |
| Reactie met 6 M HCl | krachtig, ⇒ H2, FrCl |
| Reactie met 6 M NaOH | krachtig, ⇒ H2, FrOH |
| Oxide (s) | – |
| Hydride (s) | – |
| Chloride (s) | – |
| Atoomradius | – |
| Ionische straal (1+ ion) | 194 pm |
| Ionische straal (2+ ion) | – |
| Ionische straal (3+ ion) | – |
| Ionische straal (1- ion) | – |
| Ionische straal (2- ion) | – |
| Ionische straal (3- ion) | – |
| Thermische geleidbaarheid | 3,61 W m-1 K-1 |
| Elektrische geleidbaarheid | – |
| Vries- / smeltpunt: | 27 oC, 300 K |

Dit uraniumertsmonster bevat ongeveer 100.000 atomen francium-223 (3,3 x 10-20 g). Francium is radioactief; er is op elk moment minder dan 30 gram op aarde. Afbeelding Ref. (1)
Ontdekking van Francium
Francium werd ontdekt door Marguerite Perey in 1939 toen ze onderzoek deed naar het radioactief verval van actinium-227.
De ontdekking vond plaats in het Curie Institute in Parijs. Het element ontleent zijn naam aan het land van zijn ontdekking – Frankrijk.
De ontdekking begon in 1935, toen Perey, 26 jaar oud, een onderzoeksartikel las waarin hij beweerde dat Amerikaanse wetenschappers bètadeeltjes hadden ontdekt die werden uitgestoten door actinium dat had een grotere hoeveelheid energie dan normaal.
Perey was nieuwsgierig naar deze bevinding en als expert op het gebied van actiniumgerelateerd werk besloot ze haar eigen experimenten met actinium uit te voeren. Ze produceerde een ultrazuiver actiniummonster en bestudeerde de straling ervan. Perey ontdekte dat ongeveer 1% van de radioactiviteit van actinium werd veroorzaakt doordat het alfadeeltjes uitzendt, niet door bètadeeltjes.
Perey had ontdekt dat actinium-227 kon vervallen door een heliumkern (ook wel een alfadeeltje genoemd) zijn eigen kern. De gevormde dochterkern was een voorheen onontdekt element dat ze francium noemde om haar thuisland Frankrijk te eren.
227Ac → 223Fr + 4He
Met 87 protonen hoorde het nieuwe element thuis in Groep 1 van het periodiek systeem, samen met de andere vijf alkalimetalen: lithium, natrium, kalium, rubidium en cesium.
De ontdekking van francium voltooide de ontdekkingen van de mensheid van natuurlijk voorkomende elementen.
Alle elementen die sindsdien zijn ontdekt, zijn ontdekt toen het element in het laboratorium werd geproduceerd.

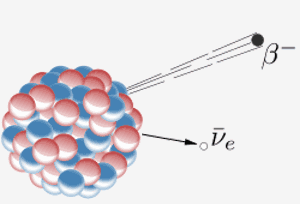
Een kern zendt een bètadeeltje uit ( een elektron) en een antineutrino. Het resultaat hiervan is dat een neutron in de kern verandert in een proton. Wanneer element 87 in het periodiek systeem (francium) dit doet, betekent het extra proton dat het element 88 (radium) wordt.
Uiterlijk en kenmerken
Schadelijke effecten:
Francium is zeer radioactief.
Kenmerken:
Francium is een zwaar, onstabiel, radioactief metaal met een maximale halfwaardetijd van slechts 22 minuten. Het heeft een laag smeltpunt (27 oC, 81 oF) en als er voldoende van kan worden verzameld, zou het vloeibaar zijn in een warme kamer.
Francium is het tweede zeldzaamste element in de aardkorst, naast astatine. Er is op elk moment minder dan dertig gram francium op aarde.
Francium is het minst elektronegatieve van alle elementen, daarom zou het het chemisch meest reactieve alkalimetaal moeten zijn. Helaas is het niet in voldoende hoeveelheden beschikbaar om te laten zien dat het reageert met water – het wordt in kleine hoeveelheden gemaakt in deeltjesversnellers. In theorie zou de reactie ervan met water gewelddadiger zijn dan die van cesium en veel gewelddadiger dan die van natrium.
Francium is voor het laatst bestudeerd aan de Stony Brook University, New York. Wetenschappers hielden daar tot tienduizend franciumatomen tegelijk vast met behulp van laserstralen in een magnetisch veld om hun eigenschappen te meten.
Gebruik van Francium
Commercieel gezien zijn er geen toepassingen voor francium, vanwege de zeldzaamheid en instabiliteit. Het wordt alleen voor onderzoeksdoeleinden gebruikt.
Francium-verval
Francium-isotopen, met massagetallen variërend van 200 tot 232, ondergaan meestal alfa- of bèta-verval.
Hier zijn slechts een paar voorbeelden van de vervalpaden van francium:
Francium-223 is de langstlevende isotoop van het element. Het heeft een halfwaardetijd van 22 minuten. Het kan een alfadeeltje (een heliumkern) uitzenden om astatine-219 of een bètadeeltje te vormen om radium-223 te vormen. (Een bètadeeltje is een elektron dat wordt uitgezonden vanuit een kern wanneer een neutron wordt omgezet in een proton.)
Francium-221 heeft een halfwaardetijd van 5 minuten. Het kan een alfadeeltje uitzenden om astatine-217 te vormen of een bètadeeltje om radium-221 te worden.
Francium-216 heeft een halfwaardetijd van 0,7 microseconde. Het kan een alfadeeltje uitzenden om astatine-212 te vormen of een positron om radon-216 te vormen.
Francium-212 heeft een halfwaardetijd van 19 minuten. Het kan een alfadeeltje uitzenden om astatine-208 te vormen of een orbitaal elektron te vangen om radon-212 te vormen. (2) (Tijdens orbitale elektronenvangst vangt de kern een van de eigen elektronen van het atoom op en zendt een neutrino uit.)
Overvloed en isotopen
Overvloed aardkorst: ~ 0 delen per miljoen , ~ 0 delen per miljoen
Overvloed zonnestelsel: ~ 0 delen per miljard per gewicht, ~ 0 delen per miljard per mol
Kosten, puur: $ per 100 g
Kosten, bulk: $ per 100 g
Bron: Francium komt van nature voor als gevolg van het alfa-radioactieve verval van actinium.
Isotopen: Francium heeft 33 isotopen waarvan de halfwaardetijden zijn bekend, met massagetallen 200 tot 232. Geen enkele is stabiel. 223Fr heeft de langste halfwaardetijd van 21,8 minuten.

- Foto door Konrad Roeder
- EK Hyde, een. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, uitgave 6.
Citeer deze pagina
Voor online koppelingen, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
of
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Om deze pagina in een academisch document te citeren, gebruik de volgende MLA-compatibele citatie:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.