Frontiers in Immunology
Inleiding
Pre-eclampsie is een zwangerschapsspecifieke ziekte die 3-5% van alle zwangerschappen treft (1, 2). Het manifesteert zich met nieuw ontstane hypertensie na 20 weken zwangerschap en proteïnurie. De placenta staat centraal in de pathogenese van de ziekte door de moeder met de foetus te verbinden (3). De moeder-foetale interface is de zone waar genetisch verschillend weefsel van foetale oorsprong samenkomt met maternale circulatie, endotheel en immuunsysteem. Een algemeen aanvaard inzicht, vaak de ziekte van de theorieën genoemd, is dat pre-eclampsie het endotheel van de moeder aantast en de functie van het endotheel verstoort, wat leidt tot hypertensie en proteïnurie (2). In zijn ernstige vorm kan pre-eclampsie leiden tot groeiachterstand van de foetus, prematuriteit en voor de moeder kan het orgaanfalen in de nieren en lever veroorzaken, evenals eclampsie. Bovendien kan pre-eclampsie op de lange termijn nadelige cardiovasculaire gevolgen hebben voor de moeder en de pasgeborene (4). De ontwikkeling van de placenta wordt met name als ontoereikend beschouwd in het proces van transformatie van de maternale arteria spiralis, waar de trofoblastcellen de maternale zijde binnendringen in decidua en de arteriën transformeren in leidingen met lage weerstand, die ook het endotheel van de moeder vervangen (5–7). Typisch is deze hermodellering van de baarmoederslagaders afwezig of onvolledig, vooral bij ernstige vorm van pre-eclampsie. Hoge weerstand in de vernauwde baarmoederslagaders veroorzaakt turbulente bloedstroom naar de tussenliggende ruimte van de placenta, wat oxidatieve stress en mechanische schade aan de placenta villous bomen veroorzaakt. De resulterende schade verhoogt de placenta-uitscheiding van microdeeltjes en ontstekingsmediatoren, wat resulteert in gegeneraliseerde endotheliale activering en disfunctie (8, 9). Deze opeenvolgende gebeurtenissen in de maternale-foetale interface leiden tot maternale hypertensie en andere symptomen, zoals hierboven beschreven.
Het HELLP-syndroom werd voor het eerst gekarakteriseerd in 1982 door Weinstein als een afzonderlijk syndroom, dat vaak samen met pre-eclampsie voorkomt, maar ook alleen (10, 11). HELLP-syndroom wordt gekenmerkt door hemolyse, verhoogde leverenzymen en lage bloedplaatjes. Het vereist vaak observatie op het niveau van de intensive care en symptomatische therapie. De pathogenese van het syndroom staat nog in de schaduw. Het HELLP-syndroom heeft gemeenschappelijke kenmerken met trombotische microangiopathieën (TMA’s), zoals trombotische trombocytopenische purpura (TTP) en hemolytisch-uremisch syndroom (HUS). TMA’s komen voor in diverse groepen ziekten met gemeenschappelijke kenmerken van microangiopathische hemolyse, trombocytopenie en orgaanschade als gevolg van microtrombi. Bij TTP veroorzaakt een genetisch defect van, of zoals in de overgrote meerderheid van de gevallen, verworven auto-antilichamen tegen een desintegrine en metalloproteïnase met thrombospondine type 1 motief 13 (ADAMTS13), het enzym dat geactiveerde von Willebrand-factor (vWF) splitst, de vorming van ongewoon grote geactiveerde vWF-multimeren op endotheelcellen die leiden tot trombi van bloedplaatjes in kleine bloedvaten en hemolyse. Typische HUS wordt veroorzaakt door Shiga-toxine producerende bacteriële infectie (vooral Escherichia coli), terwijl atypische HUS (aHUS) verwijst naar het type TMA, waarin genetische tekortkomingen in de regulatoren van de alternatieve route van het complementsysteem ten grondslag liggen, die, in aanwezigheid van van een trigger kan de klinische ziekte veroorzaken (12, 13). De door de FDA goedgekeurde behandeling voor aHUS is de infusie van complement C5-antagonist eculizumab, die de vorming van het membraanaanvalcomplex (MAC) voorkomt (Figuur 1). Klinisch deelt HELLP dezelfde symptomen als klassieke TMA’s: hemolyse, trombocytopenie en orgaanaandoening in de lever. Afhankelijk van de gebruikte TMA-classificatie, wordt het HELLP-syndroom meestal gecategoriseerd als onderdeel van secundaire of verworven TMA’s (tabel 1).
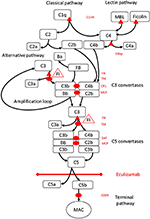
Figuur 1. Eculizumab remt de terminale route van complementactivering. Complementactivering kan worden geïnitieerd via drie activeringsroutes, die alle leiden tot de vorming van C5-convertases die het vermogen hebben om de terminale route te activeren die leidt tot de vorming van de MAC op het doeloppervlak. Deze schematische illustratie van het complementsysteem toont de meest relevante activatoren (in zwart lettertype) en remmers (in rood). De activatoren kunnen membraangebonden (ovaal) of oplosbaar (driehoekig) zijn. De alternatieve route wordt spontaan geactiveerd op alle oppervlakken die geen remming door de oplosbare regulator factor H (FH) mogelijk maken. FH fungeert als de cofactor voor inactivering van C3b naar iC3b door factor I (FI). Thrombomodulin (TM) verbetert de FH-cofactoractiviteit. Gesplitste factor B (FB) vormt samen met de activator C3b de alternatieve pathway convertase, die de capaciteit heeft om C3 in C3b te splitsen, waardoor een amplificatielus van alternatieve pathway-activering ontstaat.Klassieke route van complementactivering kan worden geïnitieerd door bijvoorbeeld binding van immuuncomplexen aan C1q, terwijl de lectine-route wordt geactiveerd door mannoses bindend lectine (MBL) of ficolines die binden aan bijvoorbeeld patronen van koolhydraten op microben. Activering van de lectineroute resulteert in mannose-geassocieerde serineproteasen 1 en 2 (MASP-1 en MASP-2, niet afgebeeld) die complementcomponenten C4 en C2 splitsen om de klassieke convertase C4bC2b te vormen. C1-remmer (C1inh) en C4bp zijn de oplosbare regulatoren van de klassieke route, terwijl membraancofactoreiwit (MCP) en complementreceptor 1 (CR1) membraangebonden regulatoren zijn van vroege complementroutes. De vorming van C5-convertases initieert de terminale route van complementactivering en splitsing van C5 in afwezigheid van oppervlaktegebonden regulatoren, vervalversnellingsfactor (DAF) en MCP. De montage van MAC wordt gereguleerd door de oppervlaktegebonden regulator CD59 (protectin). Splitsing van C3 in de vroege routes en C5 in de terminale route maakt anafylatoxinen C3a en C5a vrij en resulteert in ontsteking. Eculizumab is een gehumaniseerd recombinant antilichaam tegen het complementeiwit C5, dat de splitsing van C5 door de C5-convertases remt, waardoor de protrombotische en pro-inflammatoire effecten van complementactivering worden gereguleerd. De patiënt die in dit casusrapport wordt beschreven, werd getest op genetische mutaties in genen die coderen voor Factor H (CFH), FHR5 en MCP, CFI, CFB, THBD en ADAMTS13 (ADAMTS13), een regulator van de vWF-route van de coagulatiecascade (niet getoond). De resultaten van de genetische tests waren negatief.

Tabel 1. HELLP- en aHUS-diagnostische criteria.
In deze case study rapporteren we een patiënt met een gecompliceerde zwangerschapsgeïnduceerde TMA en het succesvolle verloop van de behandeling.
Casuspresentatie
De negenentwintigjarige primigravida werd op de zwangerschapsduur 34 + 2 jaar doorverwezen naar het Universitair ziekenhuis van Helsinki polikliniek met pijn in de bovenbuik. Aanvankelijk was haar bloeddruk matig verhoogd (133/91 mmHg) en de peilstok in de urine was positief voor proteïne. De aanvankelijk gerapporteerde pijn in de bovenbuik verbeterde geleidelijk. In de echografie had de foetus een normaal biofysisch profiel (BPP), de schatting van het gewicht was op de -2 SD-groeicurve. Cardiotocografie (CTG) was normaal. Bloedhemoglobine (Hb) was 115 g / l, bloedplaatjes 158 E9 / l (normaal bereik 150-360 E9 / l), alanineaminotransferase (ALT) was normaal (23 E / l). De urinepeilstok was positief voor eiwit (+2) en de berekende proteïnurie was 1,6 g / 24 uur. Er werd besloten om een cortisone-behandeling te starten om de longrijping van de baby te vergemakkelijken. De patiënt werd ontslagen met het plan om de volgende dag terug te komen voor controle en een tweede dosis cortison. Zoals gepland, kwam ze voor controle in zwangerschapsweek 34 + 4. De bloeddruk was 147/87 mmHg, ALT 23, bloedplaatjes 177, CTG en de BPP van de foetus in de echografie was normaal. Ze werd ontslagen en er stond weer een controle op het programma. In de middag van dezelfde dag keerde de pijn in de bovenbuik terug en werd tegen de avond gestaag erger. Ze keerde om 02.20 uur terug naar het ziekenhuis.Ze had pijn in de bovenbuik, rusteloosheid, en ze had twee keer overgegeven en voelde zich trillen. De bloeddruk was duidelijk verhoogd met 170/94 mmHg, de eiwitpeilstok in de urine was sterk positief, de ALT was verhoogd met 159, Hb 122 en het aantal bloedplaatjes 172. Ze werd opgenomen op de prenatale afdeling. Om 4 uur ’s morgens had ze hoofdpijn. Antihypertensiva werden gestart (Labetalol 100 mg driemaal). De uitscheiding van eiwit in de urine bereikte ’s nachts een piek van 13 g / 24 uur. Vervolgens begon ze te braken, had ze pijn in de bovenbuik, hoofdpijn en vertoonde de CTG-monitoring vertragingen. De patiënt werd om 7.11 uur overgebracht naar de verloskundige afdeling en aangezien de baarmoederhals drie centimeter was uitgezet, werden de foetale vliezen kunstmatig gebroken om de bevalling in te leiden. Tegelijkertijd werden de laboratoriumtesten afgerond met Hb 122, bloedplaatjes 172. Lactaatdehydrogenase (LD) was op dit moment echter duidelijk verhoogd met 1231 U / L. In de CTG gingen de vertragingen door en naarmate de bradycardie voortduurde, werd een spoedkeizersnede uitgevoerd. Mannelijk kind (1960 g, -2 SD) werd geboren om 7.25 uur met een navelstrengader pH-waarde van 7,05, BE -6,80, Apgar 1/6/8. Het bloedverlies tijdens de operatie was 400 ml.
Om 9 uur na de keizersnede waren de bloedplaatjes van de moeder laag met 49, met een Hb van 102. Tegen de middag was de ALT gestegen tot 1800, LD 3570 was het serumcreatininegehalte 153 (μmol / l), terwijl het aantal bloedplaatjes afnam tot 33. Er was een verstoring van de coagulatie, aangegeven door een laag fibrinogeengehalte (1,1 g / l, referentiewaarden 2-4 g / l) en een hoog niveau van D -dimer van fibrine (30,2 mg / l, < 0,5 mg / l). Er was wat bloeding uit de keizersnede, waarin extra hechtingen werden geplaatst.Op dat moment werden acht eenheden bloedplaatjes toegediend. Het kaliumgehalte steeg van 4,7 naar 5,6 (mmol / L). Hemolyse werd duidelijk waargenomen. Coombs-test was negatief. De uitscheiding van urine was slechts 10 ml / uur. De laboratoriumtest toonde duidelijk een ernstige ziekte aan met tekenen van schade aan zowel de nieren als de lever. Bovendien was er een verstoring van het stollingssysteem, waarbij tegelijkertijd een aanzienlijke stolling en duidelijke fibrinolyse werd waargenomen. Magnesiumsulfaatinfusie werd gestart vanwege hyperreflexie, die wordt beschouwd als een voorspellend teken van convulsies, een ernstige complicatie van pre-eclampsie. Er werd begonnen met intraveneuze dexamethason 10 mg en de patiënt werd overgebracht naar de intensive care (ICU).
Verder werden laboratoriumtests uitgevoerd voor differentiële diagnostische doeleinden van andere medische noodgevallen (tabel 2). De activiteit van ADAMTS13 was normaal 62% (40–130%), exclusief TTP. Serumcomplement C3 (0,52 g / l, 0,71-1,41 g / l) en C4 (0,07 g / l, 0,12-0,34 g / l) niveaus waren laag. Het niveau van oplosbaar terminaal complex van het complement (C5b-9, 971 ng / ml, < 366 ng / ml) was verhoogd op de eerste postpartumdag. Antifosfolipide-antilichamen werden niet gedetecteerd, de infectie-serologie met betrekking tot hepatitis B en C en HIV was negatief. Uit ontlastingsmonster testten de pathogenen die typische HUS veroorzaakten negatief.

Tabel 2. Tijdlijn van de ziektediagnostiek en -behandeling.
De patiënt werd behandeld met plasma-uitwisselingsbehandeling op de eerste en tweede postpartumdag en werd in de loop van haar behandeling driemaal gehemodialyseerd (dag 2, 4 en 6 postpartum).
Op de derde postpartumdag was de patiënt stabiel en werd hij teruggebracht naar de verkoeverkamer van het vrouwenziekenhuis waar observatie plaatsvond. en symptomatische therapie werd voortgezet. Hypertensie werd behandeld met amlodipine 10 mg tweemaal daags en Labetalol 200 mg driemaal daags. Op de vierde postpartumdag bleven de bloedplaatjes afnemen en werd de patiënt gediagnosticeerd met aHUS. Vaak werd de differentiële diagnose met het HELLP-syndroom en aHUS ligt in het spontane herstel van HELLP-patiënten, meestal op de derde dag postpartum. Behandeling met eculizumab werd gestart (900 mg IV). ent kreeg een pneumokokkenvaccinatie en het profylactische antibioticum (penicilline) werd gestart. De patiënte kreeg in totaal vier wekelijkse doses eculizumab (900 mg) en ze begon snel te herstellen. Ze had geen verdere hemodialyse nodig na haar derde hemodialyse op de zesde postpartumdag (Figuur 2). De nierfunctie corrigeerde geleidelijk, het aantal bloedplaatjes steeg en de hemolyse verdween. Vier weken postpartum werden de plasmaspiegels van C3 en C4 genormaliseerd.
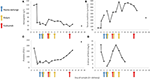
Figuur 2. Geselecteerde laboratoriumwaarden waargenomen tijdens de vroege stadia van de ziekte en de timing van plasma-uitwisseling, hemodialyse en toediening van eculizumab. In paneel (A) wordt de ontwikkeling van bloedhemoglobinemetingen weergegeven, in paneel (B) het serumcreatininegehalte, in paneel (C) het aantal bloedplaatjes en in paneel (D) D-dimeer van fibrinewaarden gedurende de 17 dagen follow-up periode.
Bij genetische tests werden geen bekende genpolymorfismen geïdentificeerd. Ze werd getest op mutaties in complementregulatoren Factor H (CFH), Factor H-gerelateerd proteïne 5 (FHR5) en membraancofactoreiwit (MCP), complementaire inactivatorfactor I (CFI), alternatieve pathway-activator factor B (CFB ), en de volgende componenten van de coagulatiecascade: ADAMTS13, trombomoduline (THBD), en een intracellulair enzym, diacylglycerol kinase E (DGKE), waarvan de mutaties een bekende oorzaak zijn van aHUS (14). Bovendien werden antilichamen tegen factor H ook niet gedetecteerd. Er werd geen C4-deficiëntie gedetecteerd.
Samenvattend, onze patiënt had ernstige pre-eclampsie en voldeed aan de diagnostische criteria voor het HELLP-syndroom. Hoewel genetische tests voor aHUS negatief bleven, suggereerden het klinische verloop van de ziekte (vooral ernstig acuut nierletsel) en de respons op de behandeling (vooral eculizumab) dat onze patiënt door zwangerschap veroorzaakte aHUS had.
Discussie
De hierboven beschreven primigravida werd gediagnosticeerd met ernstige pre-eclampsie, HELLP-syndroom en door zwangerschap geïnduceerde aHUS. Er werden geen bekende genmutaties ontdekt die vatbaar zouden kunnen zijn voor aHUS. Differentiële diagnose tussen typen TMA, TTP, HUS / aHUS en secundaire TMA’s zoals het HELLP-syndroom is belangrijk. Vooral TTP moet in een vroeg stadium worden geïdentificeerd, aangezien de ziekte wordt behandeld met snelle dagelijkse plasma-uitwisseling tot remissie (15).
Momenteel kunnen laboratoriumanalysemethoden voor het testen van genetische mutaties die mogelijk aHUS veroorzaken, mutaties aantonen in slechts tot 40-60% van de aHUS-gevallen, waardoor de mogelijkheid van vals-negatieve gevallen overblijft. Daarom sluit een negatief testresultaat voor mutaties een echte aHUS niet uit (16).Zelden is aHUS geïnduceerd na zwangerschap en bevalling. In deze gevallen ontwikkelde gedurende de volgende drie jaar ~ 50% chronische nierziekte (CKD), sommige zelfs terminale nierziekte (ESKD). Wanneer genetische mutaties werden waargenomen, kan tot 85% CKD of ESKD ontwikkelen (17).
Het is algemeen aanvaard dat bij hypertensieve zwangerschapsstoornissen, placenta-ontsteking leidt tot endotheeldisfunctie. Als de integriteit van het endotheel wordt verstoord, resulteert dit in activering van complement en coagulatie (18). Er wordt ook verondersteld dat een verstoord endotheel van de moeder bijdraagt aan de moederlijke morbiditeit op latere leeftijd die gepaard gaat met ernstige pre-eclampsie en andere hypertensieve zwangerschapsstoornissen (2, 19). Van beschadigd endotheel is aangetoond dat het abnormaal functioneert, zelfs jaren nadat de eerste diagnostische symptomen zijn verdwenen (20-23).
Bij tot 46% van de HELLP-patiënten zijn genmutaties beschreven in de regulatoren van de alternatieve route. van het complementsysteem (24, 25). In de vroege stadia van de zwangerschap, wanneer de placenta zich ontwikkelt, wordt activering van het complementsysteem waargenomen bij verhoogde niveaus van Bb in het serum bij patiënten die later pre-eclampsie ontwikkelden (26). Activering van het complementsysteem is waargenomen bij ernstige pre-eclampsie en het HELLP-syndroom, en er zijn verhoogde niveaus van terminaal complex (C5b-9) waargenomen in de urine van patiënten met ernstige pre-eclampsie. Bij patiënten met het HELLP-syndroom werd een verhoogde activering van het complementsysteem aangetoond door functionele tests en bovendien door tekorten aan expressie in CD55 en CD59, wat leidde tot verminderde regulatie en verergerde activering van het complementsysteem (27-29).
Er zijn veel overeenkomsten tussen het HELLP-syndroom en aHUS. Bij beide aandoeningen is er duidelijk sprake van endotheelstoornis, gevolgd door complement- en coagulatie-activering. Bij ernstige pre-eclampsie en het HELLP-syndroom zou eculizumab, gegeven bij de vroege tekenen van ernstige ziekte en TMA, gunstig zijn voor de bescherming van de nieren en het maternale endotheel (30). Het behoud van de integriteit van het endotheel kan de patiënt mogelijk beschermen tegen gezondheidsrisico’s op de lange termijn, zoals hart- en vaatziekten. Bij zwangerschapsgerelateerde TMA’s verdwijnen de klinische bevindingen van hemolyse en trombocytopenie doorgaans in ~ 3 dagen. Als de ziekteactiviteit langer duurt, moet de differentiële diagnostiek worden voortgezet en alleen dan wordt een alternatieve behandeling (bijv. Eculizumab) overwogen. Eerdere introductie van de behandeling met eculizumab zou vrouwen ten goede komen door nierbeschadiging te voorkomen en de turbulentie in het endotheel en systemische ontsteking te minimaliseren. Eculizumab, vroeg genoeg gegeven en slechts één of twee doses, zou mogelijk voldoende kunnen zijn om de turbulentie te stoppen en voldoende om de cascade van gebeurtenissen te stoppen (31). Enerzijds is eculizumab een erg duur medicijn, maar anderzijds blijven de kosten van intensieve zorg, plasma-uitwisseling, hemodialyse, mogelijke niertransplantatie en niet te vergeten de emotionele gevolgen voor de moeders en gezinnen onschatbaar.
Concluderend, onze patiënt was ernstig ziek en ervoer hemolyse, stoornissen in de stolling, leverschade en nierfalen, waarvoor opname op de IC en hemodialyse nodig was. Het is mogelijk dat eculizumab, indien eerder gestart, bij de eerste tekenen van het HELLP-syndroom, gunstig zou zijn geweest tijdens het latere verloop van de ziekte, waarbij het mogelijk de nierbeschadiging verlichtte en zo de noodzaak van hemodialyse en later CKD verhinderde. Kunnen we daarom in dit tijdperk van moderne immunologische geneeskunde meer doen voor de moeders en gezinnen dan alleen maar wachten en er het beste van hopen?
Ethische verklaring
Ethische beoordeling en goedkeuring was niet vereist voor het onderzoek met menselijke deelnemers in overeenstemming met de lokale wetgeving en institutionele vereisten. De patiënten / deelnemers gaven hun schriftelijke geïnformeerde toestemming om deel te nemen aan deze studie.
Bijdragen van de auteur
AL en JH-E ontwikkelden het idee voor het manuscript en schreven het manuscript. JH-E en MH waren betrokken bij de diagnostische en therapeutische zorg van de patiënt. Alle auteurs hebben het manuscript beoordeeld en bewerkt en de definitieve versie goedgekeurd voor publicatie.
Belangenverstrengeling
De auteurs verklaren dat het onderzoek is uitgevoerd zonder enige commerciële of financiële relatie die kan worden opgevat als een mogelijk belangenconflict.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Ongunstige zwangerschapsuitkomsten en toekomstige cardiovasculaire aandoeningen van de moeder. Clin Cardiol. (2018) 41: 239-46. doi: 10.1002 / clc.22887
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” grote verloskundige syndromen ”worden geassocieerd met aandoeningen van diepe placentatie. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Systemische inflammatoire priming bij normale zwangerschap en pre-eclampsie: de rol van circulerende syncytiotrofoblastmicrodeeltjes. J Immunol. (2007) 178: 5949-56. doi: 10.4049 / jimmunol.178.9.5949
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Update van syncytiotrofoblast-afgeleide extracellulaire vesikels bij normale zwangerschap en pre-eclampsie. J Reprod Immunol. (2017) 119: 98-106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
10. Weinstein L. Syndroom van hemolyse, verhoogde leverenzymen en laag aantal bloedplaatjes count: een ernstig gevolg van hypertensie tijdens de zwangerschap. Ben J Obstet Gynecol. (1982) 142: 159-67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Onderscheid tussen ernstig HELLP-syndroom en trombotische microangiopathie, trombotische trombocytopenische purpura en andere imitatoren. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68-72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Aantasting van de endotheelfunctie bij vrouwen met een voorgeschiedenis van pre-eclampsie: een indicator van cardiovasculair risico. Ben J Physiol Hoor Circ Physiol. (2004) 286: 1-3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Personeel AC. De endotheelfunctie en circulerende biomarkers zijn verstoord bij vrouwen en kinderen na pre-eclampsie. Hypertensie. (2011) 58: 63-9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
23. Stanhewicz AE. Residuele vasculaire disfunctie bij vrouwen met een voorgeschiedenis van pre-eclampsie. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062-R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. Kiemlijnmutaties in de alternatieve route van complement maken vatbaar voor het HELLP-syndroom. JCI inzicht. (2018) 3: 0-13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, een nieuwe potentiële behandeling voor acuut nierletsel geassocieerd met pre-eclampsie / HELLP-syndroom. BMJ zaakrep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | CrossRef Volledige tekst | Google Scholar