Fysische geologie
De overgrote meerderheid van de mineralen die de rotsen van de aardkorst vormen, zijn silicaatmineralen. Deze omvatten mineralen zoals kwarts, veldspaat, mica, amfibool, pyroxeen, olivijn en een grote verscheidenheid aan kleimineralen. De bouwsteen van al deze mineralen is de silica-tetraëder, een combinatie van vier zuurstofatomen en één siliciumatoom. Deze zijn zo gerangschikt dat door de zuurstofatomen getrokken vlakken een tetraëder vormen (figuur 2.6). Aangezien het siliciumion een lading heeft van +4 en elk van de vier zuurstofionen een lading heeft van –2, heeft de silica tetraëder een nettolading van –4.
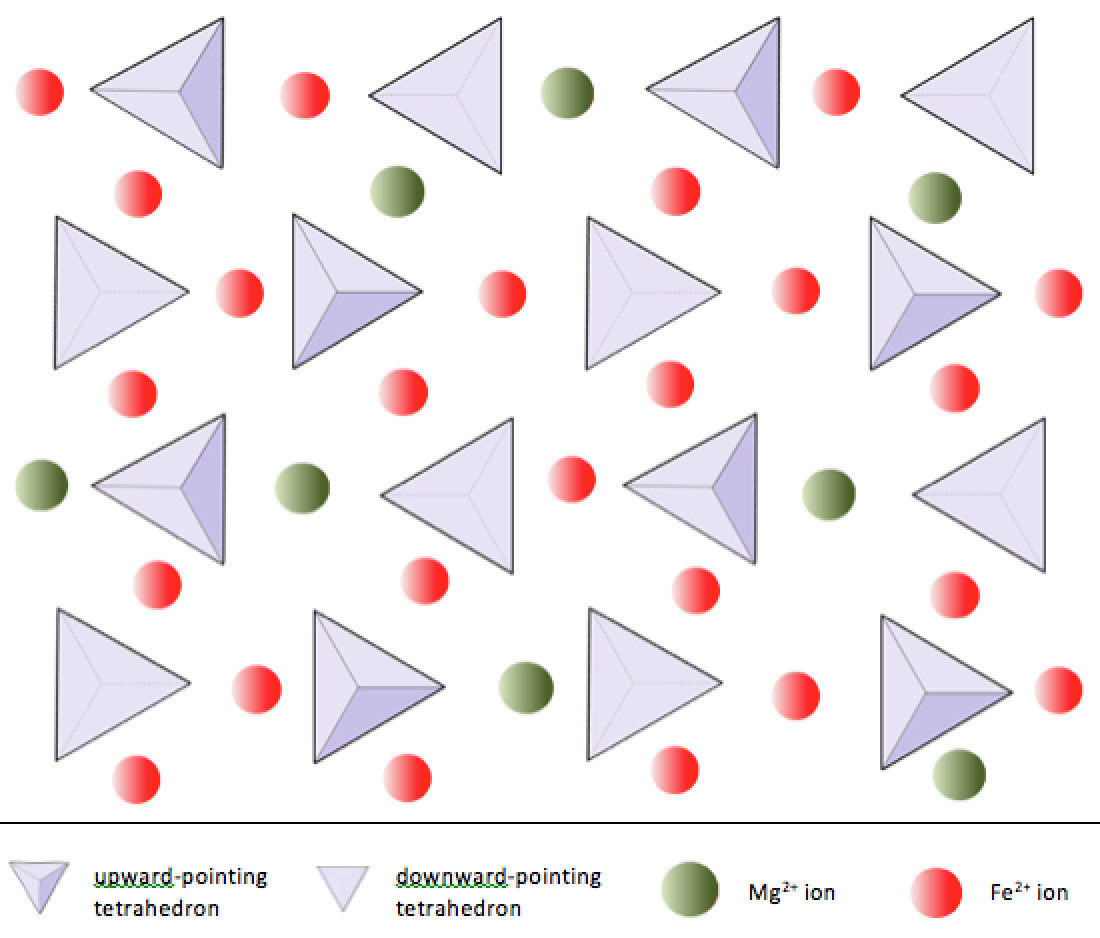
In silicaatmineralen zijn deze tetraëders gerangschikt en op verschillende manieren met elkaar verbonden, van afzonderlijke eenheden tot complexe kaders (figuur 2.9). De eenvoudigste silicaatstructuur, die van het mineraal olivijn, bestaat uit geïsoleerde tetraëders die zijn gebonden aan ijzer- en / of magnesiumionen. In olivijn wordt de –4 lading van elke silica-tetraëder in evenwicht gehouden door twee tweewaardige (d.w.z. +2) ijzer- of magnesiumkationen. Olivijn kan ofwel Mg2SiO4 of Fe2SiO4 zijn, of een combinatie van de twee (Mg, Fe) 2SiO4. De tweewaardige kationen van magnesium en ijzer zijn vrij dichtbij in straal (0,73 versus 0,62 Angström). Vanwege deze gelijkenis in grootte en omdat ze beide tweewaardige kationen zijn (beide hebben een lading van +2), kunnen ijzer en magnesium elkaar gemakkelijk vervangen in olivijn en in veel andere mineralen.
| Tetraëderconfiguratie | Voorbeeldmineralen | |
|---|---|---|
 |
Geïsoleerd (nesosilicaten) | Olivijn, granaat, zirkoon, kyaniet |
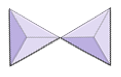 |
Paren (sorosilicaten) | Epidoot, zoisiet |
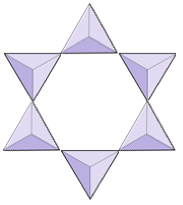 |
Ringen (cyclosilicaten) | Toermalijn |
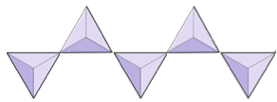 |
Enkele ketens (inosilicaten) | Pyroxenen, wollastoniet |
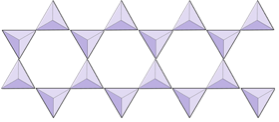 |
Dubbele ketens (inosilicaten) | Amfibolen |
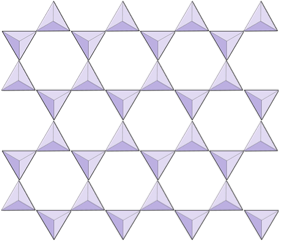 |
Vellen (phyllosilicaten) | Micas, kleimineralen, serpentijn, chloriet |
| 3-dimensionaal structuur | Framework (tectosilicates) | Veldspaat, kwarts, zeoliet |
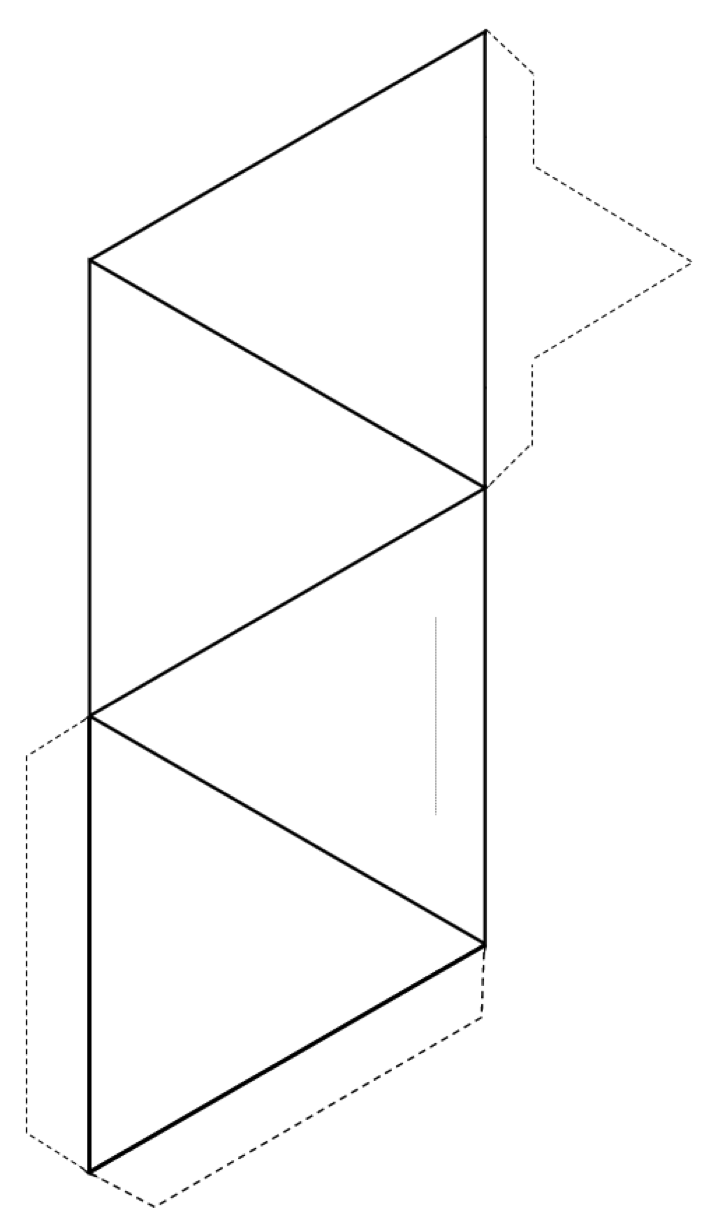
Oefening 2.3 Maak een tetraëder
Knip rond de buitenkant van de vorm (ononderbroken lijnen en stippellijnen) en vouw vervolgens langs de ononderbroken lijnen om een tetraëder te vormen.
Als je lijm of tape hebt, zet dan de lipjes naar de tetraëder om het bij elkaar te houden. Als je geen lijm of plakband hebt, maak dan een plak langs de dunne grijze lijn en steek het puntige lipje in de gleuf.
Als je dit in een klaslokaal doet, probeer dan je tetraëder met anderen te verbinden in paren, ringen, enkele en dubbele kettingen, platen en zelfs driedimensionale raamwerken.
In olivijn, in tegenstelling tot de meeste andere silicaatmineralen, zijn de silica-tetraëders niet aan elk andere. Ze zijn echter gebonden aan ijzer en / of magnesium, zoals weergegeven in figuur 2.10.
Zoals al opgemerkt, de +2 ionen van ijzer en magnesium zijn vergelijkbaar in grootte (hoewel niet helemaal hetzelfde). Hierdoor kunnen ze elkaar vervangen in sommige silicaatmineralen. In feite hebben de gewone ionen in silicaatmineralen een breed scala aan groottes, zoals weergegeven in figuur 2.11. Alle weergegeven ionen zijn kationen, behalve zuurstof. Merk op dat ijzer zowel kan bestaan als een +2 ion (als het twee elektronen verliest tijdens ionisatie) of een +3 ion (als het er drie verliest). Fe2 + staat bekend als ferro-ijzer. Fe3 + staat bekend als ijzerijzer. Ionische stralen zijn cruciaal voor de samenstelling van silicaatmineralen, dus we verwijzen opnieuw naar dit diagram.

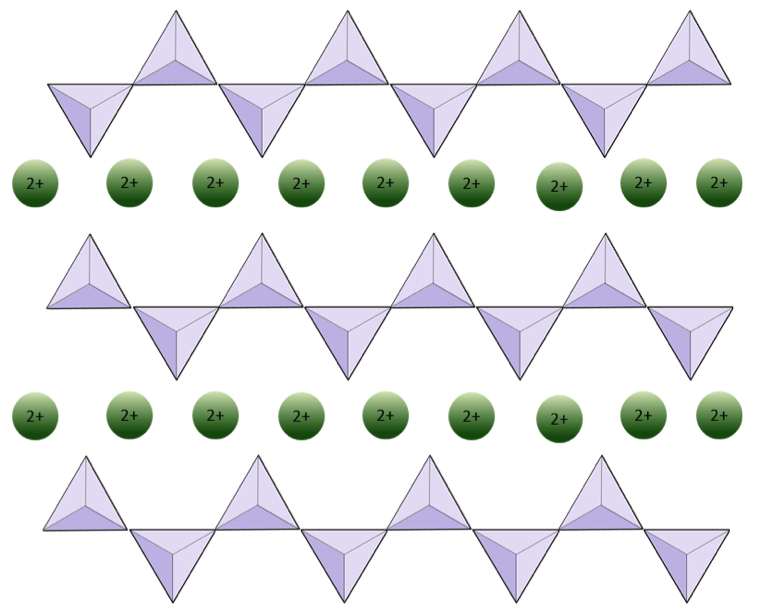
De structuur van de enkelketen silicaatpyroxeen wordt getoond in figuren 2.12 en 2.13. In pyroxeen zijn silica-tetraëders met elkaar verbonden in een enkele keten, waarbij één zuurstofion van elke tetraëder wordt gedeeld met de aangrenzende tetraëder, waardoor er minder zuurstofatomen in de structuur zijn.Het resultaat is dat de zuurstof-siliciumverhouding lager is dan bij olivijn (3: 1 in plaats van 4: 1), en de nettolading per siliciumatoom kleiner is (–2 in plaats van –4), aangezien er minder kationen nodig zijn om die kosten in evenwicht te brengen. Pyroxeencomposities zijn van het type MgSiO3, FeSiO3 en CaSiO3, of een combinatie hiervan. Pyroxeen kan ook worden geschreven als (Mg, Fe, Ca) SiO3, waarbij de elementen tussen haakjes in elke verhouding aanwezig kunnen zijn. Met andere woorden, pyroxeen heeft één kation voor elke silica-tetraëder (bijvoorbeeld MgSiO3), terwijl olivijn er twee heeft (bijvoorbeeld Mg2SiO4). Omdat elk siliciumion +4 is en elk zuurstofion –2, geven de drie zuurstofatomen (–6) en het ene silicium (+4) een nettolading van –2 voor de enkele keten van silica-tetraëders. In pyroxeen balanceert het enige tweewaardige kation (2+) per tetraëder die –2 lading. In olivijn zijn twee tweewaardige kationen nodig om de lading -4 van een geïsoleerde tetraëder in evenwicht te brengen.
De structuur van pyroxeen is meer “tolerant” dan die van olivijn – wat betekent dat kationen met een groter bereik van ionstralen kunnen erin passen. Daarom kunnen pyroxenen ijzer (straal 0,63 Å) of magnesium (straal 0,72 Å) of calcium (straal 1,00 Å) kationen hebben.
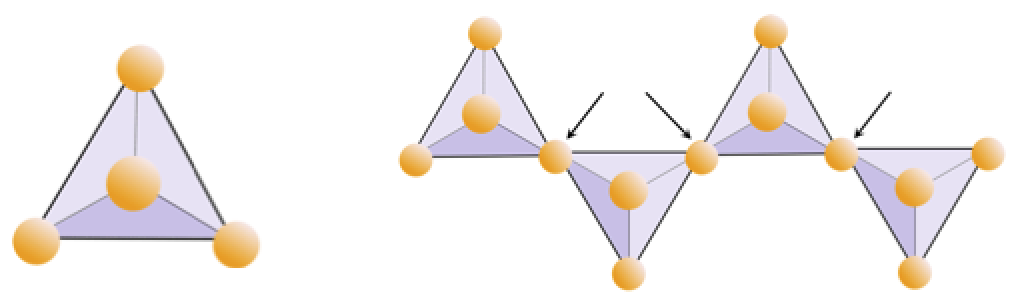
Oefening 2.4 Zuurstoftekort
Het onderstaande diagram stelt een enkele keten in een silicaatmineraal voor. Tel het aantal tetraëders versus het aantal zuurstofionen (gele bollen). Elke tetraëder heeft één siliciumion, dus dit zou de verhouding Si tot O moeten geven in silicaten met een enkele keten (bijv. Pyroxeen).
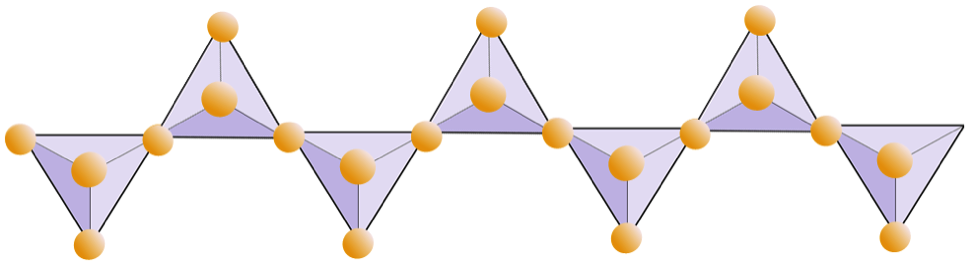
Het onderstaande diagram stelt een dubbele ketting in een silicaatmineraal voor. Tel opnieuw het aantal tetraëders versus het aantal zuurstofionen. Dit zou u de verhouding moeten geven van Si tot O in silicaten met dubbele ketens (bijv. Amfibool).
In amfiboolstructuren zijn de silica-tetraëders verbonden in een dubbele keten die een zuurstof-siliciumverhouding heeft die lager is dan die van pyroxeen, en daarom zijn er nog minder kationen nodig om de lading in evenwicht te brengen. Amfibool is zelfs toleranter dan pyroxeen en de samenstelling kan erg complex zijn. Hornblende kan bijvoorbeeld natrium, kalium, calcium, magnesium, ijzer, aluminium, silicium, zuurstof, fluor en het hydroxylion (OH–) bevatten.
In mica-structuren silica tetraëders zijn gerangschikt in continue vellen, waarbij elke tetraëder drie zuurstofanionen deelt met aangrenzende tetraëders. Er zijn zelfs meer zuurstofatomen tussen aangrenzende tetraëders en daarom zijn er minder ladingsbalancerende kationen nodig voor bladsilicaatmineralen. De hechting tussen platen is relatief zwak, en dit verklaart de goed ontwikkelde eenrichtingssplitsing (figuur 2.14). Biotietmica kan ijzer en / of magnesium bevatten en dat maakt het een ferromagnesiaansilicaatmineraal (zoals olivijn, pyroxeen en amfibool). Chloriet is een ander soortgelijk mineraal dat gewoonlijk magnesium bevat. In muscovietmica zijn de enige aanwezige kationen aluminium en kalium; daarom is het een non-ferromagnesiaans silicaatmineraal.

Behalve muscoviet, biotiet en chloriet zijn er veel andere bladsilicaten (of phyllosilicaten) die bestaan meestal als fragmenten ter grootte van een klei (dwz minder dan 0,004 mm). Deze omvatten de kleimineralen kaoliniet, illiet en smectiet, en hoewel ze moeilijk te bestuderen zijn vanwege hun zeer kleine formaat, zijn ze buitengewoon belangrijke componenten van gesteenten en vooral van bodems.
Al het bladsilicaat mineralen hebben ook water in hun structuur.
Silica tetraëders zijn gebonden in driedimensionale raamwerken in zowel de veldspaat als kwarts. Dit zijn niet-ferromagnesische mineralen – ze bevatten geen ijzer of magnesium.Naast silica tetraëders omvatten veldspaat de kationen aluminium, kalium, natrium en calcium in verschillende combinaties. Kwarts bevat alleen silica tetraëders.
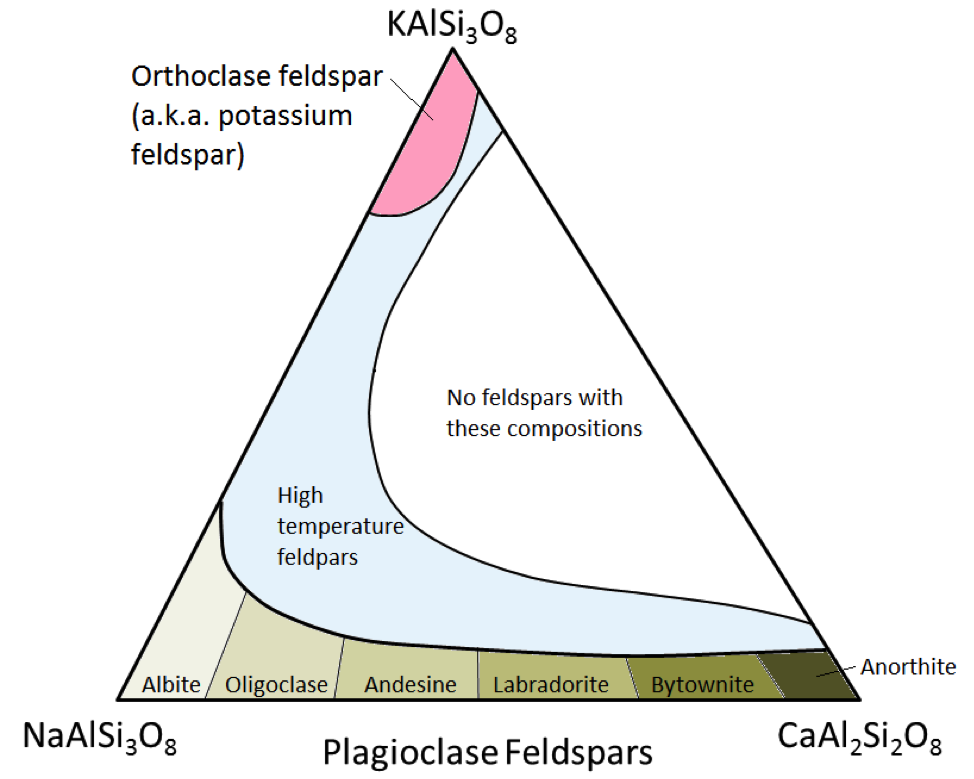
De drie belangrijkste veldspaatmineralen zijn kaliumveldspaat (ook bekend als K-veldspaat of K-spar) en twee soorten plagioklaasveldspaat: albiet (alleen natrium) en anorthiet (alleen calcium) . Zoals het geval is voor ijzer en magnesium in olivijn, is er een continue reeks samenstellingen (reeks vaste oplossingen) tussen albiet en anorthiet in plagioklaas. Dit komt doordat de calcium- en natriumionen bijna identiek zijn in grootte (1,00 Å versus 0,99 Å). Elke tussenliggende compositie tussen CaAl2Si3O8 en NaAlSi3O8 kan bestaan (Figuur 2.15). Dit is een beetje verrassend, want hoewel ze qua grootte erg op elkaar lijken, hebben calcium- en natriumionen niet dezelfde lading (Ca2 + versus Na +). Dit probleem wordt verklaard door de overeenkomstige vervanging van Al3 + voor Si4 +. Daarom is albiet NaAlSi3O8 (één Al en drie Si), terwijl anorthiet CaAl2Si2O8 is (twee Al en twee Si), en plagioklaasveldspaten met een tussenliggende samenstelling hebben tussenliggende hoeveelheden Al en Si. Dit wordt een “gekoppelde substitutie” genoemd.
De tussenliggende samenstelling plagioklaas veldspaat zijn oligoklaas (10% tot 30% Ca), andesine (30% tot 50% Ca), labradoriet (50% tot 70%) % Ca), en bytownite (70% tot 90% Ca). K-veldspaat (KAlSi3O8) heeft een iets andere structuur dan die van plagioklaas, vanwege de grotere afmeting van het kaliumion (1,37 Å) en vanwege deze grote afmeting , kalium en natrium vervangen elkaar niet gemakkelijk, behalve bij hoge temperaturen. Deze veldspaten met hoge temperatuur worden waarschijnlijk alleen in vulkanisch gesteente aangetroffen, omdat opdringerige stollingsgesteenten langzaam genoeg afkoelen tot lage temperaturen zodat de veldspaat verandert in een van de lagere temperatuur formulieren.
In kwarts (SiO2) zijn de silica tetraëders gebonden in een “perfect” driedimensionaal raamwerk. Elke tetraëder is gebonden aan vier andere tetraëders (met zuurstof gedeeld op elke hoek van elke tetraëder), en als resultaat is de verhouding van silicium tot zuurstof 1: 2. Aangezien het ene siliciumkation een lading van +4 heeft en de twee zuurstofanionen elk een lading van –2 hebben, is de lading in evenwicht. Er is geen aluminium of een van de andere kationen zoals natrium of kalium nodig. De hardheid en het ontbreken van splitsing in kwarts zijn het gevolg van de sterke covalente / ionische bindingen die kenmerkend zijn voor de silica-tetraëder.
Oefening 2.5 Ferromagnesiaansilicaten?
Silicaatmineralen worden geclassificeerd als ferromagnesian of niet-ferromagnesian, afhankelijk van het feit of ze al dan niet ijzer (Fe) en / of magnesium (Mg) in hun formule hebben. Hieronder vindt u een aantal mineralen en hun formules. Geef voor elk aan of het een ferromagnesiaansilicaat is.
| Mineraal | Formule | Ferromagnesiaansilicaat? |
|---|---|---|
| olivijn | (Mg, Fe) 2SiO4 | |
| pyriet | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| pyroxene | MgSiO3 | |
| hematiet | Fe2O3 | |
| orthoklaas | KAlSi3O8 | |
| quartz | SiO2 |
| Mineraal | Formule * | Ferromagnesiaansilicaat? |
|---|---|---|
| amfibool | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetiet | Fe3O4 | |
| biotite | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomiet | (Ca, Mg) CO3 | |
| granaat | Fe2Al2Si3O12 | |
| serpentijn | Mg3Si2O5 (OH) 4 |
* Sommige van de formules, vooral de meer gecompliceerde, zijn vereenvoudigd.
- Een ångström is de eenheid die gewoonlijk wordt gebruikt voor de uitdrukking van atomaire -schaal afmetingen. Een ångström is 10–10 m of 0,0000000001 m. Het symbool voor een ångström is Å. ↵