Grenzen in cellulaire en infectie-microbiologie
Inleiding
Staphylococcus aureus is een belangrijke menselijke ziekteverwekker die wordt geïsoleerd uit ziekenhuispatiënten wereldwijd, die zowel ziekenhuisinfecties als buiten de gemeenschap opgelopen infecties veroorzaakt ( Lowy, 1998). Deze ziekteverwekker is de etiologische veroorzaker van verschillende systemische infecties, die de huid en de weke delen aantasten, evenals het bewegingsapparaat en de bloedsomloop (Lowy, 1998; Changchien et al., 2016). Er werd gemeld dat S. aureus kan overleven in macrofagen die zijn afgeleid van menselijke monocyten (Kubica et al., 2008). De virulentie van S. aureus is nauw verbonden met een verscheidenheid aan uitgescheiden enzymen en toxines die door de bacteriën worden geproduceerd (Otto, 2014). Hemolysine, leukocidine (Panton-Valentine leukocidin, PVL) en toxisch shocksyndroom toxine-1 (TSST-1), die de beschadiging van het rode celmembraan vergemakkelijken, de fagocytische functie van leukocyten beschadigen en het toxische shocksyndroom induceren, zijn van cruciaal belang voor de pathogene processen van S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube en Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Recente studies hebben aangetoond dat hemolysine ook deelneemt aan de vorming van de S. aureus biofilm (den Reijer et al., 2016). De toenemende prevalentie van multiresistente S. aureus-stammen in ziekenhuis- en gemeenschapsomgevingen verhoogt de gevaren van S. aureus verder en vormt een serieuze uitdaging voor klinische therapie (Voss en Doebbeling, 1995; Evangelista Sde en de Oliveira, 2015).
Recent zijn in ons ziekenhuis een aantal stammen gevonden die behoren tot een klasse van S. aureus met een incompleet hemolytisch fenotype (SIHP). Hemolyse veroorzaakt door deze SIHP-stammen verschilt significant van de volledige hemolytische ring (β-hemolytisch fenotype) die wordt geproduceerd in andere S. aureus-stammen. Deze SIHP-stammen zijn echter nog niet volledig geïdentificeerd en gekarakteriseerd. Om de microbiologische kenmerken van deze SIHP-stammen te onderzoeken, hebben we 60 SIHP-stammen verzameld en deze bestudeerd met behulp van meerdere criteria, waaronder hemolytisch fenotype, expressie van het hemolysinegen, kenmerken van geneesmiddelresistentie en virulentie. Deze studie toont aan dat SIHP’s methicillineresistente stammen zijn die β-hemolysine in hoge mate tot expressie brengen en een hoog virulentiepotentieel bezitten.
Materialen en methoden
Bacteriestammen
Zestig SIHP stammen werden geïsoleerd uit patiënten die tussen 2013 en 2015 waren opgenomen in het tweede aangesloten ziekenhuis van de Soochow University. Van elke patiënt werden dubbele monsters genomen voor analyse. Deze isolaten werden vervolgens gekweekt op Columbia schapenbloedagarplaten (CHROMagar Company, Shanghai, China) bij 35 ° C in een atmosfeer die 5% C02 (v / v) bevatte. De identiteit van de stammen als S. aureus werd bevestigd met behulp van het Phoenix-100 geautomatiseerde microbiologische systeem (Becton, Dickinson and Company, VS). De controlestammen S. aureus, met volledig hemolytisch fenotype, werden in dezelfde periode uit patiënten in ons ziekenhuis geïsoleerd. Hier werd S. aureus met het volledige hemolytische fenotype SCHP-stammen genoemd. De S. aureus ATCC25923-referentiestam (Shanghai Center for Clinical Laboratory, China) heeft het volledige hemolytische fenotype en fungeerde ook als controlestam. De Medical Ethics Committee of Second Affiliated Hospital of Soochow University keurde deze studie goed en alle isolaten werden verzameld met toestemming van de patiënt in deze studie.
Vergelijkende analyses van onvolledig hemolytisch fenotype
De S. aureus stammen werden gekweekt op commerciële bloedagarplaten van verschillende bedrijven (CHROMagar, Autobio Diagnostics Co., Ltd., China en BioMérieux, China), evenals zelfgemaakte schapenbloedagarplaten met Columbia-bloedagar-poeder (OXIDE, VK). De bacteriën werden gedurende 24 uur gekweekt bij 35 ° C in een atmosfeer die 5% CO2 (v / v) bevatte en ondergingen daarna een seriële passage. Het hemolytische fenomeen werd vervolgens waargenomen. Klinisch geïsoleerde stammen met volledig hemolytisch fenotype en de ATCC25923-referentiestam werden ook waargenomen als een controle voor vergelijkende analyses.
Bepaling van de mRNA-niveaus van vier hemolysine-genen van S. aureus met behulp van omgekeerde transcriptie Real-time kwantitatief PCR (qPCR)
Totale RNA-extractie van de SIHP en de ATCC25923-referentiestam werd uitgevoerd zoals eerder beschreven (Qin et al., 2014). Aanvankelijk werden de cellen gelyseerd met lysostaphine, lysozym en proteïnase K. RNA werd vervolgens geëxtraheerd en gezuiverd met behulp van RNeasy Mini Kit (Qiagen) volgens het aanbevolen protocol van de fabrikant. RNA-kwaliteit en concentratie werden geëvalueerd met behulp van de NanoDrop1000. RNA was vervolgens omgekeerd – getranscribeerd naar cDNA met behulp van een reverse transcriptiekit (Thermo Fisher Scientific Inc., VS) volgens de instructies van de fabrikant.In het kort werd qPCR als volgt uitgevoerd: pre-denaturatie bij 94 ° C gedurende 3 minuten, denaturatie bij 94 ° C gedurende 30 seconden, annealing bij 52 ° C gedurende 30 seconden, verlenging bij 72 ° C gedurende 40 seconden, in totaal 45 cycli . Elk monster had drie technische en drie biologische herhalingen. Het transcriptieprofiel van elk van de vier hemolysinegenen en het 16s-rRNA-gen werd bepaald met behulp van de 2 − ΔΔCt-methode. Het transcriptieniveau werd bepaald ten opzichte van de expressie van het 16s rRNA-gen. De sequenties van vier hemolysine-genen (hla, hlb, hlgC en hld) werden opgehaald uit de GenBank-database. Primer 5.0-software werd gebruikt om de primers te ontwerpen (tabel 1) en deze primers werden gesynthetiseerd door Sangon Biotech Co., Ltd. (Shanghai, China).
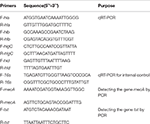
Tabel 1. Primers gebruikt in dit onderzoek.
SPSS 17.0 werd gebruikt voor data-analyse. Meetgegevens worden weergegeven als x ̄ ± s. T-test voor twee onafhankelijke monsters werd gebruikt om de relatieve expressie van elk van de vier hemolysinegenen te vergelijken. Statistische significantie werd gedefinieerd als p < 0.05.
Detectie van α-hemolysine (Hla) expressie door Western Blot
De concentratie van de SIHP en de referentiestam S. aureus ATCC25923 werden met behulp van een troebelheidsmeter op 5,0 McFarland gebracht. Totaal eiwit werd vervolgens uit elk monster geëxtraheerd, op dezelfde concentratie ingesteld en onderging elektroforese op een SDS-PAGE-gel. De eiwitten werden vervolgens overgebracht naar een nitrocellulosemembraan en het membraan werd gedurende 1 uur geblokkeerd met 5% magere melk. Geiten-anti-stafylokokken α-hemolysine polyklonale antilichamen (Abcam) werden toegevoegd in een eindconcentratie van 2 μg / ml. Het reactiemengsel werd vervolgens een nacht bij 4 ° C geïncubeerd. Nadat het membraan was gewassen, werden 1: 1000 verdunde HRP-gelabelde konijnen-anti-geit-IgG-antilichamen toegevoegd en 2 uur bij 37 ° C geïncubeerd. Ten slotte werden chemiluminescerende substraten toegevoegd voor kleurontwikkeling. De expressie van α-hemolysine werd uiteindelijk waargenomen onder de imager.
Antimicrobiële gevoeligheidstest van SIHP
De microtiter-bouillonverdunningsmethode werd gebruikt om antimicrobiële gevoeligheidsscreening uit te voeren. De procedure werd uitgevoerd volgens de operationele handleiding van het Phoenix-100 geautomatiseerde microbiologie-systeem. De resultaten van deze screening werden geïnterpreteerd aan de hand van de M100-S24-criteria die zijn geïntroduceerd door het Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). Methicilline-resistente S. aureus (MRSA) status werd bepaald met behulp van de MIC (minimale remmende concentratie) van twee antibiotica. Voor de SIHP-stammen was ≥ 4 μg / ml de MIC voor oxallicine en ≥ 8 μg / ml was de MIC voor cefoxitine.
Detectie van mecA- en tst-genen
Alle 60 SIHP stammen werden getest op het geneesmiddelresistentie-gen mecA en virulentiegen tst. Kokende extractie van genomisch DNA werd uitgevoerd na cellulaire lysis met lysostafine. De mecA- en tst-genen werden vervolgens geamplificeerd uit het genomische DNA met behulp van de DreamGreen Taq-kit. PCR-omstandigheden waren als volgt: voordenaturatie bij 94 ° C gedurende 3 minuten, denaturatie bij 94 ° C gedurende 30 seconden, annealing bij 50 ° C gedurende 30 seconden, verlenging bij 72 ° C gedurende 1 minuut. PCR-producten werden gesequenced en geanalyseerd door BLAST om te valideren dat het de verwachte producten waren. De sequenties van het geneesmiddelresistentie-gen mecA en het virulentiegen tst van S. aureus werden opgehaald uit de GenBank-database. Primer 5.0-software werd gebruikt om de primers te ontwerpen (tabel 1) en deze primers werden gesynthetiseerd door Sangon Biotech Co., Ltd. (Shanghai, China).
Detectie van de overleving van S. aureus SIHP-stammen in Macrofagen
Om de overleving van S. aureus SIHP-stammen in macrofagen te vergelijken met die van tst-negatieve S. aureus SCHP-stammen, werd de menselijke monocytcellijn THP-1 gehandhaafd in RPMI-1640 met 10% (v / v) FBS bij 37 ° C in een atmosfeer met 5% (v / v) CO2. Voor macrofaaginfectie werden THP-1-cellen gezaaid met 5 x 105 cellen per putje in weefselkweekschalen met 24 putjes en geïnduceerd om te differentiëren door 10 – 7 M phorbol 12-myristaat 13-acetaat (PMA) gedurende 48 uur. Ongeveer 3 x 108 kolonievormende eenheden (CFU) van bacteriën in logaritmische fase (OD600 0,5–0,6) werden gepelleteerd door middel van centrifugatie, tweemaal gewassen met PBS en geresuspendeerd in 1 ml RPMI-1640. Vervolgens werden bacteriën toegevoegd aan de celmonolaag met een MOI van 20: 1, en gedurende 5 minuten gecentrifugeerd bij 1000 rpm. Geïnfecteerde cellen werden gedurende 20 minuten bij 37 ° C geïncubeerd, vervolgens drie keer gewassen met voorverwarmde PBS (pH 7,4) en nog eens 1 uur geïncubeerd in medium met 100 μg / ml gentamicine om extracellulaire bacteriën te doden. Cellen werden gewassen en gelyseerd om de intracellulaire bacteriële bacterie te kwantificeren als het tijdstip nul monster (T0). Extra cellen werden verzameld na 12 of 24 uur incubatie in aanwezigheid van vers aangevuld weefselkweekmedium dat 12 ug / ml gentamicine bevat.De groei van bacteriën in THP-1-cellen werd bepaald door het aantal intracellulaire bacteriën na 12 uur of 24 uur te delen door het aantal op tijdstip 0 (T12 / T0 of T24 / T0). Het experiment werd drie keer onafhankelijk herhaald.
Detectie van cytokinesecretie van macrofagen geïnfecteerd door S. aureus SIHP-stammen
De kweeksupernatanten van THP-1-macrofagen die gedurende 12 uur door bacteriën waren geïnfecteerd, werden verzameld. De cytokineniveaus werden gemeten door middel van FACSCalibur flowcytometrie (BD) met behulp van een CBA Human Thl / Th2 Cytokine Kit II (BD) volgens de instructies van de fabrikant.
Multilocus sequentietypering en analyse
Resultaten
Hemolytisch fenotype van SIHP-stammen op bloedplaten van schapenagar
Zoals getoond in figuren 1A, B, werd de volledige hemolytische ring (β-hemolytisch fenotype) waargenomen in controle S . aureus-stammen na het kweken van stammen op bloedagarplaten gedurende 24 uur. Er werden echter verschillende hemolytische fenotypen (hier onvolledig hemolytisch fenotype genoemd) weergegeven in SIHP-stammen. Bovendien kon het onvolledige hemolytische fenotype worden waargenomen in de SIHP-stammen die in verschillende omgevingen groeiden. condities waaronder microaërofiele, aërobe en anaërobe condities respectievelijk (figuren 1C-E). Bovendien werd dit onvolledige hemolytische fenotype na 10 seriële passages nog steeds gehandhaafd (Figuur 1F).
Relatief mRNA-expressieniveaus van vier hemolysine-genen
Zoals weergegeven in figuur 2, vertoonden de expressieniveaus van de vier hemolysinegenen hla, hlb, hlgC en hld in SCHP-stammen geen statistisch significante verschillen (p > 0,05) vergeleken met die van controlestammen ATCC25923. De expressieniveaus van hla, hlgC en hld in SIHP-stammen werden echter significant onderdrukt met respectievelijk 50-, 16,7- en 8,3-voudige (p < 0,05) vergeleken met die van controlestammen ATCC25923 en SCHP-stammen, terwijl de expressie van hlb in SIHP-stammen significant 7,7-voudig was toegenomen in vergelijking met de controles (p < 0.05).
Detectie van α-hemolysine door Western Blot
Het α-hemolysine gecodeerd door gen hla is een porievormend toxine dat wordt uitgescheiden door S. aureus en het molecuulgewicht is 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). Western blot-analyse toonde aan dat de expressie van α-hemolysine in SIHP-stammen 40 keer lager was dan die van de SCHP- en controlestammen, wat consistent is met de qRT-PCR-gegevens (Figuur 3).

Figuur 3. Western blot van α -hemolysine in S. aureus. ATCC29213: controle S. aureus met het volledige hemolytische fenotype; SCHP: S. aureus met het volledige hemolytische fenotype geïsoleerd uit klinische monsters in dezelfde periode; SIHP: S. aureus met een onvolledig hemolytisch fenotype.
Geneesmiddelresistentie van SIHP
Geneesmiddelgevoeligheid getest met behulp van verdunningen van microtiterbouillon bleek dat de MIC-waarden voor oxacilline en cefoxitine allemaal > 2 en > 8 μg / ml waren in respectievelijk 60 SIHP-kleuringen . Volgens de CLSI M100-S24-richtlijnen worden alle 60 SIHP-stammen geclassificeerd als MRSA-stammen. PCR detecteerde ook het mecA-gen in alle 60 stammen.
Testen op het tst-gen
Het tst-gen is een belangrijke virulentiefactor in S. aureus. PCR toonde aan dat alle 50 SIHP-stammen tst-genen droegen.
Het overlevingsvermogen van S. aureus SIHP-stammen in macrofagen is groter dan dat van tst negatieve S. aureus
We vergeleken het intracellulaire overlevingsvermogen van SIHP-stammen en de tst-negatieve SCHP-stam in macrofagen. Door het aantal bacteriën te tellen dat van de platen werd gewonnen, ontdekten we dat het intracellulaire overlevingsvermogen van de SIHP-stam veel hoger was dan dat van de tst-negatieve S. aureus-stam na 12 of 24 uur geïnfecteerde THP-1-afgeleide macrofagen (Figuur 4). Vooraf speculeerden we dat SIHP-stammen een potentieel hoge virulentie bezitten, en er werd gesuggereerd dat SIHP meer aandacht zou moeten krijgen in het ziekenhuis.
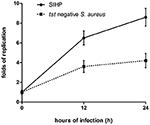
Figuur 4. Overleving van SIHP-stammen en tst-negatieve S. aureus in THP-1-afgeleide macrofagen. Nadat de macrofagen gedurende 12 en 24 uur door bacteriën waren geïnfecteerd, werden de macrofagen gelyseerd en werden de intracellulaire overlevende bacteriën uitgeplaat op LB-agar. De replicatievouwen van intracellulaire overlevende bacteriën werden berekend op basis van het aantal kolonies op de bovenstaande LB-agarplaat.
De secretieverschillen van cytokinen en chemokinen van macrofagen geïnfecteerd door S. aureus SIHP-stammen en tst negatieve S. aureus
De secretieverschillen van cytokinen en chemokinen in THP-1-afgeleide macrofagen geïnfecteerd door SIHP-stam en tst-negatief S.aureus-stam, hebben we pro-inflammatoire cytokines gedetecteerd door flowcytometrie in het kweeksupernatant van macrofagen geïnfecteerd door SIHP-stammen en tst-negatieve S. aureus-stam. De resultaten toonden een significant hogere inductie van IL-2, IL-6 en IL-17A in SIHP-stammen, maar niet door tst-negatieve S. aureus, wat suggereert dat SIHP-stammen cytokine / chemokine-reacties in de macrofagen induceren (Figuur 5). De andere cytokines IL-4, IL-10, INF-γ en TNF uitgescheiden door macrofagen waren geen duidelijke verschillen tussen SIHP-stammen en tst-negatieve S. aureus getroffen groepen.
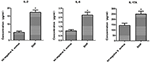
Figuur 5. Detectie van cytokinen en chemokinen die worden uitgescheiden door macrofagen die zijn geïnfecteerd met S. aureus. * P < 0.05.
Multilocus sequentie typen
We bepaalden het multilocus genotype van 60 SIHP-isolaten verzameld van patiënten die tussen 2013 en 2014 in ons ziekenhuis waren opgenomen. Het zeven-locus-schema aanbevolen in de S. aureus MLST-database werd toegepast. MLST-analyse toonde aan dat alle SIHP-stammen waren geclassificeerd in ST5-kloon.
Discussie
Hemolysine is een van de belangrijkste virulentiefactoren voor S. aureus (Wiseman, 1975). De gecombineerde effecten van elk van de vier soorten hemolysine resulteren in de vernietiging van het rode celmembraan, wat leidt tot de vorming van de volledig transparante hemolytische ring op bloedagarplaten. SIHP werd de afgelopen jaren gevonden in de klinische monsters van het tweede aangesloten ziekenhuis van Soochow University. In deze studie hebben we geprobeerd deze stammen te identificeren en hun kenmerken in de microbiologie te bestuderen. Aanvankelijk gebruikten we verschillende commerciële of zelfbereide agarplaten van schapenbloed om de stammen te isoleren, te incuberen en serieel te passeren. We hebben aangetoond dat er enkele stammen zijn die een onvolledig hemolytisch fenotype vertonen en behouden, zelfs na langdurige subcultuur. De mogelijkheid dat dit fenotype wordt veroorzaakt door niet-bacteriële factoren kan dus worden uitgesloten. Onze studies suggereren dat SIHP een subset van unieke S. aureus-stammen zou kunnen zijn.
Eerdere studies suggereerden dat rode bloedcellen van konijnen zeer gevoelig zijn voor α-hemolysine (Hildebrand et al., 1991). Berube et al. meldde dat het effect van α-hemolysine op de lysis van rode bloedcellen concentratieafhankelijk is (Berube en Bubeck Wardenburg, 2013). γ-hemolysine kan de rode bloedcellen van mens en dier beschadigen (Kaneko en Kamio, 2004). Hoewel δ-hemolysine rode bloedcellen beschadigt, vormt het alleen bij hoge concentraties een transmembraanporie die het celmembraan lyseert (Verdon et al., 2009). In deze studie hebben we aangetoond dat de expressie van vier hemolysines van SIHP-stammen en SCHP-stammen significant verschillende transcriptionele expressieprofielen heeft. De expressie van α-, γ-, δ-hemolysine in de SIHP-stammen, die de rode bloedcellen direct zouden kunnen beschadigen, is veel lager dan die van de SCHP-stammen, terwijl β-hemolysine veel hogere expressieniveaus heeft in vergelijking met de SCHP-stammen. Bovendien werd het eiwitexpressieniveau van α-hemolysine verder gevalideerd door Western blot. Er werd gerapporteerd dat β-hemolysine voornamelijk de gevoeligheid van rode bloedcellen voor andere toxines verhoogt in plaats van de cellen rechtstreeks te lyseren, tenzij de cellen bij lagere temperaturen worden gekweekt (Vandenesch et al., 2012). In deze studie werd de hoge expressie van β-hemolysine gedetecteerd in SIHP-stammen, maar de volledige hemolytische ring werd nooit waargenomen in de SIHP-stammen, zelfs niet bij incubatie bij 4 ° C. Deze resultaten suggereren dat het waargenomen onvolledige fenotype van SIHP-stammen hoogstwaarschijnlijk de effecten zijn van alle vier hemolysinen die op een andere manier tot expressie worden gebracht in vergelijking met de SCHP-stammen. Eerdere studies hebben aangetoond dat tijdens chronische pathogenese het gecombineerde effect van selectieve druk als gevolg van antibiotica, waaronder ciprofloxacine en trimethoprim, evenals de immuunrespons van de gastheer, kan leiden tot de verhoogde expressie van α-hemolysine, wat erg belangrijk is voor de kolonisatie van S. . aureus in slijmvlies, vooral bij luchtweginfecties (Goerke et al., 2006; Huseby et al., 2010). In deze studie kregen alle met SIHP geïnfecteerde patiënten een langdurige behandeling met breedspectrumantibiotica, of deze selectieve druk overexpressie van geneesmiddelresistente genen veroorzaakte en interfereerde met de expressie van de hemolysine-genen, blijft een mogelijkheid die verder nodig is. onderzoek.
Om de microbiologische kenmerken van SIHP te onderzoeken, hebben we antimicrobiële gevoeligheidstests uitgevoerd en het virulentiegen gekozen dat geassocieerd is met de pathogeniteit van S. aureus. We ontdekten dat alle 60 SIHP-stammen konden worden geclassificeerd als MRSA-stammen en het mecA-gen droegen. De resultaten van antimicrobiële gevoeligheidstesten toonden aan dat zelfs na 10 passages, van deze 60 SIHP-stammen, de MIC-waarden van linezolid en teicoplanine van slechts drie SIHP-stammen weinig zijn veranderd.Deze veranderingen van MIC-waarden hadden echter geen invloed op de beoordeling van de resultaten van antimicrobiële gevoeligheid. Het virulentiegen tst codeert voor toxisch shocksyndroomtoxine (TSST-1) (Kreiswirth, 1989). Als superantigeen versterkt TSST-1 de shock- en immuunonderdrukkingsreacties die worden geïnduceerd door endotoxinen (Kulhankova et al., 2014). Uit PCR-testen bleek dat alle 60 SIHP-stammen het tst-gen bezaten, wat wijst op verhoogde virulentie. Onlangs toonden veel rapporten aan dat S. aureus zou kunnen overleven in de uit menselijke monocyten afkomstige macrofagen en dat deze S. aureus-stammen virulenter zijn (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi en Bishayi, 2016). Daarom vergeleken we de intracellulaire overlevingscapaciteiten van SIHP-stammen en SCHP-stammen die tst-negatieve S. aureus zijn in macrofagen, en ontdekten dat het intracellulaire overlevingsvermogen van de SIHP-stam veel hoger was dan die van de tst-negatieve S. aureus-stam. Bovendien toonde analyse van patiëntgegevens aan dat het effect van anti-infectieuze therapie bij de meeste patiënten die waren geïnfecteerd met SIHP-stammen slechter was dan dat van de vergelijkbare patiënten die waren geïnfecteerd met SCHP-stammen (gegevens niet getoond). Onze studie levert voorlopig experimenteel bewijs voor de speculatie dat SIHP-stammen een potentieel hoge virulentie bezitten.
Tijdens het infectieproces van invasieve S. aureus initiëren pathogeen-geassocieerde moleculen het aangeboren immuunsysteem dat leidt tot activering en rekrutering van neutrofielen en macrofagen en de productie van pro-inflammatoire cytokines, met name TNF-α, IL-1β en IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). Er werd gemeld dat de secretie van inflammatoire cytokines IL-6 toenam met toenemende concentraties van S. aureus (Chen et al., 2016). Bovendien zijn superantigene S. aureus bijzonder efficiënt in het stimuleren van IL-17-productie (Islander et al., 2010). In deze studie vertoonden SIHP-stammen een significant hogere inductie van IL-2, IL-6 en IL-17A van macrofagen in vergelijking met tst-negatieve SCHP-stammen, wat suggereert dat SIHP-stammen meer uitscheiding van cytokines zouden kunnen induceren tegen het dodende effect van macrofagen. Bovendien toonde MLST-analyse aan dat alle SIHP-stammen waren geclassificeerd in ST5-kloon. Bovendien werden deze SIHP-stammen samen gegroepeerd in het kuuroord type t2460 (gegevens niet getoond).
Samengenomen kan SIHP een nieuwe subset van MRSA zijn met potentieel hoge virulentie, en er moet meer aandacht worden besteed aan beheersing en behandeling van deze stammen in ziekenhuizen.
Bijdragen van de auteur
Verklaring van belangenconflicten
De auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van enige commerciële of financiële relaties die kunnen worden opgevat als een potentieel belangenconflict.
Dankbetuigingen
Deze studie werd ondersteund door de National Natural Science Foundation of China (81572032, 81401636), de Natural Science Stichting voor Hogescholen en Universiteiten in de provincie Jiangsu (16KJB320006), en het Science and Technology Program of Suzhou (SYSD2014094, SYS201551, SS201638).
Klinisch en laboratorium Standards Institute (2014). M100-S24 prestatienormen voor testen op antimicrobiële gevoeligheid; Vierentwintigste informatiesupplement. Wayne, PA: CLSI.
Nandi, A., en Bishayi, B. (2016). Intracellulair overleefde Staphylococcus aureus na fagocytose zijn virulenter bij het induceren van cytotoxiciteit in verse muriene peritoneale macrofagen met behulp van TLR-2 als mogelijk doelwit. Microb. Pathog. 97, 131-147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
Wiseman, G. M. (1975). De hemolysinen van Staphylococcus aureus. Bacteriol. Rev. 39, 317-344.
PubMed Abstract | Google Scholar