Grenzen in de fysiologie
Inleiding
Arteriële baroreceptoren dienen als frontliniesensoren om bloeddrukveranderingen in de bloedstroom te detecteren. Veranderingen in de bloeddruk stimuleren de mechanisch gevoelige zenuwuiteinden die zich in de arteriële wanden bevinden. De mechanische kracht wordt omgezet in elektrische signalen op de zenuwuiteinden, wat resulteert in drukafhankelijke actiepotentiaalvuren in baroreceptorneuronen. De zenuwsignalen verspreiden zich vervolgens naar het cardiovasculaire controlecentrum in de hersenstam voor baroreflexregulatie van de bloeddruk (Levy MN, 2007). Bovendien hebben supra-medullaire structuren, waaronder de spijkerschriftkern van de middenhersenen en de ventrale mediale prefrontale cortex, ook een remmende rol bij de regulatie van baroreflex (Verberne et al., 1997).
Er zijn twee arteriële baroreceptoren, namelijk: de aortabaroreceptoren en halsslagaderbaroreceptoren, die zich respectievelijk in de adventitia-laag van de aortaboog en halsslagaders bevinden. De aortabaroreceptoren detecteren de bloeddruk in de aorta. De cellichamen (soma) van de aortabaroreceptoren bevinden zich op het nodose ganglion (NG) (Figuur 1). De zenuwsignalen van de zenuwuiteinden van de aortabaroreceptor worden naar het nodose ganglion gestuurd via een sensorische zenuw genaamd aortadressor zenuw (ADN) (Figuur 1). Carotisbaroreceptoren detecteren de bloeddruk in de halsslagader, die bloed aan de hersenen levert. De zenuwuiteinden van halsslagaderbaroreceptoren zijn bilateraal gelokaliseerd bij de vertakkingen van de halsslagader, dicht bij de interne halsslagader. De zenuwsignalen van de halsslagaderbaroreceptoren reizen langs de carotissinuszenuwen (CSN) naar hun soma gelokaliseerd in het petrosale ganglion (PG). Petrosal ganglion steekt uit voorbij het foramen van de halsader (Figuur 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly en Rigual, 2000; Weijnen et al., 2000) . Omdat aortabaroreceptoren de bloeddruk waarnemen in de aorta, die bloed levert aan de gehele systemische circulatie, wordt verwacht dat deze baroreceptoren een belangrijke functionele rol spelen bij het handhaven van de algehele systemische bloeddruk. Aan de andere kant detecteren halsslagaderbaroreceptoren de druk van het bloed dat aan de hersenen wordt afgegeven. Deze baroreceptoren zijn mogelijk belangrijker voor het handhaven van een stabiele cerebrale bloeddruk en cerebrale bloedstroom.
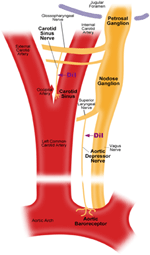
Figuur 1. Schematisch diagram van aorta en halsslagader baroreceptor terminals en zenuwen. Diagram dat de anatomische posities illustreert van de zenuwuiteinden van de aorta en halsslagader, hun zenuwvezels en somata-gebieden. Aortabaroreceptorterminals bevinden zich in de aortaboog. De afferente zenuwvezel is de aortadressor. De soma bevindt zich in het nodose ganglion (NG). Carotisbaroreceptor is gepositioneerd in de interne halsslagader naast de halsslagader. De afferente zenuw is de sinus carotis zenuw. De soma bevindt zich in het petrosale ganglion (PG).
Er zijn tegenstrijdige rapporten over welke baroreceptoren, aortabaroreceptoren of halsslagader baroreceptoren, zijn gevoeliger voor bloeddrukveranderingen. Sommige onderzoekers meldden dat de halsslagaderbaroreceptoren gevoeliger zijn voor druk (Donald en Edis, 1971; Fadel et al., 2003), terwijl anderen denken dat aortabaroreceptoren gevoeliger zijn voor druk (Glick en Covell, 1968; Pickering et al., 2008), en weer anderen hebben geen verschil in de drukgevoeligheid tussen deze twee baroreceptoren gerapporteerd (Hainswor et al., 1970; James en Daly, 1970). In bijna al deze eerdere onderzoeken werden echter alleen de baroreflexresponsen (zoals hartslag en renale sympathische zenuwactiviteit) gebruikt als eindpunten voor de baroreceptorgevoeligheidstest. Er is nog steeds geen studie die de drukgevoeligheid van aorta- en halsslagader-baroreceptorneuronen per se rechtstreeks registreert en vergelijkt.
Hier hebben we een hogesnelheidsdrukklem gebruikt om de hydrostatische druk in baroreceptorneuronen te veranderen en gemeten de overeenkomstige elektrofysiologische reacties van deze neuronen door het vastklemmen van de hele cel. We gebruikten ook een uniaxiale rekkamer om de baroreceptorneuronen te strekken en maten de overeenkomstige veranderingen in cytosolisch Ca2 + in deze neuronen. Bovendien hebben we voor in vivo dierstudies de door druk geïnduceerde actiepotentiaalvuren gemeten in de aortadressor en de carotis-sinuszenuwen, die de sensorische zenuwen zijn van respectievelijk de aorta- en halsslagaderbaroreceptoren.
Materialen en methoden
Dieren
Alle dierproeven werden uitgevoerd onder het gezag van een vergunning afgegeven door de regering van de Hong Kong SAR en met goedkeuring van de Animal Experimentation Ethics Committee, de Chinese University of Hong Kong.Mannelijke Sprague-Dawley (S / D) -ratten (180-200 g) werden geleverd door Laboratory Animal Services Centre van de Chinese University of Hong Kong.
Primaire cultuur
S / D ratten werden verdoofd met pentobarbital-natrium (100 mg / kg). Het linker cervicale gebied werd blootgelegd door middel van een incisie in de middellijn onder gesteriliseerde toestand. Zoals getoond in figuur 1, werd de aortadressor zenuw of de carotis sinus zenuw blootgelegd en werd 2-3 mm van de zenuw voorzichtig losgemaakt van de omliggende weefsels door middel van stompe dissectie. Fluorescerende lipofiele tracer 1,1-dioctadecyl-3,3,3 ′, 3′-tetramethylindocarbocyanine (DiI) -kristallen (Invitrogen) werden rond de zenuw aangebracht en bedekt met Kwik-Sil (World Precision Instruments, VS). De incisie werd daarna gehecht. De ratten kregen 5–7 dagen de tijd om te herstellen om de DiI-kleurstof retrograde te laten diffunderen langs de aortadressor zenuw of de sinus carotis zenuw naar de somata in respectievelijk het nodose ganglion of petrosal ganglion.
Nodose of petrosal ganglion neuronen werden geïsoleerd uit DiI-gelabelde ratten en in stukjes gesneden in ijskoude EBSS. Ze werden gedurende 1 uur bij 37 ° C aan digestie onderworpen met trypsine (1 mg / ml) en collagenase IA (1 mg / ml). Enkele neuronen werden gedispergeerd door voorzichtig fijnwrijven met een glazen pasteurpipet, gevolgd door centrifugeren. De neuronen werden geresuspendeerd en gekweekt in DMEM / F-12-medium aangevuld met 5% FBS, 1% antibioticum-antimycoticum en 7S NGF (100 ng / ml). Cytosine arabinofuranoside (Ara-C; 10 μM) werd in het kweekmedium opgenomen om de groei van delende cellen te remmen. De neuronen werden vóór experimenten gedurende ten minste 3 dagen gekweekt. Voor het opnemen van actiepotentiaal werden de neuronen vers geïsoleerd en ten minste 30 minuten vóór experimenten in F12 geïncubeerd. Voor alle experimenten werden de cellen geïncubeerd op glasplaatjes die vooraf waren bekleed met 0,1 mg / ml poly-L-lysine, behalve voor de celstrekexperimenten waarbij de siliconenkamers vooraf waren bekleed met 2% gelatine.
Patch-klem
De opname van stroomtangen in de gehele cel werd bereikt door een EPC7 patch-klemversterker (HEKA, Duitsland). Patchpipetten met weerstand 3-5 MΩ werden gevuld met pipetoplossing (in mM): 130 K-gluconaat, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 door KOH. De cellen werden ondergedompeld in de kunstmatige cerebrospinale vloeistof (ACSF) (in mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glucose, in evenwicht gebracht met carbogeen (95% O2 en 5 % CO2). Bij de huidige klemopname werden de cellen op zijn rustmembraanpotentiaal gehouden. Een hogesnelheidsdrukklemsysteem (HSPC-1, ALA Scientific Instruments, VS) werd gebruikt om positieve druk aan de cel te geven via micropipet. Opnames werden bemonsterd op 50 kHz en gefilterd op 5 kHz. De gegevens werden geanalyseerd met PulseFit (HEKA). Alle experimenten werden uitgevoerd bij kamertemperatuur.
Calcium Imaging
Cytosolische Ca2 + -meting werd uitgevoerd zoals elders beschreven (Wong et al., 2010). In het kort werden cellen gedurende 40 minuten geladen met 5 μM Fluo-4 / AM. Cytosolische Ca2 + -meting werd uitgevoerd met HEPES-gebufferde oplossing (in mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glucose, pH 7,4 door NaOH. Cytosolische Ca2 + -verandering als reactie op uniaxiale rek werd uitgevoerd met STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). De cellen werden gestimuleerd door 10, 20 of 30% unidirectionele rek gedurende 1 s. Cytosolische Ca2 + -respons werd gemeten bij kamertemperatuur. De Fluo-4-fluorescentie werd geregistreerd en geanalyseerd door het FV1000 laser scanning confocale beeldvormingssysteem. Verandering in cytosolische Ca2 + fluorescentierespons werd uitgedrukt als een verhouding (Fx / F0) van real-time fluorescentie, waarbij Fx het real-time fluo-4 / AM-signaal is en F0 het basislijn fluo-4 / AM-signaal vóór rek. / p>
Registratie van zenuwactiviteit
Ratten werden verdoofd met 100 mg / kg pentobarbital-natrium. Het cervicale gebied werd blootgelegd door een incisie in de middellijn. De rechter halsslagader werd geïsoleerd en van een canule voorzien door een katheter die was verbonden met de druktransducer (ML221, ADInstruments, VS) voor bloeddrukregistratie. De linker dijader werd van een canule voorzien voor injectie met fenylefrine en SNP. De linker aorta depressor zenuw of carotis sinus zenuw was verbonden met een bipolaire zilveren elektrode, gevolgd door een versterker (Model 1700 Differential AC Amplifier, A-M Systems Inc., VS). Zowel de bloeddruk als de zenuwactiviteit werden continu geregistreerd met Chart 5.0 (AD Instruments). De zenuwactiviteit werd 10.000 keer versterkt en gefilterd met een banddoorlaat van 100-5000 Hz. Waarden van gemiddelde arteriële druk, hartslag en piekfrequentie als reactie op fenylefrine werden geanalyseerd met Chart 5.0-software. Verandering in piekfrequentie (piekfrequentie na fenylefrine – piekfrequentie vóór fenylefrine) als reactie op maximale bloeddrukverandering (gemiddelde arteriële bloeddruk na fenylefrine – gemiddelde arteriële bloeddruk vóór fenylefrine) bij injectie met fenylefrine werd berekend (Lau et al., 2016) .
Statistische analyse
Representatieve sporen werden uitgezet als tijdsverloopsporen. Gegevens van alle experimenten werden samengevat in een staafdiagram dat werd uitgedrukt in gemiddelde ± sem van individuele experimenten. De t-test van de student werd gebruikt voor statistische analyse. De paarsgewijze t-test werd waar nodig gebruikt.
Resultaten
Eigenschappen van aortadepressorneuronen en carotissinusneuronen
Dil werd aangebracht op de zenuw van de aorta depressor of op de zenuw van de sinus halsslagader. Daarom omvatten Dil-gelabelde neuronen in het nodose ganglion de baroreceptor neuronen die de aortaboog innerveren en de chemoreceptor neuronen die het aortahuis innerveren. Aan de andere kant, Dil-gelabelde neuronen in petrosale ganglion omvatte de baroreceptorneuronen die de carotissinus innerveren en de chemoreceptorneuronen die het carotislichaam innerveren. We onderzochten eerst de basiseigenschappen van deze Dil-label neuronen. DiI-gelabelde neuronen in nodose en petrosale ganglion werden afzonderlijk gekweekt en onderworpen aan een depolariserende elektrische stroom zoals getoond in Figuur 2. Er werden twee soorten reacties geregistreerd, de ene reageerde met een enkel actiepotentiaal en de andere met continue actiepotentialen na de depolariserende stroom (Figuur 2) (Belmonte en Gallego, 1983). Deze neuronen werden vervolgens onderworpen aan een hydrostatisch drukprotocol om hun gevoeligheid voor veranderingen in hydrostatische druk te testen. Een positieve hydrostatische drukhelling werd intracellulair aangebracht door een glazen micropipet door het hogesnelheids-drukklemsysteem (HSPC-1, ALA Scientific Instruments, VS) totdat actiepotentialen werden opgewekt. De resultaten toonden aan dat 45% van de aortabaroreceptorneuronen continue actiepotentialen afvuurden als reactie op de depolariserende elektrische stroom (tabel 1A). Van hen reageerde 91% (41% / 45%) ook op de hydrostatische drukverandering en vertoonde drukafhankelijke actiepotentiaalvuren (tabel 1A). De resterende 55% van de aortabaroreceptorneuronen vuurden slechts één actiepotentiaal af als reactie op de depolariserende stroom (tabel 1A), en onder hen kon 40% (22% / 55%) reageren op de drukverandering (tabel 1A). Voor de halsslagader-baroreceptorneuronen gaven 45% van de cellen continue actiepotentialen wanneer ze werden gestimuleerd door de depolariserende stroom (tabel 1B). Onder hen was 82% (37% / 45%) ook gevoelig voor de drukverandering (tabel 1B). Bovendien kon van de halsslagader-baroreceptorneuronen die slechts één actiepotentiaal afvuurden als reactie op de depolariserende stroom, 24% (13% / 55%) reageren op de drukverandering (tabel 1B).
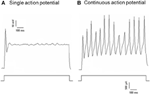
Figuur 2. Opname van actiepotentiaal van gekweekte aortadressor en carotissinusneuronen. Getoond zijn de sporen van actiepotentialen die werden geregistreerd van twee representatieve aortadressor / carotis-sinusneuronen op een depolariserende stroom. (A) Een representatieve neuronen die slechts één actiepotentiaal afvuren op de huidige stimulatie; (B) Een representatieve neuronen die alleen continue actiepotentialen afvuren op de huidige stimulatie. Onderste paneel: protocol voor huidige injectie. Schaalbalk, horizontaal, 100 ms, verticaal, 10 mV (bovenste sporen) en 500 pA (onderste sporen). n = 27 en n = 38 voor respectievelijk aortadressor en carotissinusneuronen.

Tabel 1. Eigenschappen van aorta depressor en carotis sinus neuronen.
Ongeacht of ze een enkele actiepotentialen of continue actiepotentialen afvuurden, 63% van de met Dil gelabelde aortabaroreceptorneuronen bleken gevoelig te zijn voor de drukverandering, terwijl slechts 50% van de met Dil gelabelde halsslagader-baroreceptorneuronen gevoelig was voor de drukverandering (tabel 1).
Rekgevoeligheid van aorta- en halsslagaderneuronen
De drukdrempel voor de actiepotentiaalontlading werd geanalyseerd. Zoals weergegeven in figuur 3, hadden baroreceptorneuronen van de aorta een lagere drukdrempel (24 ± 4 mmHg) dan die van de halsslagader-baroreceptorneuronen (39 ± 4 mmHg).

Figuur 3. Gevoeligheden van aorta- en halsslagader-baroreceptorneuronen voor hydrostatische druk. (A, B) Bovenpaneel, representatieve sporen van het tijdsverloop ter illustratie van de drukafhankelijke actiepotentiaalvuren in de aorta (A) en halsslagader (B) baroreceptorneuronen. De drukhelling (onderste paneel) werd op de binnenkant van de cellen aangebracht via een micropipet met behulp van een hogesnelheidsdrukklemsysteem (HSPC). Schaalbalk horizontaal, 1 s, verticaal, 20 mV en 20 mmHg. (C) Samenvatting met de drukdrempel die de actiepotentiaalvuren in aorta- en halsslagader-baroreceptorneuronen initieert. n = 13 voor aortabaroreceptorneuronen en n = 15 voor halsslagaderbaroreceptorneuronen. *** p < 0.01, door Student’s t-test.
Stretch-geïnduceerde Ca2 + -respons in baroreceptorneuronen
Gekweekte aortadepressor of carotissinusneuronen werden onderworpen aan 10, 20 of 30% van de uniaxiale rek door STREX Cell Stretching System, in een poging om het uitrekken van het bloedvat onder bloeddruk na te bootsen. De resultaten toonden aan dat een uniaxiale rek van 20% een duidelijke toename in cytosolische Ca2 + fluorescentie induceerde in aorta baroreceptor neuronen maar niet in halsslagader baroreceptor neuronen (figuren 4A-C). Bovendien neemt de grootte van de Ca2 + -fluorescentie toe als reactie op 30% uniaxiale rek was veel hoger in aorta baroreceptor neuronen dan in halsslagader baroreceptor neuronen (figuren 4A-C).
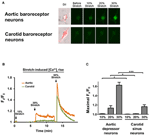
Figuur 4. Gevoeligheden van aorta depressor en carotis sinus neuronen voor uniaxiale rek. Cellen werden geladen met Ca2 + -gevoelige fluorescerende kleurstof Fluo-4 / AM. Getoond worden representatieve beelden (A) en tijdsverloopsporen (B) van relatieve cytosolische Ca2 + stijgingen in reactie op uniaxiale rek van 10, 20 en 30% van de cellengte in aortadressor en carotis sinus neuronen. (C) Samenvatting van de maximale cytosolische Ca2 + -stijging in reactie op verschillende mate van rek. Verandering in cytosolisch Ca2 + werd uitgedrukt als Fx / F0, waarbij Fx dat realtime fluo-4 / AM-signaal is en F0 het basislijn fluo-4 / AM-signaal vóór rek. Gemiddelde ± sem (n = 5). * p < 0.05, *** p < 0.01 vergeleken met de overeenkomstige controle, door paarsgewijze t-test.
Baroreceptor zenuwactiviteit in vivo
De zenuwactiviteit van de twee baroreceptoren werd in vivo onderzocht. Fenylefrine werd intraveneus geïnjecteerd. De veranderingen in bloeddruk bij het aanbrengen van fenylefrine worden getoond in het bovenste paneel van figuren 5A, B. De subsequentieveranderingen in de zenuwactiviteit van de baroreceptor worden getoond in het onderste paneel (figuren 5A, B). De druk-geïnduceerde zenuwactiviteit was veel hoger in de aortadressor zenuw dan in de carotis sinus zenuw (figuren 5A, B). De verandering in piekfrequentie per mmHg-toename wordt samengevat in Figuur 5C. Het resultaat gaf aan dat de aortabaroreceptoren gevoeliger zijn voor hydrostatische druk dan de halsslagaderbaroreceptoren in vivo.
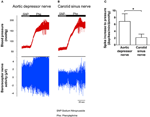
Figuur 5. Baroreceptor zenuwactiviteit bij ratten in vivo. (A, B) Representatieve sporen die de verandering in aortadressor zenuw (A) en carotis sinus zenuw (B) activiteit tonen bij verhoging van de bloeddruk. In beide (A, B) was het bovenste paneel de verandering in bloeddruk voor en na het aanbrengen van Phe, zoals aangegeven door de horizontale balken. Het onderste paneel was de overeenkomstige verandering in zenuwactiviteit. (C) Samengevatte gegevens die de verandering in zenuwactiviteit per eenheid bloeddrukverandering tonen. Gemiddelde ± sem (n = 8). * p < 0.05 vergeleken met de controle in aortabaroreceptoren, door paarsgewijze t-test.
Expressie van TRP-kanalen
Er is gemeld dat verschillende TRP-kanalen mechano-gevoelig zijn, waaronder TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O “Neil en Heller, 2005; Christensen en Corey, 2007; Pedersen en Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Hier onderzochten we de mogelijke rol van deze mechanosensitieve TRP-kanalen in relatie tot de aorta. en carotisbaroreceptorgevoeligheid. De mRNA-expressies van deze kanalen in nodose en petrosal ganglion werden vergeleken. Er werd vastgesteld dat de expressies van TRPV4 en TRPC6 hoger waren in nodose ganglion in vergelijking met petrosal ganglion (Figuur 6). Het is mogelijk dat hoe hoger expressie van mechanisch gevoelige kanalen in nodose ganglion kan bijdragen aan de hogere gevoeligheid.
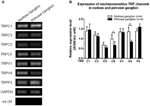
Figuur 6. Uitdrukking van mechanosensitieve TRP-kanalen in nodose en petrosal ganglion. (A) Representatieve gelafbeeldingen die het mRNA-expressieniveau van mechanosensitieve TRP-kanalen vergelijken (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) tussen nodose en petrosale ganglionneuronen. Semi-kwantitatieve RT-PCR-analyse werd gebruikt om de mRNA-expressieniveaus van verschillende TRP-kanalen te vergelijken met GAPDH-mRNA-expressie. De resultaten van 9 experimenten zijn samengevat in (B). Waarden waren in gemiddelde ± sem. * p < 0.05, door paarsgewijze t-test.
Discussie
In de huidige studie werden de mechanosensitieve eigenschappen van aorta- en halsslagader-baroreceptoren vergeleken. Whole-cell patch clamp studies toonden aan dat, in vergelijking met de carotissinus-neuronen, een hoger percentage aortadressor-neuronen rekgevoelig was. Bovendien bleek de drukdrempel die actiepotentiaalvuren zou kunnen initiëren lager te zijn in de aortabaroreceptorneuronen dan in de halsslagaderbaroreceptorneuronen. Uniaxiale rek-geïnduceerde cytosolische Ca2 + -stijging werd ook vergeleken tussen de aortadressor en de carotissinus-neuronen.De omvang van de cytosolische Ca2 + -stijging als reactie op de uniaxiale rek was veel hoger in aortabaroreceptorneuronen dan in halsslagaderbaroreceptorneuronen. Aortabaroreceptorneuronen vertoonden ook een lagere drempel van cytosolische Ca2 + -responsen op uniaxiale rek. In een andere reeks experimenten ontdekten we dat de door druk geïnduceerde toename van het actiepotentiaal afvuren hoger was in de aorta depressor zenuw dan in de carotis sinus zenuw. Alles bij elkaar leveren onze gegevens sterk bewijs dat de aortabaroreceptoren gevoeliger zijn voor bloeddruk dan halsslagaderbaroreceptoren.
Eerder is er veel moeite gedaan om het verschil in gevoeligheden tussen de twee baroreceptoren te begrijpen. De resultaten zijn echter controversieel. Sommige rapporten concludeerden dat de aortabaroreceptoren gevoeliger zijn voor drukveranderingen (Glick en Covell, 1968; Fan et al., 1996; Pickering et al., 2008), terwijl anderen stelden dat de halsslagaderbaroreceptoren gevoeliger zijn voor drukveranderingen (Donald en Edis, 1971; Fadel et al., 2003). Bij bijna al deze eerdere onderzoeken waren echter zeer gecompliceerde chirurgische procedures betrokken en werden uiteindelijk baroreflexreacties, zoals hartslag en renale sympathische output, gebruikt als eindpunten voor de baroreceptorgevoeligheidstest. Ingewikkelde chirurgische procedures zijn vatbaar voor experimentele fouten, die tot controversiële conclusies kunnen leiden. Bovendien is ook diersoortafhankelijke variatie in baroreceptorgevoeligheid mogelijk. Bovendien wordt de baroreflexrespons niet alleen beïnvloed door de gevoeligheid van de baroreceptor, maar ook door meerdere andere factoren, waaronder zenuwgeleiding, centrale bemiddeling, contractiliteit van bloedvaten en hartfunctie. Daarom is het bewijs uit eerdere onderzoeken indirect en nauwelijks ideaal. Tot op heden is er een gebrek aan directe studies die de drukgevoeligheid van aorta versus halsslagader-baroreceptorneuronen vergelijken. In deze studie werd de mechanogevoeligheid rechtstreeks in baroreceptorneuronen bestudeerd. De gegevens suggereren sterk dat de aortabaroreceptoren gevoeliger zijn voor druk dan de halsslagaderbaroreceptoren. Deze informatie kan een belangrijke fysiologische relevantie hebben bij de regulering van de bloeddruk.
Het is onduidelijk welke mechanismen ten grondslag liggen aan het verschil in drukgevoeligheid tussen aorta- en halsslagader-baroreceptoren. We vergeleken het expressieniveau van verschillende mechanosensitieve TRP-kanalen (Figuur 6) (O “Neil en Heller, 2005; Christensen en Corey, 2007; Pedersen en Nilius, 2007; Patel et al., 2010). Onze resultaten toonden aan dat aortabaroreceptorneuronen een hogere expressie hebben van verschillende mechanosensitieve TRP-kanalen, waaronder TRPV4 en TRPC6. Het is mogelijk dat een hogere expressie van TRPV4 en / of TRPC6 kan bijdragen aan de hoge drukgevoeligheid van aortabaroreceptoren. Verdere studies zijn nodig om de rol van deze ionenkanalen te verifiëren.
Eerder werd gerapporteerd dat het nodose ganglion en het petrosale ganglion twee verschillende soorten neuronen bevatten (Belmonte en Gallego, 1983). Een van hen geeft continue actiepotentialen na elektrische stimulatie, terwijl de andere slechts een enkele actie geeft. potentieel bij stimulatie. De auteurs wezen de eerste toe als de drukgevoelige neuronen en de laatste als de chemogevoelige neuronen. Onze resultaten geven aan dat het misschien niet geschikt is te om de drukgevoelige neuronen en drukongevoelige neuronen toe te wijzen op basis van het feit of ze een enkel actiepotentiaal of continue actiepotentialen afvuren als reactie op de depolariserende stroom. In feite is een groot percentage van de cellen die een enkel actiepotentiaal afvuren als reactie op elektrische stimulatie ook gevoelig voor druk, en dus behoren ze tot drukgevoelige baroreceptorneuronen (Figuur 2 en Tabel 1).
Samenvattend levert de huidige studie bewijs dat de aortabaroreceptoren gevoeliger zijn voor druk dan de halsslagaderbaroreceptoren en voegt nieuwe informatie toe aan het begrip van de basisfysiologie.
Bijdragen van de auteur
EL en XY ontwerpen de experimenten en stellen het manuscript op. EL, CL en YY voeren de experimenten uit. XY, YH, AM en LJ hebben het manuscript herzien. Alle auteurs keurden de definitieve versie van het manuscript goed.
Financiering
Dit werk werd ondersteund door subsidies van de Hong Kong Research Grant Committee CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 en RGC-NSFC Joint Grant N_CUHK439 / 13.
Verklaring van belangenconflict
De auteurs verklaren dat het onderzoek is uitgevoerd bij afwezigheid van commerciële of financiële relaties die kunnen worden opgevat als een mogelijk belangenconflict.
James, JEA en Daly, MDB (1970). Vergelijking van reflex vasomotorische responsen op afzonderlijke en gecombineerde stimulatie van carotissinus- en aortaboogbaroreceptoren door pulserende en niet-pulserende drukken bij honden. J. Physiol. 209, 257-293. doi: 10.1113 / jphysiol.1970.sp009165
PubMed Abstract | CrossRef Volledige tekst | Google Scholar
Levy MN, P. A. (2007). Cardiovasculaire fysiologie. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H., en Luciano, D.S. (1998). Menselijke fysiologie: het mechanisme van lichaamsfunctie. Boston, MA: WCB McGraw-Hill.