Kosteneffectieve analyse van het gebruik van hoogfrequente thoraxwandoscillatie (HFCWO) bij niet-cystische patiënten Fibrose Bronchiëctasie
Samenvatting
Bronchiëctasie is een chronische progressieve ziekte die wordt gekenmerkt door onomkeerbare pathologische verwijding van pulmonale bronchiën. Behandelingen voor bronchiëctasie zijn gericht op het mobiliseren van luchtwegafscheidingen, het verminderen van ontstekingen, het voorkomen van luchtweginfecties, het verbeteren van de ventilatie, het minimaliseren van het aantal exacerbaties en het verbeteren van de kwaliteit van leven van een persoon. Hoogfrequente thoraxwandoscillatie (HFCWO) is een behandeling voor het vrijmaken van de luchtwegen die momenteel wordt gebruikt voor een aantal chronische aandoeningen die de luchtwegen in gevaar brengen, waaronder niet-cystische fibrose bronchiëctasie. Deze studie evalueerde de economische impact van HFCWO-behandeling geleverd door het SmartVest® Airway Clearance System op bronchiëctasegerelateerde zorggebruik en kosten.
Methoden
De resultaten van een eerder gepubliceerde case review-uitkomst -gebaseerde klinische studie door de auteurs leverde de basis voor deze kosteneffectiviteitsanalyse. Bronchiëctasegerelateerde exacerbaties, waaronder het aantal ziekenhuisopnames, bezoeken aan de spoedeisende hulp (SEH) en de frequentie van antibioticavoorschriften werden voor elke patiënt geregistreerd gedurende een periode van één jaar voorafgaand aan SmartVest-gebruik (standaardzorgcontrole) en gedurende een periode van één jaar na het starten van SmartVest gebruik. De exacerbatiepercentages voor een jaar vóór SmartVest en een jaar na SmartVest werden vergeleken. Exacerbaties werden geverifieerd uit zowel de medische dossiers van de patiënt als via een telefonisch interview. Antibioticakosten werden bepaald met behulp van “on-line korting apotheekprijzen”, terwijl ziekenhuisopname en ED-kosten werden bepaald met behulp van de Healthcare Cost and Utilization Project (HCUP) Statistical Brief # 146 en de HCUP National Inpatient Sample (NIS) 2013-database.
Resultaten
De eerder gepubliceerde klinische resultaten van negenenvijftig SmartVest-patiënten met niet-cystische fibrose bronchiëctasieën dienden als basis voor deze analyse. Toen de uitkomstgegevens werden geanalyseerd, gebruikte SmartVest, vergeleken met de standaard van zorgcontrole, werd geassocieerd met statistisch significante resultaten; een afname van 58% in antibioticakosten, een afname van 63% in kosten van spoedeisende hulp en een afname van 60% in ziekenhuisopnamekosten. In totaal resulteerde de kostenanalyse in een jaarlijkse besparing van $ 3.045 per jaar. per jaar dat SmartVest wordt gebruikt.
Conclusies
De klinische effectiviteit van het gebruik van SmartVest als behandeling voor niet-cystische fibrose bronchiëctasepatiënten werd eerder geverifieerd door een significante reductie n bij bronchiëctasegerelateerde exacerbaties, wat zich direct vertaalt in een aanzienlijke vermindering van 60% van het gebruik van de gezondheidszorg en de kosten in deze populatie. Bovendien kunnen secundaire voordelen, zoals het potentieel om heropnames in het ziekenhuis te verminderen en het potentieel om antibioticaresistentie af te schrikken, nog grotere voordelen hebben dan lagere kosten.
Trefwoorden
SmartVest, hoogfrequente borstkas wandoscillatie, HFCWO, bronchiëctasie, kosten
Inleiding
Bronchiëctasie is een chronische en etiologisch heterogene ziekte. Algemene kenmerken van bronchiëctasie zijn kortademigheid, frequente exacerbaties, chronische hoest, bloedspuwing en overmatige sputumproductie. De ziekte wordt typisch gekenmerkt door cycli van verminderde mucociliaire klaring, bronchiale infectie en ontsteking resulterend in structurele schade aan de luchtwegen met permanente en abnormale verwijding.1 Bronchiëctasie kan het gevolg zijn van een breed scala aan respiratoire en systemische ziekten, waaronder cystische fibrose, dyskinetische ciliaire syndromen, inademings- / aspiratieletsels, primaire en verworven immunodeficiëntietoestanden en een aantal reumatische en inflammatoire aandoeningen.2 Bronchiëctasie wordt waargenomen bij 7% tot 52% van de patiënten met astma of chronisch obstructieve longziekte (COPD) .3,4 37
Seitz, et al, analyseerden een steekproef van 5% van de Medicare poliklinische claimdatabase voor bronchiëctasieën onder begunstigden van ≥65 jaar van 2000 tot 2007.6 De database bevat claimniveau-informatie van niet-institutionele poliklinische gezondheidszorg providers. Bronchiëctasie werd geïdentificeerd door de database met behulp van de International Classification of Diseases, Ninth Revision, Clinical Modification codes (ICD-9-CM) codes. De onderzoekspopulatie omvatte > 2 miljoen unieke individuen die van 2000 tot 2007 gedurende ten minste één maand deelnamen aan Medicare Part B. Het onderzoek bepaalde dat de prevalentie van bronchiëctasieën in de totale populatie 1.106 gevallen was per 100.000 mensen gedurende de beoordelingsperiode van acht jaar. Uit de studie bleek ook dat de prevalentie van bronchiëctasie bij Medicare-begunstigden tussen 2000 en 2007 met 8,7% toenam en dat het aantal ziekenhuisopnames voor bronchiëctasieën jaarlijks met 2 steeg.4% bij mannen en 3,0% bij vrouwen.
De algehele last van gevorderde longziekte neemt toe, en waar gegevens beschikbaar zijn, lijken de kosten in verband met de morbiditeit en mortaliteit van deze ziekten aanzienlijk te zijn.2 Dit zou, ten dele een weerspiegeling zijn van de toenemende vergrijzing van de bevolking met chronische longziekte, die een onevenredige stijging van de kosten voor gezondheidszorg met zich meebrengt; het aantal ziekenhuisopnames als gevolg van chronische longziekte neemt duidelijk toe boven de leeftijd van 50 jaar, en vooral bij oudere vrouwen.2,7 Aan de hand van ontslagregistraties van 1997-2010 werden de gemiddelde ziekenhuiskosten voor intramurale zorg bij patiënten met een verergering van longontsteking bedroeg $ 9.300.28 In 2001 werd ook geschat dat de jaarlijkse medische kosten van zorg voor personen in de Verenigde Staten met bronchiëctasieën $ 13.244 bedroegen, wat hoger is dan de jaarlijkse kosten voor vele andere chronische ziekten, zoals hartaandoeningen ($ 12.000) en COPD ($ 11.000) .38 Een onderzoek uit 2005 wees uit dat patiënten met niet-cystische fibrose bronchiëctasie gemiddeld 2,0 extra dagen per jaar in het ziekenhuis verbleven, 6,1 extra poliklinische ontmoetingen hadden en 27,2 dagen meer antibiotische therapie vergeleken met patiënten zonder de ziekte.9 In 2005 , de behandelingskosten voor niet-cystische fibrose bronchiëctasieën waren $ 630 miljoen per jaar.5
Patiënten met niet-cystische fibrose bronchiëctasieën kunnen moeite hebben met het opruimen ay secreties en kan aanzienlijk baat hebben bij luchtwegklaringstherapie.2 Het doel van de behandeling van bronchiëctasieën is het mobiliseren van luchtwegafscheidingen om ontstekingen te verminderen, luchtweginfecties te voorkomen, ventilatie te verbeteren, het aantal exacerbaties te minimaliseren en de kwaliteit van leven van een patiënt te verbeteren. 10-12 Momenteel wordt een aantal therapeutische methoden gebruikt om de secretie van de luchtwegen op te ruimen bij patiënten met een longaandoening, verminderde ademhalingsmucusklaring of die het risico lopen een van deze aandoeningen te ontwikkelen.8 Deze methoden zijn doorgaans bedoeld om de secretieklaring te bevorderen door het verminderen van slijmviscositeit en het gebruik van schuifkrachten om het slijm van de longwand vrij te maken om de mobilisatie te vergemakkelijken en het slijm te vergemakkelijken. Standaardzorg omvat combinatietherapie met mucolytische en mucokinetische middelen, bronchodilatatoren, ontstekingsremmende therapie en een of andere vorm van fysische / mechanische luchtwegklaringstherapie.2 Luchtwegklaringstherapie speelt een cruciale rol omdat het helpt om het vasthouden van pathogeenbeladen slijm te voorkomen. is de onderliggende oorzaak van terugkerende infectie die progressieve pulmonale verslechtering veroorzaakt.2,13,14 Luchtwegklaring methoden spelen een cruciale rol bij het handhaven van de ademhalingsgezondheid gedurende de hele levensduur van de patiënt.
Een aantal luchtwegklaring methoden zijn beschikbaar, waaronder thoraxfysiotherapie, positieve end-expiratoire drukmaskers, orale hoogfrequente apparaten en hoogfrequente thoraxwandoscillatie (HFCWO) .2 Positieve end-expiratoire drukmaskers en orale hoogfrequente apparaten vereisen actieve inspanning, beheersing van de techniek en / of fysieke behendigheid die het gebruik ervan kunnen beperken.2
HFCWO wordt gebruikt voor luchtwegklaring bij patiënten met een breed scala aan luchtwegproblemen. ziekten en aandoeningen, waaronder genetische en immunologische aandoeningen, neuromusculaire aandoeningen en obstructieve longaandoeningen, zoals astma en COPD.15-18 In tegenstelling tot sommige andere methoden vereist HFCWO minimale activiteit van de gebruiker en is niet afhankelijk van de zorgverlener. techniek om effectief te zijn.2 Klinische studies, voornamelijk bij patiënten met cystische fibrose, hebben aangetoond dat HFCWO veilig en effectief is.2,15,19-22 HFCWO geeft compressiepulsen af aan de borstwand via een opblaasbaar vest dat is aangesloten op een luchtpulsgenerator .2 De generator produceert een afwisselende luchtstroom in en uit het vest die de borstwand snel comprimeert en vrijgeeft binnen een bereik van selecteerbare frequenties en drukken. Van de oscillerende compressie die op de borstwand wordt uitgeoefend, is gemeld dat het viskeus slijm dunner maakt, slijm losmaakt van de longwand en slijm van de kleine luchtwegen van de longen naar de grote luchtwegen duwt, waar het kan worden opgezogen of weggezogen.2,23, 24 HFCWO kan leiden tot een significante verbetering van het longvolume van 15 tot 57 ml en de flow tot 1,6 l / sec. 22
In een eerdere case review-studie werden de klinische resultaten van SmartVest® Airway Clearance System-therapie op exacerbatie geëvalueerd -gerelateerd zorggebruik en medicatiegebruik bij proefpersonen met niet-cystische fibrose bronchiëctasieën.25 Uit de studie bleek dat het gebruik van SmartVest resulteerde in een statistisch significante afname van 60% in bronchiëctasegerelateerde exacerbaties, waaronder antibioticagebruik, bezoeken aan spoedeisende hulp (ED) en ziekenhuisopnames . De huidige studie is bedoeld om de economische impact van SmartVest-therapie op bronchiëctasegerelateerde gezondheidszorg en antibioticakosten te beoordelen.
Methoden
Een recent SmartVest (Electromed, Inc., New Prague, MN , VS) case review uitkomst-gebaseerde klinische studie diende als basis voor deze analyse.25 De studie registreerde alle bronchiëctasegerelateerde exacerbaties, inclusief het aantal ziekenhuisopnames, ED-bezoeken en antibioticagebruik gedurende een periode van één jaar voorafgaand aan SmartVest-gebruik (standaardzorgcontrole) en, ter vergelijking, gedurende een periode van één jaar na het begin van SmartVest-gebruik (behandeling). De studie omvatte alleen die proefpersonen met een diagnose van niet-cystische fibrose bronchiëctasie die SmartVest al minstens een jaar gebruikten en van wie de medische dossiers gedurende een jaar beschikbaar waren voorafgaand aan de start van de SmartVest-therapie. Patiënten werden uitgesloten als ze niet hadden voldaan aan hun voorgeschreven SmartVest-therapieregime, niet telefonisch gecontacteerd konden worden of als ze verlopen waren. Alle gegevens die voorafgaand aan het gebruik van SmartVest werden verzameld, werden vastgelegd via de medische dossiers van de patiënt.
De medische dossiers van de patiënt werden beoordeeld op alle bronchiëctasegerelateerde exacerbaties die optraden gedurende een periode van één jaar voorafgaand aan de start van de SmartVest-therapie. De proefpersonen werden telefonisch gecontacteerd en geïnterviewd om bronchiëctasegerelateerde exacerbaties te verzamelen gedurende de periode van één jaar na het starten van de SmartVest-therapie. De vragenlijst voor de telefonische enquête is exclusief ontwikkeld voor het onderzoek. Tijdens het telefonische interview werden aan de proefpersoon specifieke vragen gesteld over respiratoir antibioticagebruik, ED-bezoeken en ziekenhuisopnames. In het interview werd ook gevraagd of de patiënt SmartVest gebruikte volgens het voorschrift van de arts.
De kosten van antibiotica werden bepaald aan de hand van ‘online korting op apotheekprijzen’, maar de kosten van kantoorbezoeken en artsenhonoraria waren niet inbegrepen . Ziekenhuisopname en ED-kosten werden bepaald met behulp van de gewogen nationale schattingen van Healthcare Cost and Utilization Project (HCUP) National Inpatient Sample (NIS), 2013, Agency for Healthcare Research and Quality (AHRQ), op basis van gegevens verzameld door individuele staten en verstrekt aan AHRQ door de Verenigde Staten.26 De NIS-database bevat een gestratificeerde kanssteekproef van ziekenhuizen uit State Inpatient Databases met ziekenhuisopnames door patiënten met Medicare, Medicaid, particuliere verzekeringen en onverzekerde.27 De NIS bevat gegevens van 5 tot 8 miljoen ziekenhuisopnames van ongeveer 1000 ziekenhuizen. Het is aangewezen om een steekproef van 20% van de Amerikaanse niet-federale, kortlopende ziekenhuizen te benaderen, zoals gedefinieerd door de American Medical Associ ation. De NIS is afkomstig uit staten die deelnemen aan het Healthcare Cost and Utilization Project. Het NIS bevat uniforme gegevens over ziekenhuisverblijf uit databases van ziekenhuisontslag die wordt beheerd door overheidsinstanties, ziekenhuisverenigingen en andere particuliere organisaties. Het totale aantal gewogen ontladingen in de VS op basis van HCUP NIS was 35.597.792,28
Resultaten
Herziening van HCUP- en Medicare-databases onthulde de bijbehorende kosten voor de gezondheidszorg voor een bronchiëctasegerelateerde exacerbatie
$ 450 (2012) voor een ED-bezoek en $ 9.300 (2010) voor een ziekenhuisopname met longontsteking. Verlengde ziekenhuisopnames op basis van complicaties of comorbiditeit werden niet berekend. Door gebruik te maken van online prijsberekeningen voor apotheken, bedroegen de kosten van een standaard antibioticum voor longontsteking $ 290 (2016). Artsenhonoraria voor een kantoorbezoek en daaropvolgend recept waren niet beschikbaar voor berekening.
Van de 104 geïdentificeerde bronchiëctasieën SmartVest-patiënten voldeden negenenvijftig patiënten aan de inclusie- / uitsluitingscriteria.25 In de onderzoekspopulatie was het gemiddelde aantal van antibioticavoorschriften per jaar was 58% minder voor SmartVest (0,6 / jaar) vergeleken met standaardzorgcontrole (1,4 / jaar) (zie tabel 1). Het gebruik van SmartVest verminderde ook significant ED-bezoeken met 63% (0,08 / jaar versus 0,03 / jaar) en ziekenhuisopnames met 60% (0,5 / jaar versus 0,2 / jaar). De jaarlijkse kosten per patiënt voor antibiotica voor patiënten die met SmartVest werden behandeld, waren ongeveer $ 233 lager in vergelijking met degenen die met standaardzorg werden behandeld (zie tabel 1). Ziekenhuisopnames, na een jaar SmartVest-gebruik, werden ook aanzienlijk verminderd met $ 2.790 per patiënt per jaar. In totaal lieten de algemene resultaten een jaarlijkse besparing zien van $ 3.045 per patiënt per jaar SmartVest-gebruik.
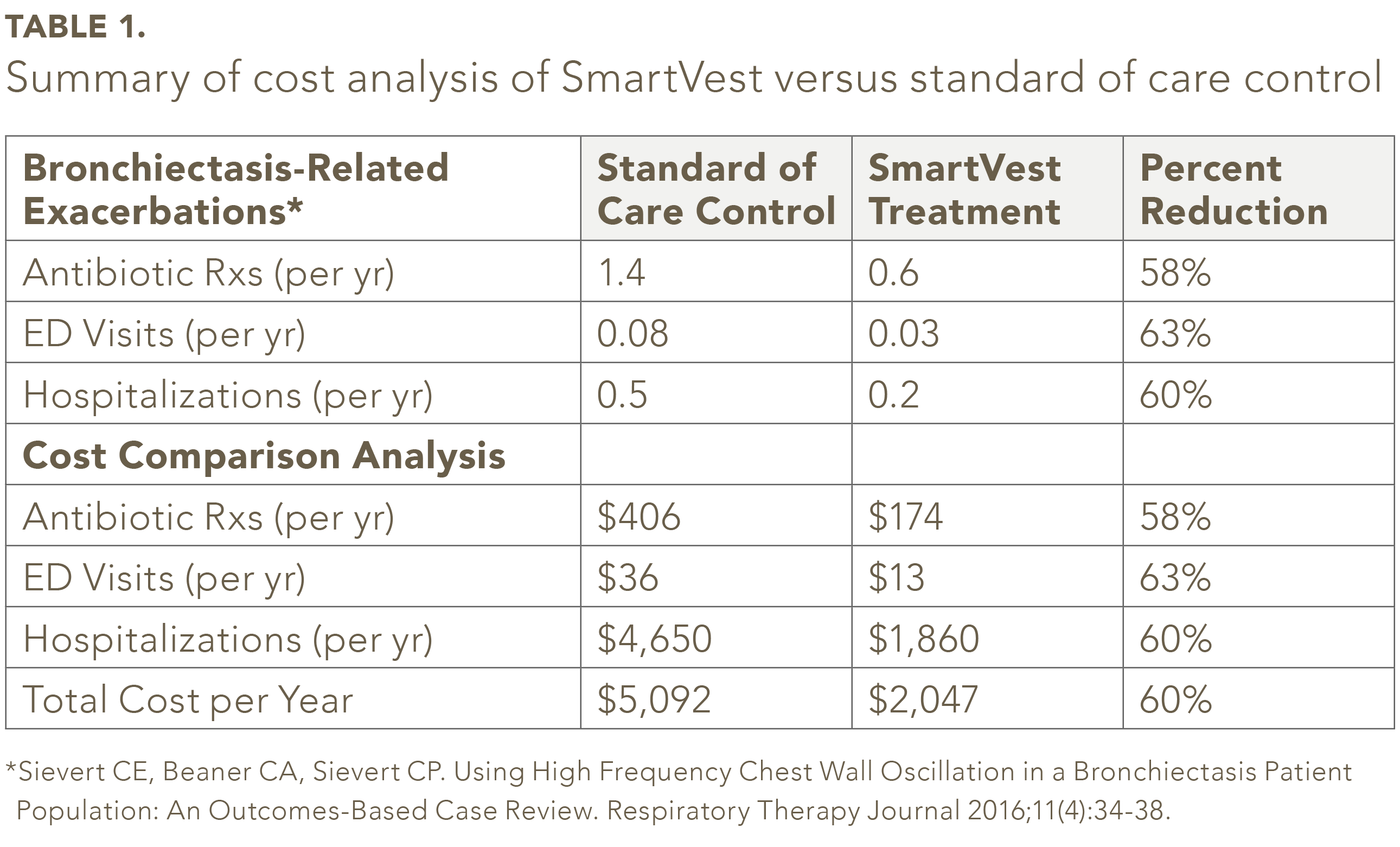
De analyse rekening houden met eventuele kosten voor een arts / kantoor die zijn gemaakt om een antibioticumrecept te krijgen zonder ziekenhuisopname. Ook hield de analyse geen rekening met een kantoorbezoek voor een mogelijke exacerbatie die niet resulteerde in een recept of ziekenhuisopname. Bovendien hield de analyse geen rekening met extra kosten als de exacerbatie een antibioticaresistente bacteriestampneumonie was die naar verluidt meer dan $ 15.000 per episode kan kosten.
Discussie
Het doel van de analyse was om de economische impact van het gebruik van SmartVest op aan bronchiëctasieën gerelateerde medische kosten te evalueren in vergelijking met een standaardzorgcontrole. Voor zover wij weten, is dit de eerste studie om de gezondheidszorgkosten te beoordelen van de behandeling van niet-cystische fibrose bronchiëctasieën met HFCWO.De totale kosten omvatten de kosten van antibiotica, ED-bezoeken en ziekenhuisopnames in verband met exacerbaties geassocieerd met niet-cystische fibrose bronchiëctasie. De studie toonde een significante vermindering van het gebruik van de gezondheidszorg en de bijbehorende kosten aan wanneer bronchiëctasiepatiënten een jaar lang met SmartVest werden behandeld. De totale kosten werden met 60% verlaagd, wat zich vertaalt in een besparing van $ 3.045 per patiënt per jaar.
Een recente studie waarin ontslagen, heropnames en ED-bezoeken voor COPD of bronchiëctasieën bij volwassenen in de Verenigde Staten werden geëvalueerd gevonden tussen 2001 en 2012 steeg het aantal ontslagen uit het ziekenhuis met 88.000.31 Uit het onderzoek bleek ook dat ongeveer 7% van de patiënten met COPD of bronchiëctasie binnen 30 dagen opnieuw werd opgenomen met COPD of bronchiëctasie als hoofddiagnose.31 Daarentegen nam het ontslagpercentage af. voor andere ziekten.31 De reden voor de aanzienlijke toename van COPD en bronchiëctasieën in ziekenhuizen en ED-bezoeken is niet duidelijk aangezien er een significante afname van het aantal rokers is waargenomen. Het kan echter een weerspiegeling zijn van het potentieel onder diagnose van de ziekte en de langetermijnkarakteristieken van COPD en bronchiëctasieën bij een verouderende bevolking.31
Een eerdere uitkomstgebaseerde studie meldde dat het gebruik van SmartVest ziekenhuisopnames verminderde door 1,5 maal, 25 geeft het kostenvoordeel aan van HFCWO voor het verminderen van de zorggebruiklast. Andere onderzoeken hebben ook factoren geëvalueerd (zowel systeem als patiënt) die de heropname bij patiënten met COPD kunnen verminderen, en die, althans gedeeltelijk, relevant zijn voor patiënten met bronchiëctasieën. Deze factoren omvatten continuïteit met de geboden eerstelijnszorg van de patiënt of de longarts, interventie van de ontslagcoördinator en de mate of het type ademhalingstherapie.32-34
Een afname van het aantal bronchiëctasegerelateerde exacerbaties kan ook een impact hebben op een kwaliteit van leven van de patiënt.35,36 In een populatie van patiënten met COPD werd het gebruik van SmartVest geassocieerd met een significante verbetering van de vijf-symptoomscore P = 0,002 (beoordeling van sputum, piepende ademhaling, hoesten, kortademigheid en inspanningstolerantie 36 SmartVest-behandeling toonde ook een significante verbetering aan in de St.George’s Respiratory Questionnaire (SGRQ) P = 0,02, terwijl er geen verbetering werd waargenomen bij patiënten die met conventionele behandeling werden behandeld.36 Evenzo bleek uit onze eerdere case review-uitkomst-studie dat 68 % van de proefpersonen gaf tijdens het telefoongesprek aan dat het gebruik van SmartVest hun kwaliteit van leven aanzienlijk had verbeterd.25
Er moet rekening worden gehouden met verschillende beperkingen van de onderzoeksopzet rood bij het interpreteren van de resultaten. De patiëntengrootte van het onderzoek was klein en de gegevens over ziekenhuisopnames, ED-bezoeken en antibioticagebruik na het starten van de SmartVest-therapie werden voornamelijk verkregen via een patiëntinterview. Het onderzoek kan als conservatief worden beschouwd omdat er geen kosten worden toegevoegd voor de kosten van een arts die verband houden met een kantoorbezoek dat resulteert in een antibioticumrecept, of omdat er geen kosten worden toegevoegd voor een kantoorbezoek dat niet heeft geleid tot een antibioticumrecept. Bovendien is het mogelijk dat de Reliance on HCUP-, NIS- en AHRQ-databases, die afhankelijk zijn van de diagnoses die op claims worden ingevoerd, onjuist of helemaal niet gecodeerd zijn, waardoor er mogelijk meetfouten ontstaan met betrekking tot ICD-9-CM-gebaseerde variabelen. / p>
Het verminderen van de kosten van het gebruik van de gezondheidszorg, zoals antibioticagebruik, ED-bezoeken en ziekenhuisopnames, zijn prioritaire doelstellingen van recente gezondheidsrichtlijnen zoals de Affordable Care Act (ACA). De ACA heeft bijvoorbeeld het Hospital Refmissions Reduction Program (HRRP) opgericht, dat CMS heeft opgedragen ziekenhuizen te bestraffen door de vergoedingen voor te veel heropnames van patiënten voor dezelfde aandoening te verminderen. HRRP identificeerde oorspronkelijk de top drie van ‘van toepassing zijnde voorwaarden’ voor gerichte heropnamemetingen, waaronder acuut myocardinfarct, hartfalen en longontsteking. Bovendien heeft CMS onlangs de uitbreiding van aanvullende toepasselijke voorwaarden afgerond, te beginnen met het programma van het fiscale jaar 2015, met patiënten die opnieuw zijn opgenomen voor een acute exacerbatie van COPD. De aanzienlijke vermindering van het gebruik van gezondheidszorg en ziekenhuisopnames voor niet-cystische bronchiëctasepatiënten die SmartVest gebruiken, zoals aangetoond in deze studie en andere, kan een cruciale rol spelen bij het helpen van ziekenhuizen om heropnames te verminderen en wordt daarom niet bestraft.
Voor patiënten met luchtweginfecties die resistent zijn tegen orale antibiotica, is de last veel groter en ernstiger. Intraveneuze antibiotica bemoeilijken de zorg enorm omdat ziekenhuisopname of thuisbewaking vereist is. De behandeling voor deze patiënten omvat het plaatsen van een centraal veneuze katheter, coördinatie van de doses medicijnen die vaak moeten worden gegeven multi meerdere keren per dag, regelmatige bloedtesten om te controleren op bijwerkingen, en het meten van bloedspiegels van het antibioticum gedurende vele dagen, stappen die duur worden en het leven van patiënten verstoren.
De Wereldgezondheidsorganisatie (WHO) heeft verklaard dat microbiële resistentie tegen antibiotica een “grote wereldwijde bedreiging vormt met verwoestende gevolgen voor de volksgezondheid”. Antimicrobiële resistentie vormt een bedreiging voor de effectieve preventie en behandeling van een steeds groter wordend aantal infecties, niet alleen veroorzaakt door bacteriën, maar ook door virussen en schimmels. De Amerikaanse Centers for Disease Control and Prevention (CDC) beschouwen antimicrobiële resistentie als een van hun belangrijkste zorgen en prioriteiten. Alleen al in de VS raken minstens 2 miljoen mensen besmet met bacteriën die resistent zijn tegen antibiotica en elk jaar sterven minstens 23.000 mensen als direct gevolg van die infecties.39 Als reactie op de wereldwijde bezorgdheid hebben de Amerikaanse Centers for Medicare & Medicaid Services (CMS) heeft onlangs een voorgestelde wijziging van de regels van haar deelnamevoorwaarden vrijgegeven, die onder andere zou vereisen dat ziekenhuizen antibioticabeheerprogramma’s implementeren om deel te nemen aan Medicare- en Medicaid-programma’s. Antibioticabeheer omvat het verbeteren van de resultaten voor de patiënt door het toepassen van processen en procedures die de incidentie van infecties met pa bijzondere aandacht voor longontsteking, zoals preventieve zorg. Als een secundair voordeel van de kosten-batenresultaten van deze studie, kan een significante vermindering van de behoefte aan antibiotica bij bronchiëctasepatiënten door het gebruik van SmartVest zelfs grotere voordelen hebben dan verlaging van de kosten. Een beschikbare behandeling die luchtweginfecties en dus de behoefte aan antibiotica aanzienlijk zou kunnen verminderen, past goed binnen de infectiebeheersingsprogramma’s van ziekenhuizen.
Samengevat, de klinische effectiviteit van HFCWO-luchtwegklaring aangetoond door SmartVest bij patiënten met COPD36 en mensen met bronchiëctasieën25 en de significante vermindering van de kosten voor antibiotica, ED en ziekenhuisopname die in deze studie werden waargenomen, ondersteunt het kostenvoordeel van het gebruik van SmartVest en pleit voor verzekeringsdekking van SmartVest door betalers. Bovendien kunnen secundaire voordelen, zoals het potentieel om heropnames in ziekenhuizen te verminderen en het potentieel om van invloed te zijn op het afschrikken van antibioticaresistentie, zelfs grotere voordelen hebben dan het verlagen van de kosten.
Download de studietekst
Dankbetuigingen
De auteurs willen Elizabeth Goodwin PhD bedanken voor redactionele ondersteuning.
- King P. Pathogenese van bronchiëctasieën. Paediatr Respir Rev 2011; 12 (2): 104-110. 10.1016 / j.prrv.2010.10.011
- Braverman J, Miller H. Hoogfrequente borstcompressie: een praktische therapie voor patiënten met bronchiëctasieën. Ademhalingstherapie 2008; 3 (1): 22-26.
- Patel IS, Vlahos I, Wilkinson TM, et al. Bronchiëctasie, exacerbatie-indices en ontsteking bij chronische obstructieve longziekte. Am J Respir Crit Care Med 2004; 170 (4): 400-407. 10.1164 / rccm.200305-648OC
- Gono H, Fujimoto K, Kawakami S, et al. Evaluatie van de wanddikte van de luchtwegen en luchtinsluiting door HRCT bij asymptomatische astma. Eur Respir J 2003; 22 (6): 965-971.
- Weycker D, Edelsberg J, Oster G, et al. Prevalentie en economische belasting van bronchiëctasie. Clinical Pulmonary Medicine 2005; 12 (4): 205-209.
- Seitz AE, Olivier KN, Adjemian J, et al. Trends in bronchiëctasieën bij begunstigden van medicare in de Verenigde Staten, 2000 tot 2007. CHEST Journal 2012; 142 (2): 432-439.
- Seitz AE, Olivier KN, Steiner CA, et al. Trends en belasting van bronchiëctasegerelateerde ziekenhuisopnames in de Verenigde Staten, 1993-2006. Borst 2010; 138 (4): 944-949. 10.1378 / chest.10-0099
- Seitz AE, Olivier KN, Steiner CA, et al. Trends en belasting van bronchiëctasegerelateerde ziekenhuisopnames in de Verenigde Staten, 1993-2006. CHEST Journal 2010; 138 (4): 944-949.
- Weycker D, Edelsberg J, Oster G, et al. Prevalentie en economische belasting van bronchiëctasie. Clinical Pulmonary Medicine 2005; 12: 205-209.
- Fibrose. AoCPiC. Zorgstandaarden en goede klinische praktijken voor het beheer van fysiotherapie van cystische fibrose 2011. Beschikbaar vanaf: https://www. cysticfibrosis.org.uk/media/82076/CD Standards of Care Physio Jun 11.pdf.
- O’Donnell AE. Bronchiëctasie. Borst 2008; 134 (4): 815-823. 10.1378 / chest.08-0776
- Barker AF. Bronchiëctasie. N Engl J Med 2002; 346 (18): 1383-1393. 10.1056 / NEJMra012519
- McCool FD, Rosen MJ. Niet-farmacologische therapieën voor het klaren van de luchtwegen: ACCP evidence-based klinische praktijkrichtlijnen. Borst 2006; 129 (1 suppl): 250S-259S. 10.1378 / chest.129.1 suppl.250S
- Salathe M, O’Riordan TG, Wanner A. Behandeling van mucociliaire disfunctie. Borst 1996; 110 (4): 1048-1057.
- Arens R, Gozal D, Omlin KJ, et al. Vergelijking van hoogfrequente thoraxcompressie en conventionele thoraxfysiotherapie bij ziekenhuispatiënten met cystische fibrose. Am J Respir Crit Care Med 1994; 150 (4): 1154-1157. 10.1164 / ajrccm.150.4.7921452
- Fink JB, Mahlmeister MJ. Hoogfrequente oscillatie van de luchtweg en borstwand. Respir Care 2002; 47 (7): 797-807.
- Hansen LG, Warwick WJ.Hoogfrequent compressiesysteem op de borst om te helpen bij het verwijderen van slijm uit de longen. Biomed Instrum Technol 1990; 24 (4): 289-294.
- Lange DJ, Lechtzin N, Davey C, et al. Hoogfrequente oscillatie van de borstwand bij ALS: een verkennend gerandomiseerd, gecontroleerd onderzoek. Neurologie 2006; 67 (6): 991-997. 10.1212 / 01. wnl.0000237439.78935.46
- Warwick WJ, Hansen LG. Het langetermijneffect van hoogfrequente borstcompressietherapie op pulmonale complicaties van cystische fibrose. Pediatr Pulmonol 1991; 11 (3): 265-271.
- Kluft J, Beker L, Castagnino M, et al. Een vergelijking van bronchiale drainagebehandelingen bij cystische fibrose. Pediatr Pulmonol 1996; 22 (4): 271-274. 10.1002 / (SICI) 1099-0496 (199610) 22: 4 < 271 :: AID-PPUL7 > 3.0.CO; 2- P
- Scherer TA, Barandun J, Martinez E, et al. Effect van hoogfrequente orale luchtweg- en borstwandoscillatie en conventionele thoraxfysiotherapie op slijm bij patiënten met stabiele cystische fibrose. Borst 1998; 113 (4): 1019-1027.
- Nicolini A, Cardini F, Landucci N, et al. Effectiviteit van behandeling met hoogfrequente oscillatie van de borstwand bij patiënten met bronchiëctasieën. BMC Pulm Med 2013; 13:21. 10.1186 / 1471-2466-13-21
- Osman LP, Roughton M, Hodson ME, et al. Kortetermijnvergelijkende studie van hoogfrequente oscillatie van de borstwand en Europese technieken voor luchtwegklaring bij patiënten met cystische fibrose. Thorax 2010; 65 (3): 196-200. 10.1136 /
thx.2008.111492 - Chatburn RL. Hoogfrequente luchtwegklaring. Respir Care 2007; 52 (9): 1224-1235; discussie 1235-1227.
- Sievert CE, Beaner CA, Sievert CP. Gebruik van hoogfrequente borstwandtrillingen bij een bronchiëctasiepatiënt: een op resultaten gebaseerd casusoverzicht. Respiratory Therapy Journal 2016; 11 (4): 34-38.
- HCUP. Overzicht van de Nationwide Emergency Department Sample (NEDS) 2016. Beschikbaar vanaf: https://www .hcup-us.ahrq.gov / nedsoverview.jsp.
- Overzicht van de nationale (landelijke) klinische steekproeven. Beschikbaar via: https://www .hcup-us.ahrq.gov / nisoverview.jsp.
- Pfuntner A, Wier LM, Steiner C. Kosten voor ziekenhuisverblijven in de Verenigde Staten, 2010: Statistical Brief # 146. Statistische overzichten van Healthcare Cost and Utilization Project (HCUP). Rockville (MD): Agentschap voor onderzoek en kwaliteit in de gezondheidszorg (VS); 2006.
- Stein PD, Matta F. Kosten van bezoeken aan spoedeisende hulp en ziekenhuisopnames voor pulmonale arteriële hypertensie.
J Epidemiol Public Health Rev 2016; 1 (3). doi http://dx.doi. org / 10.16966 / 2471-8211.120 - Kangovi S, Grande D. Transitional care management-vergoeding om COPD-heropname te verminderen. Borst
2014; 145 (1): 149-155. 10.1378 / chest.13-0787 - Ford ES. Ziekenhuisontslagen, heropnames en ED-bezoeken voor COPD of bronchiëctasieën bij Amerikaanse volwassenen: bevindingen
uit de landelijke steekproef 2001-2012 en de steekproef van de landelijke spoedeisende hulp 2006-2011. Borst 2015; 147 (4): 989-998. 10.1378 / chest.14-2146 - Sharma G, Kuo YF, Freeman JL, et al. Poliklinische follow-upbezoek en 30-dagen spoedeisende hulpafdeling en heropname bij patiënten die in het ziekenhuis zijn opgenomen voor chronische obstructieve longziekte. Arch Intern Med 2010; 170 (18): 1664-1670. 10.1001 / archinternmed.2010.345
- Lainscak M, Kadivec S, Kosnik M, et al. Interventie van de ontslagcoördinator voorkomt ziekenhuisopnames bij patiënten met COPD: een gerandomiseerde gecontroleerde studie. J Am Med Dir Assoc 2013; 14 (6): 450 e451-456. 10.1016 / j.jamda.2013.03.003
- Revitt O, Sewell L, Morgan MD, et al. Een kort poliklinisch longrevalidatieprogramma vermindert heropname na ziekenhuisopname wegens verergering van chronische obstructieve longziekte. Respirologie 2013; 18 (7): 1063-1068. 10.1111 / resp.12141
- Milne RJ, Hockey H, Rea H. Langdurige luchtbevochtigingstherapie is kosteneffectief voor patiënten met matige of ernstige chronische obstructieve longziekte of bronchiëctasieën. Waarde Gezondheid 2014; 17 (4): 320-327. 10.1016 / j.jval.2014.01.007
- Chakravorty I, Chahal K, Austin G. Een pilootstudie naar de impact van hoogfrequente oscillatie van de borstwand bij patiënten met chronische obstructieve longziekte met hypersecretie van slijm. Int J Chron Obstruct Pulmon Dis 2011; 6: 693-699. 10.2147 / COPD. S22896.
- Martınez-Garcıa MA, et al. Prognostische waarde van bronchiëctasieën bij patiënten met matige tot ernstige chronische obstructieve longziekte. Am J Respir Crit Care Med 2013; Vol 187, Iss. 8, pp 823-831.
- O’Donnell AE. Bronchiëctasie. Chest 2008; 134: 815–82.
- Centra voor ziektebestrijding en -preventie – website over antibiotica / antimicrobiële resistentie https://www .cdc.gov / drugresistance /