Polonium-elementfeiten
Het chemische element polonium wordt geclassificeerd als een chalcogeen en een metalloïde. Het werd in 1898 ontdekt door Marie en Pierre Curie.

Data Zone
| Classificatie: | Polonium is een chalcogeen en een metalloïde |
| Kleur: | zilvergrijs |
| Atoomgewicht : | (209), geen stabiele isotopen |
| Staat: | solide |
| Smeltpunt: | 254 oC, 527 K |
| Kookpunt: | 960 oC, 1233 K |
| Elektronen: | 84 |
| Protonen: | 84 |
| Neutronen in de meest voorkomende isotoop: | 125 |
| Elektronenschalen: | 2,8 , 18,32,18,6 |
| Elektronenconfiguratie: | 4f14 5d10 6s2 6p4 |
| Dichtheid @ 20oC: | 9,4 g / cm3 |
Meer weergeven, inclusief: Heats, Energies, Ox idation,
Reacties, Compounds, Radii, Conductivities
| Atoomvolume: | 22,23 cm3 / mol |
| Structuur: | eenvoudige kubieke |
| Hardheid: | – |
| Specifieke warmtecapaciteit | 0,12 J g-1 K-1 0,12 |
| Smeltwarmte | 13 kJ mol-1 |
| Vernevelingswarmte | 142 kJ mol-1 |
| Verdampingswarmte | 120 kJ mol-1 |
| 1e ionisatie-energie | 812 kJ mol-1 |
| 2e ionisatie-energie | – |
| 3e ionisatie-energie | – |
| Elektronenaffiniteit | 180 kJ mol-1 |
| Minimum oxidatiegetal | -2 |
| Min. gemeenschappelijk oxidatienummer | -2 |
| Maximaal oxidatiegetal | 6 |
| Max. gemeenschappelijke oxidatie nr. | 4 |
| Elektronegativiteit (Pauling-schaal) | 2.0 |
| Polariseerbaarheid volume | 6,8 Å3 |
| Reactie met lucht | mild, ⇒ PoO2 |
| Reactie met 15 M HNO3 | – |
| Reactie met 6 M HCl | mild, ⇒ PoCl2 |
| Reactie met 6 M NaOH | geen |
| Oxide (s) | PoO2, PoO2 |
| Hydride (s) | PoH2 |
| Chloride (s) | PoCl2 |
| Atoomradius | 190 pm |
| Ionische straal (1+ ion) | – |
| Ionische straal (2+ ion) | – |
| Ionisch straal (3+ ion) | – |
| Ionische straal (1- ion) | – |
| Ionische straal (2- ion) | – |
| Ionische straal (3- ion) | – |
| Thermische geleidbaarheid | 0.2 W m-1 K-1 |
| Elektrische geleidbaarheid | 0,7 x 106 S m-1 |
| Bevriezing / smeltpunt: | 254 oC, 527 K |

Marie Curie in 1883, 16 jaar oud. Polonium was het eerste element dat ze ontdekte, 15 jaar later.
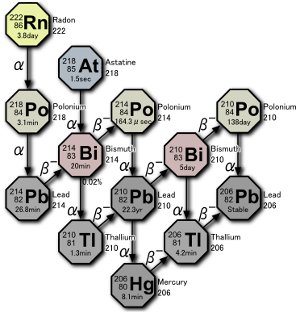
Een deel van de uranium verval serie. Drie isotopen van polonium worden in de natuur geproduceerd, hetzij door het verval van radongas zelf, hetzij door het verval van atomen als gevolg van het verval van radon. Afbeelding door Tosaka.
Ontdekking van Polonium
Polonium was het eerste element dat door Marie en Pierre Curie werd ontdekt.
Ze ontdekten polonium en vervolgens radium in 1898 in Parijs, terwijl ze radioactiviteit in pitchblende (uraniumoxide) onderzochten. / p>
Ze schreven: “We geloven dat de stof die we uit pekblende hebben gehaald een metaal bevat dat nog nooit eerder bekend was, vergelijkbaar met bismut in zijn analytische eigenschappen. polonium genoemd naar de naam van het land van herkomst van een van ons. ”
In overeenstemming met de wensen van de Curies is polonium vernoemd naar Polen, waar Marie Curie is geboren en opgegroeid.
De gevaren van het werken met radioactieve elementen waren niet bekend toen de Curies hebben hun ontdekkingen gedaan. Hun laboratoriumnotitieboekjes uit deze tijd zijn zo radioactief dat ze nu in een met lood beklede doos worden bewaard. p>
Polonium is schadelijk zowel door zijn chemische toxiciteit als door zijn radioactiviteit. Polonium-210 is een alfastraler en is daarom zeer gevaarlijk bij inslikken of inademen.Blootstelling aan polonium verhoogt het risico op het krijgen van verschillende soorten kanker.
Kenmerken:
Polonium is een zeldzame, zilvergrijze, radioactieve, laagsmeltende metalloïde.
Polonium reageert gemakkelijk met verdunde zuren, maar slechts in geringe mate met basen.
Al zijn isotopen zijn radioactief.
210Po straalt een blauwe gloed uit, omdat de lucht eromheen wordt opgewekt door het verval producten. 1 gram Po stoot evenveel alfadeeltjes uit als 5 kilogram radium.
De energie die vrijkomt door het alfa-verval van polonium is aanzienlijk en verwarmt de ruimte eromheen. De vrijkomende energie is zo groot (140 W / g) dat een capsule met ongeveer een halve gram een temperatuur van meer dan 500 ° C bereikt.
Gebruik van polonium
De alfastralen die worden uitgezonden door polonium kan worden gebruikt om statische elektriciteit te elimineren die wordt geproduceerd tijdens processen zoals vloei, draad en plaatwerk. Beta-straalbronnen worden echter vaker gebruikt omdat ze minder gevaarlijk zijn.
210Po kan worden gebruikt als atoomwarmtebron, maar vanwege de korte halfwaardetijd van de isotoop (138,4 dagen) levert het geen stroom voor langdurig gebruik.
Polonium wordt ook gebruikt in antistatische borstels om stof op fotografische film te verwijderen. Het is verzegeld in borstels om de radioactieve emissies te beheersen.
Overvloed en isotopen
Overvloed aardkorst: in de orde van grootte van 1 deel per biljard.
Overvloed zonnestelsel: verwaarloosbaar
Kosten , puur: per 100 g
Kosten, bulk: per 100 g
Bron: Polonium is een zeer zeldzaam element vanwege de korte halfwaardetijd van al zijn isotopen. Het wordt in zeer kleine hoeveelheden in uraniumertsen aangetroffen. Het kan worden verkregen door natuurlijk bismut, 209Bi, te bombarderen met neutronen om 210Bi te geven, dat vervolgens vervalt tot 210Po via β-verval. Elk jaar wordt ongeveer 100 g polonium gesynthetiseerd.
Isotopen: Polonium heeft 29 isotopen waarvan de halfwaardetijden bekend zijn, met massagetallen 190 tot 218. Geen enkele is stabiel. De meest stabiele isotoop is 209Po, met een halfwaardetijd van 102 jaar.

Citeer deze pagina
Voor online linken, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
of
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Gebruik de volgende MLA-compatibele bronvermelding om deze pagina in een academisch document te citeren:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.