Tijdschriften | Beleid | Toestemming Gastro-enterologisch onderzoek
Voorspelbaarheid van maagdarmmetaplasie door gevlekte, fragmentarische erytheem gezien op endoscopie
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
a Department of Gastroenterology and Hepatology, National Center for Global Health and Medicine (NCGM), Tokyo, Japan
bDepartment of Clinical Research and Informatics International Clinical Research Center Research Institute, NCGM, Tokyo, Japan
cDivision of Internal Medicine, Kosin University College of Medicine, Busan, Korea
dDepartment of Gastroenterology and Hepatology, Wakayama Medical University, Wakayama, Japan
eDepartment van Clinical Laboratory Pathological Division, NCGM, Tokio, Japan
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Japan
gCorresponderende auteur: Naoyoshi Nagata, Department of G astroenterology and Hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokyo 162-8655, Japan
Manuscript geaccepteerd voor publicatie 26 september 2011
Korte titel: Endoscopische diagnose van intestinale metaplasie
doi: https://doi.org/10.4021/gr357w
- Samenvatting
- Inleiding
- Methoden
- Resultaten
- Discussie
| Abstract | ▴Top |
Achtergrond: Intestinale metaplasie (IM) wordt beschouwd als een premaligne laesie. Endoscopische diagnose van IM werd echter als moeilijk beschouwd. Met behulp van endoscopie hebben we een uniek patroon van erytheem gevonden, “Gevlekt fragmentarisch erythema (MPE)”, dat ernstige IM omvat. Helicobacter pylori (Hp) -infectie zelf kan erytheem veroorzaken, wat histologische veranderingen in het maagslijmvlies weerspiegelt. Daarom hebben we Hp-eradicatie ingeschreven patiënten om de relatie tussen MPE en pathologische bevindingen te valideren.
Methoden: We namen patiënten met chronische gastritis op die een succesvolle Hp-uitroeiing ondergingen ten minste 6 maanden voor het onderzoek. We definieerden MPE als meerdere platte of depressieve erythemateuze laesies. Toen we MPE tegenkwamen op endoscopie, voerden we een biopsie uit op zowel de MPE-site als de niet-MPE-site. De niet-MPE-site werd gedefinieerd als een aangrenzend slijmvlies binnen 3 cm van de MPE-site. Alle biopsiemonsters werden immunohistochemisch beoordeeld op IM-subtype met MUC2-, MUC5AC-, MUC6-, CD10- en CDX2-kleuringen. De mate van IM werd gedefinieerd volgens het Updated Sydney System. De diagnostische nauwkeurigheid van de MPE-bevindingen voor pathologische IM werd berekend. De relatie tussen MPE en IM-subtype werd ook beoordeeld.
Resultaten: In totaal werden 102 patiënten geselecteerd voor het onderzoek. Hiervan hadden 55 (54%) patiënten MPE. Bij deze 55 patiënten werden biopsiemonsters genomen van de MPE-locaties en niet-MPE-locaties. De IM-percentages en mediane scores van IM waren beide significant hoger op de MPE-locaties (P < 0,001) dan op de niet-MPE-locaties. De gevoeligheid en specificiteit voor MPE bij de detectie van histologische IM waren respectievelijk 72,7% en 84,1%. Er werden geen significante associaties waargenomen in de expressie van MUC2, MUC5AC, MUC6, CD10 en CDX2 tussen de MPE-sites en niet-MPE-sites. Er waren geen significante verschillen in de verhoudingen (compleet / onvolledig) van IM-subtypen tussen de twee groepen.
Conclusies: MPE is een nuttige endoscopische bevinding om histologische IM te detecteren zonder het gebruik van chromo-endoscopie en vergrotende endoscopie. Het IM-subtype is echter moeilijk te identificeren. In het tijdperk van Hp-uitroeiing heeft MPE het potentieel om een voorspellende bevinding te worden voor het risico op maagkanker.
Trefwoorden: Intestinale metaplasie; Premaligne laesie; Endoscopische bevinding; Erytheem; Endoscopie met wit licht; Subtype, uitroeiing; Helicobacter pylori
| Inleiding | ▴Top |
Aangenomen wordt dat de ontwikkeling van maagkanker een proces is dat uit meerdere stappen bestaat, waaronder infectie met Helicobacter pylori (Hp), chronische gastritis, glandulaire atrofie, intestinale metaplasie (IM) en ten slotte dysplasie. IM en maagatrofie worden samen beschouwd als risicofactoren voor de ontwikkeling van maagkanker van het intestinale type en worden beschouwd als premaligne laesies.Maagatrofie kan worden herkend door endoscopie en correleert met histologische evaluatie. De diagnose van IM met behulp van standaard witlicht-endoscopie wordt echter als moeilijk beschouwd omdat IM geen onderscheid in kleur heeft en de aanwezigheid ervan als meerdere platte laesies.
Onlangs , ontdekten we dat een unieke erythemateuze bevinding bij endoscopie kon worden waargenomen, zelfs na uitroeiing van Hp. We omschrijven deze bevinding als ‘Gevlekte, vlekkerige erytheem (MPE)’. MPE kan worden herkend als meerdere platte of licht depressieve erythemateuze laesies onder standaard witlicht-endoscopie; pathologisch omvat het ernstige IM. Hp-infectie zelf kan erytheem veroorzaken, te zien op endoscopie, dat histologische veranderingen weerspiegelt, zoals infiltratie van ontstekingscellen en oedeem. hebben we patiënten opgenomen die HP-uitroeiing ondergingen om de relatie tussen MPE en pathologische bevindingen te valideren.
| Methoden | ▴Top |
Patiëntselectie
Patiënten met chronische gastritis die een succesvolle Hp-uitroeiing ondergingen ten minste 6 maanden voorafgaand aan het onderzoek, werden prospectief ingeschreven voor het onderzoek bij het National Center for Global Health and Medicine (NCGM) tussen januari 2008 en december 2008. Uitsluitingscriteria i Inclusief het gebruik van niet-steroïde anti-inflammatoire geneesmiddelen (NSAID’s), maagzuurremmers en anti-trombotische geneesmiddelen gedurende de 4 weken voorafgaand aan de endoscopie. We hebben ook patiënten uitgesloten met een voorgeschiedenis van maagoperaties, hemorragische aandoeningen, levercirrose, nierfalen, hartfalen en vroege of gevorderde maagkanker. Schriftelijke geïnformeerde toestemming werd verkregen van de deelnemers in overeenstemming met de Verklaring van Helsinki en de daaropvolgende herziening ervan. Het studieprotocol is goedgekeurd door de ethische commissie van de NCGM.
Helicobacter pylori uitroeiing
Patiënten met chronische gastritis en maagzweren veroorzaakt door Hp-infectie ondergingen eradicatietherapie. Patiënten werden behandeld met een 7-daagse kuur bestaande uit amoxicilline, claritromycine en een protonpompremmer (PPI) tweemaal daags, wat de standaard eerstelijnsbehandeling was die in Japan werd goedgekeurd. Als de uitroeiing niet succesvol was, werd een tweede regime, bestaande uit amoxicilline, metronidazol en PPI, toegediend. De uitroeiing werd bevestigd door negatief histologisch onderzoek van de maagbiopten, samen met een negatieve 13C-ureumademtest (13C-UBT) 2 tot 3 maanden na voltooiing van de eradicatietherapie. Als alle tests negatief waren, werd een patiënt gedefinieerd als negatief voor Hp-infectie.
Endoscopische beoordeling
Ten minste zes maanden na de uitroeiing van Hp ondergingen de patiënten endoscopisch onderzoek. We gebruikten een endoscoop met hoge resolutie zonder vergroting (Olympus-videoscoop, model GIF-H260) om de aanwezigheid van MPE in het maagslijmvlies te observeren. We definieerden MPE als meerdere platte of licht depressieve erythemateuze laesies die te onderscheiden waren van verstopt slijmvlies, bloeding, angioectasie, vlekkerig erytheem en lineair erytheem (Fig. 1A, B). We hebben ook onderscheid gemaakt tussen MPE en roodachtig slijmvlies met een regenererend epitheel, vergezeld van een zweer of zweerlitteken.
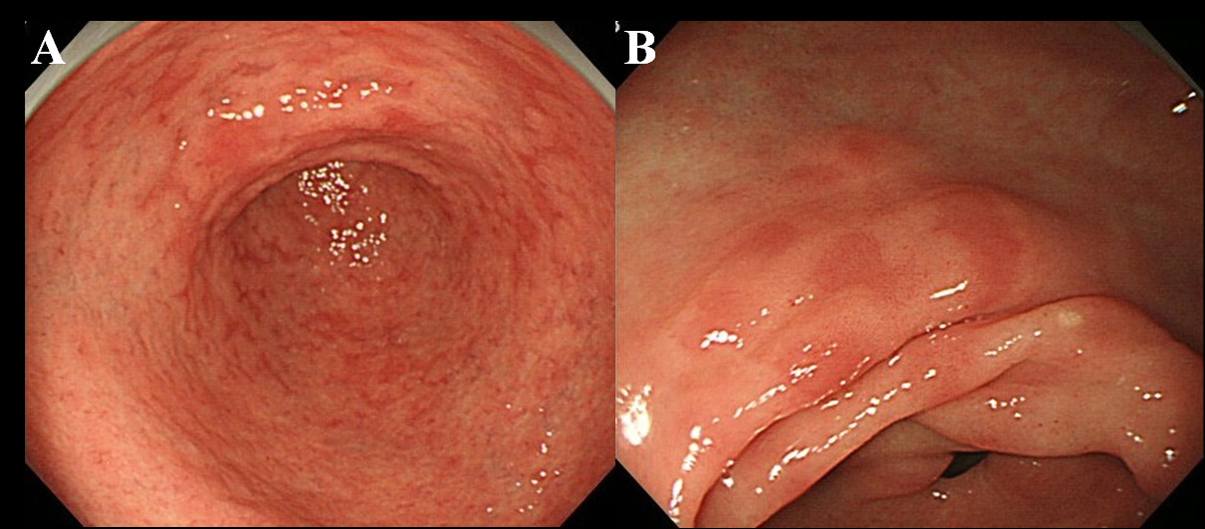 Klik voor grote afbeelding |
Figuur 1. Endoscopische bevinding van MPE. (A) Meervoudig en plat erytheem in het antrum; (B) Vlak en depressief erytheem in de mindere kromming van het antrum. |
Bij een bevinding van MPE-bevinding bij endoscopie, hebben we een biopsie uitgevoerd van zowel de MPE-site als de niet-MPE-site. De niet-MPE-locatie werd gedefinieerd als een aangrenzend slijmvlies dat zich binnen 3 cm van de MPE-locatie bevindt (afb. 2).
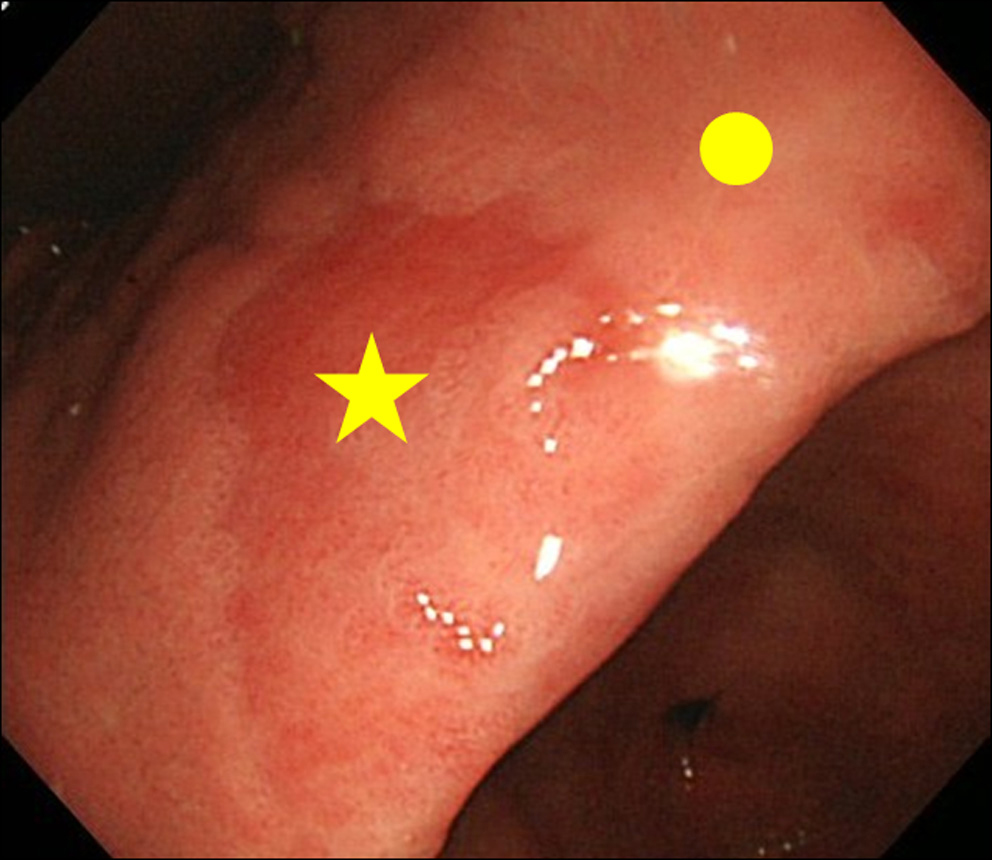 Klik voor grote afbeelding |
Figuur 2. Biopsiesite. (★) Biopsieplaats van MPE; (•) Biopsiesite van niet-MPE. Niet-MPE-site werd gedefinieerd als een aangrenzend slijmvlies dat zich binnen 3 cm van de MPE-site bevindt. |
De omvang van de atrofische grens werd ingedeeld in 3 fasen: mild, matig en ernstig, zoals gedefinieerd door Kimura en Takemoto.
Histologische beoordeling
Biopsiemonsters werden naar ons laboratorium gestuurd, gefixeerd in 10% gebufferde formaline. De monsters werden verwerkt, ingebed in paraffine en in secties van 4 µm gesneden. Objectglaasjes van elk monster werden gekleurd met hematoxyline-eosine (HE) (Fig.3A) en immunohistochemische kleuring. De immunohistochemische kleuringen omvatten het volgende: (1) MUC2, een marker van darmmucine die nuttig is voor het detecteren van slijmbekercellen (Fig. 3B), (2) MUC5AC, een marker van maagslijmvlies, die tot expressie wordt gebracht in slijmhalscellen en de foveolair epitheel (Fig. 3C), (3) MUC6, een marker voor maagslijmvlies, die wordt uitgedrukt in slijmcellen van de nekzone van het lichaam en pylorische klieren van het antrum (Fig. 3D), (4) CD10, a nuttige marker voor het detecteren van de borstelrand van de dunne darm (Fig. 3E), en (5) CDX2, een marker voor de aanwezigheid van IM (Fig. 3F). We gebruikten CDX2 omdat recente studies hebben aangetoond dat CDX2-expressie uitgebreid kon worden waargenomen in IM-klieren en niet verdween na uitroeiing van Hp. De aanwezigheid van IM werd bevestigd door zowel HE als immunohistochemische kleuring.
De subtypen van IM werden geclassificeerd als volledige of onvolledige typen. Het volledige type werd gedefinieerd als verminderde expressie van maagslijmvlies (MUC5AC of MUC6) en co-expressie van darmmucine (MUC2) en CD10 (Fig. 3A-F). Het onvolledige type werd gedefinieerd als de expressie van maagslijmvlies (MUC5AC of MUC6) en MUC2. Omdat er geen vaste criteria bestaan om een aanvraag te categoriseren met zowel de volledige als de onvolledige typen in één sectie, hebben we de IM-subtypen toegewezen als het meest voorkomende type.
De mate van IM werd gescoord op basis van het bijgewerkte Sydney-systeem (0: geen, 1: mild, 2: matig, 3: gemarkeerd).
Statistische analyse
We verdeelden de patiënten in twee groepen op basis van of de patiënten positief of negatief waren voor MPE. We gebruikten de t-test van Student om leeftijd en periode van uitroeiing te vergelijken. De chikwadraattest of Fisher’s exacte waarschijnlijkheidstest werden gebruikt voor de geslachtsverhoudingen en de mate van endoscopische atrofie in de twee groepen.
We hebben ook de histologische bevindingen tussen de MPE-sites en de niet-MPE-sites vergeleken. Om de verschillen tussen de twee biopsiesites te vergelijken, gebruikten we de Wilcoxon Matched-Pairs Signed-Ranks Test voor de IM mediane score en Fisher’s exacte test voor de prevalentie van IM, IM-subtypen en IM-fenotypes. De sensitiviteit, specificiteit, positieve en negatieve voorspellende waarden, en positieve en negatieve waarschijnlijkheidsverhoudingen van MPE waargenomen bij endoscopie voor de detectie van pathologische IM werden berekend. P-waarden < 0,05 werden als significant beschouwd. Alle statistische analyses werden uitgevoerd met Stata-software, versie 10 (StataCorp LP, College Station, TX, VS).
| Resultaten | ▴Top |
Patiëntkenmerken
Tijdens de onderzoeksperiode hebben 157 patiënten die een bovenste endoscopie ondergingen en Hp-uitroeiing kregen, werden beoordeeld. We hebben 52 van de 157 patiënten uitgesloten van de analyse op basis van een van de volgende criteria: gebruik van antacida (31), antitrombotische geneesmiddelen (17) of NSAID’s (3); of geschiedenis van levercirrose (5), hartfalen (1) of vroege maagkanker (2). Op sommige patiënten werd meer dan één uitsluitingscriterium toegepast.
In totaal werden daarom 102 patiënten na uitsluiting voor analyse geselecteerd. Hiervan waren er 55 (54%) patiënten met MPE. Er werden geen significante verschillen opgemerkt in de gemiddelde leeftijd en het geslacht tussen MPE-positieve en -negatieve patiënten (tabel 1). Er waren geen significante verschillen tussen de twee groepen na de uitroeiingsperiode van Hp. Maagatrofie met een hogere ernst (matig tot ernstig) kwam echter significant vaker voor in de MPE-positieve groep vergeleken met de MPE-negatieve groep (positief 65,6% versus negatief 45,0%, P = 0,035).
 Klik om |
tabel 1 te bekijken. Demografische kenmerken van patiënten (n = 102) |
Endoscopische bevindingen en pathologische kenmerken
 Klik om te bekijken |
Tabel 2. Vergelijking van IM-score tussen MPE en niet-MPE-site (n = 55) |
Er zijn geen significante associaties waargenomen in de expressie van MUC2, MUC5AC, MUC6, C D10 en CDX2 tussen de MPE-sites en de niet-MPE-sites (tabel 3). Er was geen significant verschil in de verhoudingen (compleet / onvolledig) van IM-subtypen tussen de twee groepen (MPE: 18/30 versus niet-MPE: 8/10, P = 0,778).
 Klik om |
Tabel 3 te bekijken. Fenotypes en subtypes van intestinale metaplasie |
| Discussie | ▴Top |
In deze studie hebben we ons gericht op een uniek erythemateus uiterlijk dat te zien is bij endoscopie na uitroeiing van HP. We noemden deze bevinding “MPE” en we ontdekten dat de aanwezigheid van MPE zoals waargenomen bij endoscopie typisch kenmerkend was voor pathologische IM.
De diagnose van IM met conventionele endoscopie is werd als moeilijk beschouwd omdat IM meestal voorkomt in vlak slijmvlies en weinig morfologische veranderingen vertoont Kaminishi et al rapporteerden “as-gekleurde nodulaire verandering” als een indicator voor IM; de nauwkeurigheid van de bevindingen van deze onderzoekers was hoog, met een specificiteit van 98-99%, maar de gevoeligheid was laag (6-12%). Kaminishi et al. Merkten op dat conventionele endoscopie minder nuttig is om de diagnose IM te bevestigen. Recente studies zijn naar voren gekomen met betrekking tot de endoscopische bevinding van IM met behulp van vergrotende endoscopie. Er is gemeld dat de kenmerkende bevindingen van maagkuilen die werden waargenomen met methyleenblauw-chromo-endoscopie en het “villusachtige uiterlijk” dat werd waargenomen bij confocale endoscopie, nuttig waren voor het diagnosticeren van IM. Uedo et al. Rapporteerden dat het verschijnen van “een lichtblauwe kam” ( LBC) is een nauwkeurig teken voor de aanwezigheid van IM, zoals te zien is bij narrow band imaging (NBI) -vergrotende endoscopie. Vanwege de hoge apparatuurkosten en de extra vaardigheden en tijd die nodig zijn voor nader onderzoek met behulp van speciaal gereedschap zoals NBI of vergrotende endoscopie, is screening met deze apparatuur niet praktisch in de dagelijkse klinische praktijk. Bovendien is er een verhoogd risico op beschadiging van het DNA in het maagdarmslijmvlies bij gebruik van chromo-endoscopie met methyleenblauw gevolgd door wit licht, wat voorzichtigheid vereist bij het gebruik ervan. Daarom is het gunstiger om IM te diagnosticeren door MPE te vinden zonder het gebruik van chromo-endoscopie en vergrotende endoscopie. Onze studieresultaten suggereren dat de aanwezigheid van IM kan worden gediagnosticeerd met standaard endoscopie zonder biopsie.
Waarom kan MPE worden waargenomen, zelfs na de uitroeiing van Hp? Dit zou kunnen worden toegeschreven aan de histologische veranderingen in het maagslijmvlies. De opmerkelijke histologische veranderingen na uitroeiing omvatten verbeteringen in de infiltratie van ontstekingscellen, epitheliale hyperplasie en oedeem. De endoscopische beelden van erythemateus en oedemateus slijmvlies die lijken te zijn verbeterd, weerspiegelen deze histologische veranderingen. Daarom speculeren we dat MPE bestaat uit een overgebleven gebied met aanhoudende erythemateuze IM en een snel hersteld niet-IM-gebied als gevolg van succesvolle Hp-uitroeiing. Door de uitroeiing van Hp werd het contrast tussen het MPE-gebied en niet-MPE-gebieden duidelijker. Het is echter niet bekend waarom alleen de MPE-plaats wordt waargenomen als een erythemateus slijmvlies. Waarschijnlijk kan hieruit worden afgeleid dat een zeer dicht gebied van microvaatjes de metaplastische klieren omgeeft; dit is in deze studie niet opgehelderd. Bovendien was de IM-score op de MPE-site significant hoger dan de score op de niet-MPE-site. We speculeren dat het verschijnen van erythemateus slijmvlies geassocieerd is met de aanwezigheid van veel metaplastische klieren.
De huidige studie toonde aan dat het IM complete subtype voornamelijk werd aangetroffen in het maagslijmvlies . De subtypen van IM zijn geclassificeerd in het volledige of onvolledige type; dit zijn de meest gebruikte subtypen. Verschillende onderzoeken hebben aangetoond dat het volledige type geen verhoogd risico op het ontwikkelen van carcinoom vertoont, terwijl het onvolledige type geassocieerd is met een verhoogd risico op maligne transformatie. Het verband tussen de subtypen en het risico op maagkanker wordt echter niet algemeen aanvaard. Momenteel is het moeilijk om een van de subtypen te identificeren met behulp van standaard endoscopie.
Er is gemeld dat Hp-uitroeiingstherapie effectief is bij het voorkomen van zowel gastro-intestinale ulcera als de ontwikkeling van maagkanker. Deze toepassingen van Hp-uitroeiingstherapie zullen waarschijnlijk in de nabije toekomst in de klinische praktijk opduiken. Voorzichtigheid is echter geboden tegen het risico op de ontwikkeling van maagkanker na uitroeiing van Hp. De kenmerken van maagkanker na uitroeiing omvatten naar verluidt pathologisch ernstige IM op het corpus en ernstige maagatrofie zoals gedetecteerd bij endoscopie. Daarom is het noodzakelijk om de aanwezigheid van IM nauwkeurig te observeren, zelfs na de uitroeiing van Hp.
Concluderend is de aanwezigheid van MPE bij endoscopisch onderzoek kenmerkend voor pathologische IM.In de klinische praktijk zou het gunstig zijn om pathologische IM te kunnen diagnosticeren zonder chromo-endoscopie of vergrotende endoscopie. MPE heeft het potentieel om een voorspellende bevinding te worden voor het risico op maagkanker in het tijdperk van Hp-uitroeiing.
Dankbetuigingen
Wij erkennen Dr. Hidenobu Watanabe en Dr. Hiroyoshi Ota voor hun adviserende diensten bij deze studie betreffende de pathologische evaluaties. We willen Hisae Kawashiro, coördinator klinisch onderzoek, bedanken voor hulp bij het verzamelen van gegevens.
Steun verlenen
Dit werk werd ondersteund door de Grant of National Center for Global Health and Medicine (21-108).
Belangenconflicten
De auteurs verklaren dat ze geen belangenconflicten hebben.
| ▴Top |
- Correa P. Menselijke maagcarcinogenese: een meerstappen en multifactorieel proces – eerste lezing over kanker van de American Cancer Society Award Epidemiologie en preventie. Cancer Res. 1992; 52 (24): 6735-6740.
pubmed - Leung WK, Sung JJ. Recensieartikel: intestinale metaplasie en maagcarcinogenese. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Helicobacter pylori-infectie en de ontwikkeling van maagkanker. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Een endoscopische herkenning van de atrofische grens en de betekenis ervan bij chronische gastritis. Endoscopie. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Biopsiesites die geschikt zijn voor de diagnose van Helicobacter pylori-infectie en de beoordeling van de omvang van atrofische gastritis. Ben J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Endoscopische classificatie van chronische gastritis op basis van een pilotstudie door de Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Maagepitheel dysplasie. Hoe klinisch-pathologische achtergrond zich verhoudt tot management. Kanker. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Endoscopische diagnose van maagdarmmetaplasie na uitroeiing van Helicobacter pylori. Endoscopie. 2009; 41 (suppl I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Classificatie en indeling van gastritis. Het bijgewerkte Sydney-systeem. Internationale workshop over de histopathologie van gastritis, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucine-genexpressie in normaal, preneoplastisch en neoplastisch humaan maagepitheel. Cancer Res. 1995; 55 (12): 2681-2690.
pubmed - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. Mucines als sleutelmoleculen voor de classificatie van intestinale metaplasie van de maag. Virchows Arch. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. Intestinale metaplasie van menselijke maag vertoont verschillende patronen van mucine (MUC1, MUC2, MUC5AC en MUC6) expressie. Cancer Res. 1999; 59 (5): 1003-1007.
pubmed - Groisman GM, Amar M, Livne E. CD10: een waardevol hulpmiddel voor de lichtmicroscopische diagnose van microvillous inclusion disease (familiaire microvillous atrofie). Ben J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. De ectopeptidases CD10, CD13, CD26 en CD143 wordt opgereguleerd bij maagkanker. Int J Oncol. 2004; 25 (5): 1223-1232.
pubmed - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Ectopische expressie van homeodomein-eiwit CDX2 in intestinale metaplasie en carcinomen van de maag. Cancer Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Afwijkende expressie van CDX2 in het maagslijmvlies met en zonder intestinale metaplasie: effect van uitroeiing van Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H, et al. Vergrotingschromo-endoscopie voor de diagnose van maagdarmmetaplasie en dysplasie. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Externe validatie van een classificatie voor chromo-endoscopie met vergroting van methyleenblauw bij premaligne maaglaesies. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Endoscopische patronen van maagslijmvlies en de klinisch-pathologische betekenis ervan. Wereld J Gastroenterol. 2003; 9 (11): 2552-2556.
pubmed - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. Een nieuwe methode voor het diagnosticeren van maagdarmmetaplasie: smalbandige beeldvorming met vergrotende endoscopie. Endoscopie. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Vergrotingsendoscopie: verbetert het de analyse van het slijmvliesoppervlak voor de diagnose van gastro-intestinale neoplasieën ?. Endoscopie. 2002; 34 (10): 819-822.
gepubliceerde doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Chromo-endoscopie met methyleenblauw en bijbehorende DNA-schade in de slokdarm van Barrett. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Vijfjarig vervolgonderzoek naar histologische en endoscopische veranderingen in het maagslijmvlies na uitroeiing van Helicobacter pylori. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Twee- tot vierjarige histologische follow-up van maagslijmvlies na Helicobacter pylori-uitroeiing. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. De mucineprofielen van normale maag mucosa, intestinale metaplasie en zijn varianten en maagcarcinoom. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al. Intestinale metaplasie-typen en het risico op maag kanker: een cohortstudie in Slovenië. Int J Cancer. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Detectie van een verhoogde incidentie van vroege maagkanker bij patiënten met intestinale metaplasie type III die nauwlettend worden gevolgd. Darm. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Overzichtsartikel: pre-neoplastische toestanden van het maagslijmvlies – een praktische benadering voor de perplexe arts. Aliment Pharmacol Ther. 2001; 15 (suppl 1): 43-50.
pubmed - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Effect van uitroeiing van Helicobacter pylori op de incidentie van metachroon maagcarcinoom na endoscopische resectie van vroege maagkanker: een open-label, gerandomiseerde gecontroleerde studie. Lancet. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Maagkanker ontdekt na uitroeiing van Helicobacter pylori. Spijsvertering endoscopie. 2007; 19: 167-173.
Dit is een open access-artikel dat wordt verspreid onder de voorwaarden van de Creative Commons Attribution License, die staat onbeperkt gebruik, distributie en reproductie in elk medium toe, op voorwaarde dat het originele werk correct wordt geciteerd.
Gastroenterology Research wordt gepubliceerd door Elmer Press Inc.