Physikalische Geologie
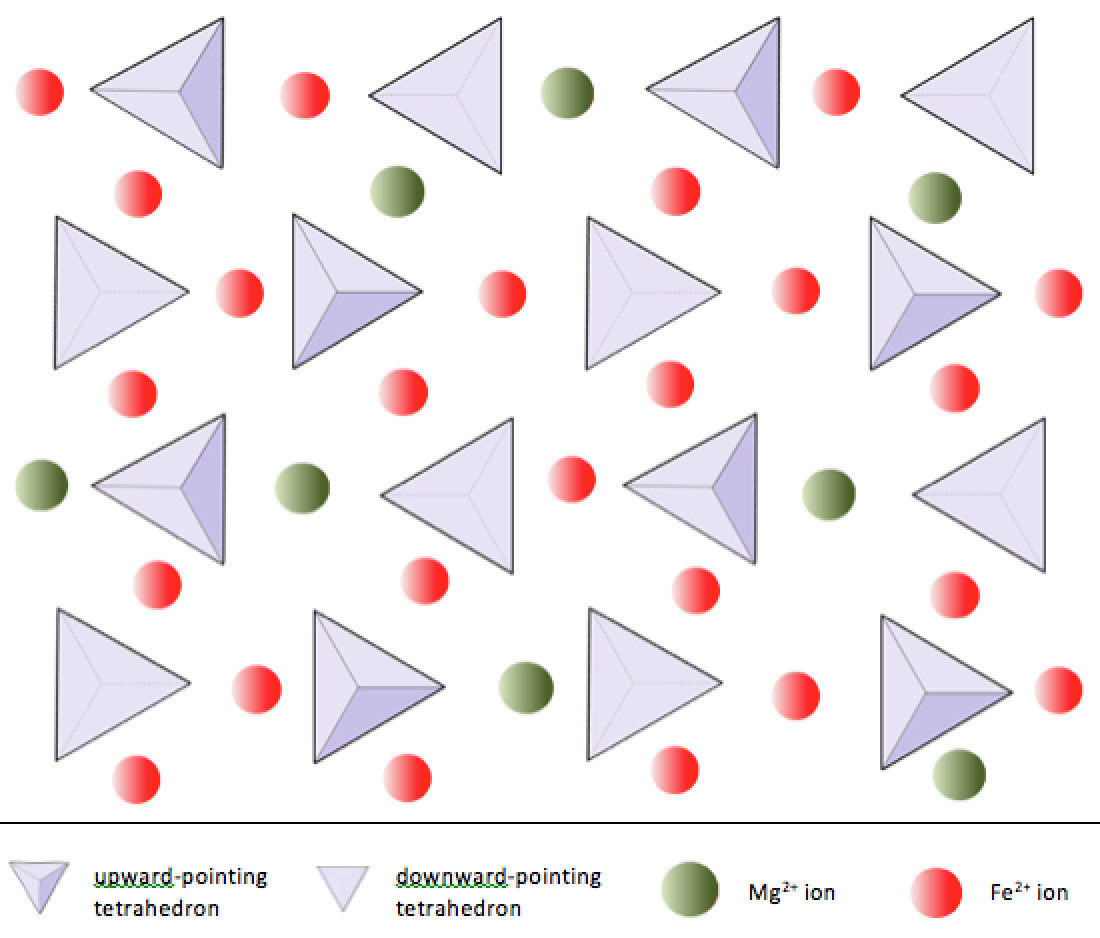
Die überwiegende Mehrheit der Mineralien, aus denen die Gesteine der Erdkruste bestehen, sind Silikatmineralien. Dazu gehören Mineralien wie Quarz, Feldspat, Glimmer, Amphibol, Pyroxen, Olivin und eine Vielzahl von Tonmineralien. Der Baustein all dieser Mineralien ist das Siliciumdioxid-Tetraeder, eine Kombination aus vier Sauerstoffatomen und einem Siliciumatom. Diese sind so angeordnet, dass Ebenen, die durch die Sauerstoffatome gezogen werden, ein Tetraeder bilden (Abbildung 2.6). Da das Siliziumion eine Ladung von +4 und jedes der vier Sauerstoffionen eine Ladung von –2 hat, hat das Siliciumdioxid-Tetraeder eine Nettoladung von –4. In Silikatmineralien sind diese Tetraeder angeordnet und auf verschiedene Weise miteinander verbunden, von einzelnen Einheiten bis hin zu komplexen Frameworks (Abbildung 2.9). Die einfachste Silikatstruktur, die des Minerals Olivin, besteht aus isolierten Tetraedern, die an Eisen- und / oder Magnesiumionen gebunden sind. In Olivin wird die –4-Ladung jedes Siliciumdioxid-Tetraeders durch zwei zweiwertige (d. H. +2) Eisen- oder Magnesiumkationen ausgeglichen. Olivin kann entweder Mg2SiO4 oder Fe2SiO4 oder eine Kombination der beiden (Mg, Fe) 2SiO4 sein. Die zweiwertigen Kationen von Magnesium und Eisen haben einen ziemlich engen Radius (0,73 gegenüber 0,62 Angström). Aufgrund dieser Größenähnlichkeit und weil beide zweiwertige Kationen sind (beide haben eine Ladung von +2), können sich Eisen und Magnesium in Olivin und in vielen anderen Mineralien leicht gegenseitig ersetzen.
| Tetraederkonfiguration | Beispielmineralien | |
|---|---|---|
 |
Isoliert (Nesosilikate) | Olivin, Granat, Zirkon, Zyanit |
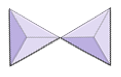 |
Paare (Sorosilikate) | Epidot, Zoisit |
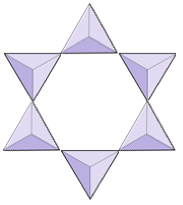 |
Ringe (Cyclosilikate) | Turmalin |
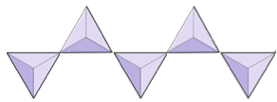 |
Einzelketten (Inosilikate) | Pyroxene, Wollastonit |
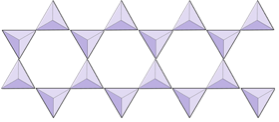 |
Doppelketten (Inosilikate) | Amphibole |
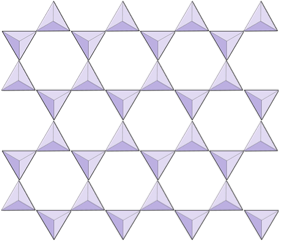 |
Blätter (Schichtsilikate) | Glimmer, Tonmineralien, Serpentin, Chlorit |
| 3-dimensional Struktur | Gerüst (Tektosilikate) | Feldspate, Quarz, Zeolith |
Übung 2.3 Erstellen Sie ein Tetraeder
Schneiden Sie die Außenseite der Form ab (durchgezogene Linien und gepunktete Linien) und falten Sie sie dann entlang der durchgezogenen Linien, um einen Tetraeder zu bilden.
Wenn Sie Kleber oder Klebeband haben, sichern Sie die Laschen zum Tetraeder, um es zusammenzuhalten. Wenn Sie keinen Kleber oder Klebeband haben, machen Sie eine Scheibe entlang der dünnen grauen Linie und führen Sie die spitze Lasche in den Schlitz ein.
Wenn Sie dies in einem Klassenzimmer tun, versuchen Sie, Ihr Tetraeder mit anderen zu verbinden Paare, Ringe, Einzel- und Doppelketten, Blätter und sogar dreidimensionale Gerüste.
Im Gegensatz zu den meisten anderen Silikatmineralien sind die Siliciumdioxid-Tetraeder in Olivin nicht aneinander gebunden andere. Sie sind jedoch an Eisen und / oder Magnesium gebunden, wie in Abbildung 2.10 dargestellt.
Wie bereits erwähnt, Die +2 Ionen von Eisen und Magnesium sind ähnlich groß (wenn auch nicht ganz gleich). Dies ermöglicht es ihnen, sich in einigen Silikatmineralien gegenseitig zu ersetzen. Tatsächlich haben die gemeinsamen Ionen in Silikatmineralien einen weiten Größenbereich, wie in Abbildung 2.11 dargestellt. Alle gezeigten Ionen sind Kationen mit Ausnahme von Sauerstoff. Beachten Sie, dass Eisen sowohl als +2 Ion (wenn es während der Ionisierung zwei Elektronen verliert) als auch als +3 Ion (wenn es drei Elektronen verliert) existieren kann. Fe2 + ist als Eisen bekannt. Fe3 + ist als Eisen (III) bekannt. Ionenradien sind für die Zusammensetzung von Silikatmineralien von entscheidender Bedeutung, daher beziehen wir uns erneut auf dieses Diagramm.

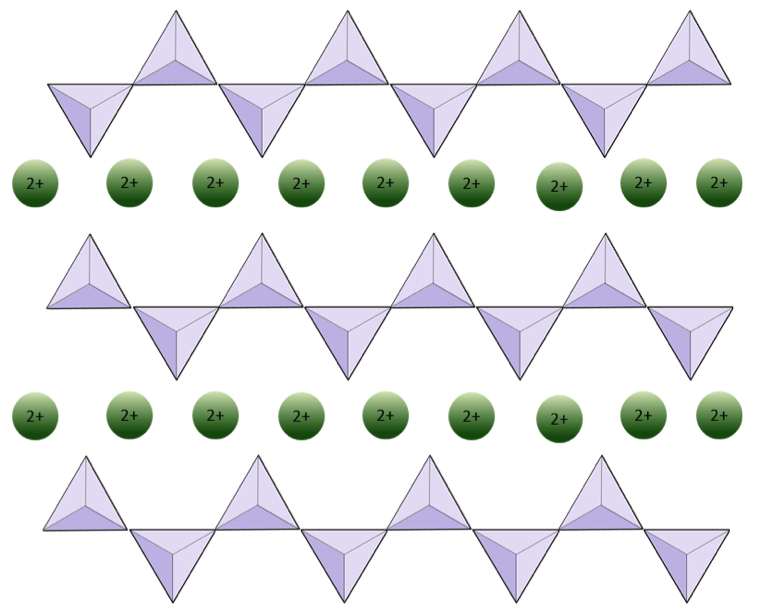
Die Struktur der Einzelkette Silikatpyroxen ist in den Abbildungen 2.12 und 2.13 dargestellt. In Pyroxen sind Siliciumdioxid-Tetraeder in einer einzigen Kette miteinander verbunden, wobei ein Sauerstoffion von jedem Tetraeder mit dem benachbarten Tetraeder geteilt wird, daher gibt es weniger Sauerstoff in der Struktur.Das Ergebnis ist, dass das Verhältnis von Sauerstoff zu Silizium niedriger ist als bei Olivin (3: 1 statt 4: 1) und die Nettoladung pro Siliziumatom geringer ist (–2 statt –4), da weniger Kationen erforderlich sind um diese Gebühr auszugleichen. Pyroxenzusammensetzungen sind vom Typ MgSiO 3, FeSiO 3 und CaSiO 3 oder eine Kombination davon. Pyroxen kann auch als (Mg, Fe, Ca) SiO3 geschrieben werden, wobei die Elemente in den Klammern in einem beliebigen Verhältnis vorhanden sein können. Mit anderen Worten, Pyroxen hat ein Kation für jedes Siliciumdioxid-Tetraeder (z. B. MgSiO 3), während Olivin zwei (z. B. Mg 2 SiO 4) hat. Da jedes Siliziumion +4 und jedes Sauerstoffion –2 ist, ergeben die drei Sauerstoffatome (–6) und das eine Silizium (+4) eine Nettoladung von –2 für die einzelne Kette von Siliciumdioxid-Tetraedern. In Pyroxen gleicht das einwertige Kation (2+) pro Tetraeder diese Ladung von –2 aus. In Olivin sind zwei zweiwertige Kationen erforderlich, um die –4-Ladung eines isolierten Tetraeders auszugleichen.
Die Struktur von Pyroxen ist „permissiver“ als die von Olivin – was bedeutet, dass Kationen einen größeren Bereich von Ionenradien aufweisen Darin können Pyroxene Kationen aus Eisen (Radius 0,63 Å) oder Magnesium (Radius 0,72 Å) oder Kalzium (Radius 1,00 Å) enthalten.
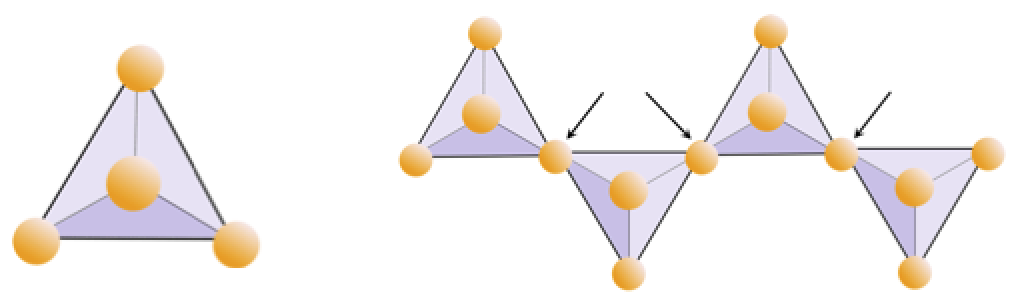
Aufgabe 2.4 Sauerstoffentzug
Das folgende Diagramm zeigt eine einzelne Kette in einem Silikatmineral. Zählen Sie die Anzahl der Tetraeder gegen die Anzahl der Sauerstoffionen (gelbe Kugeln). Jedes Tetraeder hat ein Siliziumion, daher sollte dies das Verhältnis von Si zu O in einkettigen Silikaten (z. B. Pyroxen) ergeben.
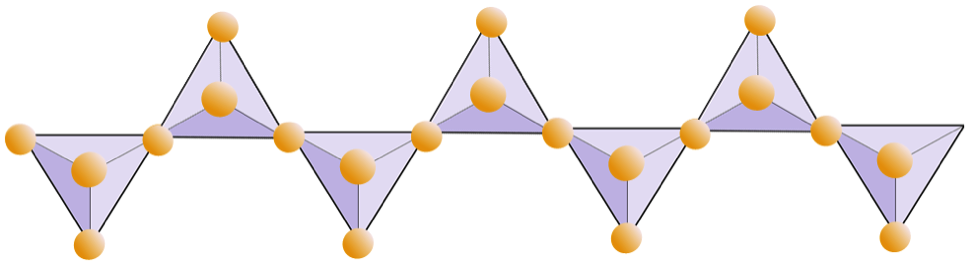
Das folgende Diagramm zeigt eine Doppelkette in einem Silikatmineral. Zählen Sie erneut die Anzahl der Tetraeder gegen die Anzahl der Sauerstoffionen. Dies sollte das Verhältnis von Si zu O in Doppelkettensilikaten (z. B. Amphibol) ergeben.
In Amphibolstrukturen sind die Siliciumdioxid-Tetraeder in einer Doppelkette verbunden, deren Sauerstoff-Silizium-Verhältnis niedriger ist als das von Pyroxen, und daher sind noch weniger Kationen erforderlich, um die Ladung auszugleichen. Amphibol ist noch toleranter als Pyroxen und seine Zusammensetzung kann sehr komplex sein. Hornblende kann zum Beispiel Natrium, Kalium, Calcium, Magnesium, Eisen, Aluminium, Silizium, Sauerstoff, Fluor und das Hydroxylion (OH–) enthalten. In Glimmerstrukturen kann die Siliciumdioxid-Tetraeder sind in durchgehenden Schichten angeordnet, wobei jedes Tetraeder drei Sauerstoffanionen mit benachbarten Tetraedern teilt. Es gibt noch mehr Sauerstoffverteilung zwischen benachbarten Tetraedern und daher werden weniger ladungsausgleichende Kationen für Blattsilikatmineralien benötigt. Die Bindung zwischen den Blättern ist relativ schwach, was für die gut entwickelte einseitige Spaltung verantwortlich ist (Abbildung 2.14). Biotitglimmer kann Eisen und / oder Magnesium enthalten und ist daher ein ferromagnesisches Silikatmineral (wie Olivin, Pyroxen und Amphibol). Chlorit ist ein weiteres ähnliches Mineral, das üblicherweise Magnesium enthält. In Muskovitglimmer sind nur Aluminium und Kalium vorhanden; Daher handelt es sich um ein nicht ferromagnesisches Silikatmineral.

Neben Muskovit, Biotit und Chlorit gibt es viele andere Schichtsilikate (oder Schichtsilikate) existieren normalerweise als tongroße Fragmente (dh weniger als 0,004 mm). Dazu gehören die Tonmineralien Kaolinit, Illit und Smektit. Obwohl sie aufgrund ihrer sehr geringen Größe schwer zu untersuchen sind, sind sie äußerst wichtige Bestandteile von Gesteinen und insbesondere von Böden.
Das gesamte Schichtsilikat Mineralien haben auch Wasser in ihrer Struktur.
Silica-Tetraeder sind in dreidimensionalen Gerüsten sowohl im Feldspat als auch im Quarz gebunden. Dies sind nicht ferromagnesische Mineralien – sie enthalten kein Eisen oder Magnesium.Feldspate enthalten neben Siliciumdioxid-Tetraedern auch die Kationen Aluminium, Kalium, Natrium und Calcium in verschiedenen Kombinationen. Quarz enthält nur Siliciumdioxid-Tetraeder.
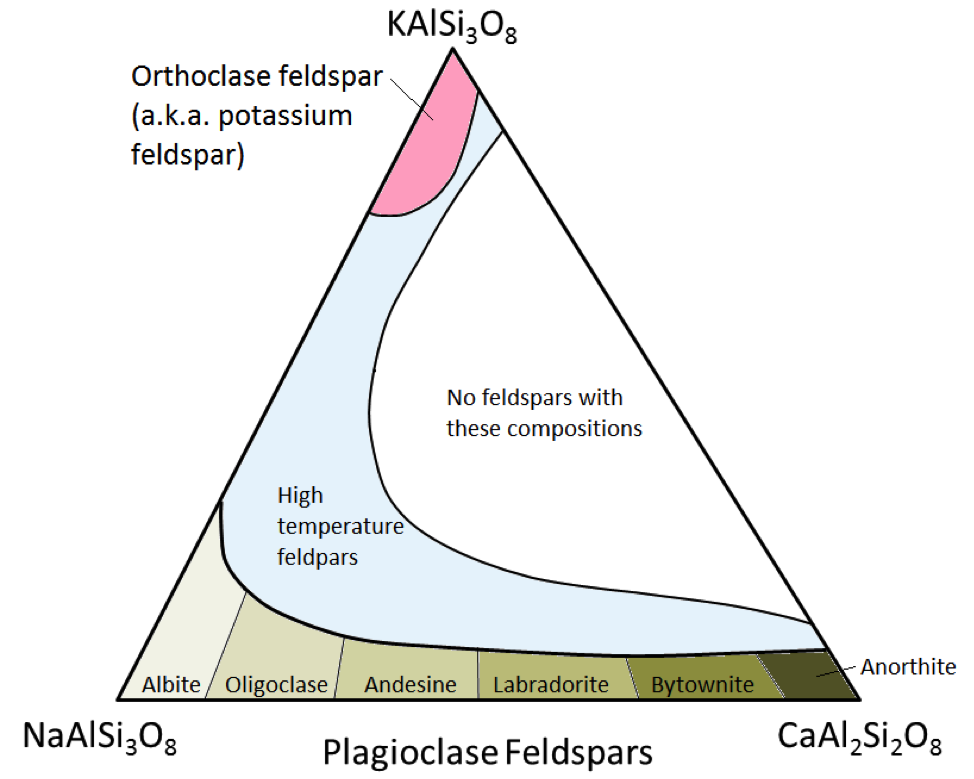
Die drei wichtigsten Feldspatmineralien sind Kaliumfeldspat (auch bekannt als K-Feldspat oder K-Spar) und zwei Arten von Plagioklasfeldspat: Albit (nur Natrium) und Anorthit (nur Kalzium) . Wie bei Eisen und Magnesium in Olivin gibt es einen kontinuierlichen Bereich von Zusammensetzungen (Reihen fester Lösungen) zwischen Albit und Anorthit in Plagioklas. Dies liegt daran, dass die Calcium- und Natriumionen nahezu identisch groß sind (1,00 Å gegenüber 0,99 Å). Zwischen CaAl2Si3O8 und NaAlSi3O8 können beliebige Zwischenzusammensetzungen existieren (Abbildung 2.15). Dies ist ein wenig überraschend, da Calcium- und Natriumionen, obwohl sie sehr ähnlich groß sind, nicht die gleiche Ladung haben (Ca2 + gegenüber Na +). Dieses Problem wird durch die entsprechende Substitution von Si4 + durch Al3 + erklärt. Daher ist Albit NaAlSi3O8 (ein Al und drei Si), während Anorthit CaAl2Si2O8 (zwei Al und zwei Si) ist, und Plagioklasfeldspate mit mittlerer Zusammensetzung haben mittlere Anteile an Al und Si. Dies wird als „gekoppelte Substitution“ bezeichnet. Die Plagioklas-Feldspate mit mittlerer Zusammensetzung sind Oligoklas (10% bis 30% Ca), Andesin (30% bis 50% Ca), Labradorit (50% bis 70%) % Ca) und Bytownit (70% bis 90% Ca). K-Feldspat (KAlSi3O8) hat aufgrund der größeren Größe des Kaliumions (1,37 Å) und aufgrund dieser Größe eine etwas andere Struktur als Plagioklas , Kalium und Natrium ersetzen sich nur bei hohen Temperaturen. Diese Hochtemperatur-Feldspate kommen wahrscheinlich nur in Vulkangesteinen vor, da aufdringliche magmatische Gesteine langsam genug auf niedrige Temperaturen abkühlen, damit sich die Feldspate in eines der Felder verwandeln können Formen mit niedrigerer Temperatur.
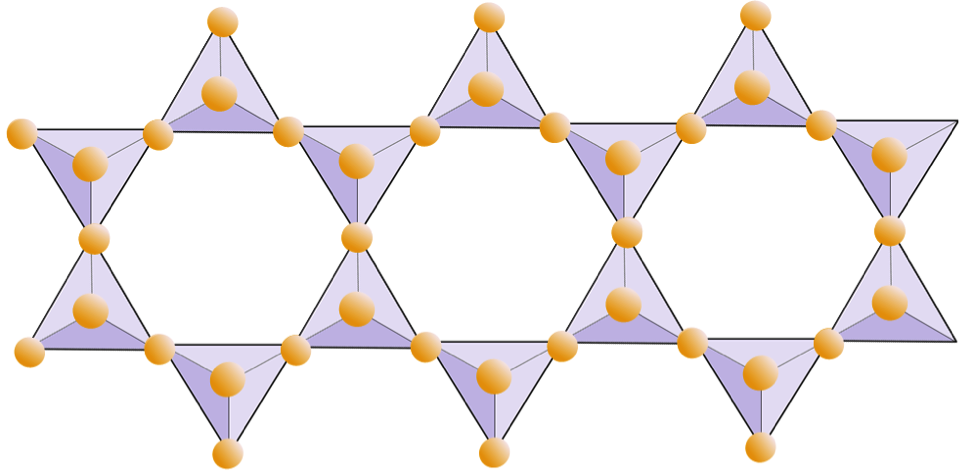
In Quarz (SiO2) sind die Siliciumdioxid-Tetraeder in einem „perfekten“ dreidimensionalen Gerüst gebunden. Jedes Tetraeder ist an vier andere Tetraeder gebunden (mit einem Sauerstoff, der an jeder Ecke jedes Tetraeders geteilt wird), und als Ergebnis beträgt das Verhältnis von Silizium zu Sauerstoff 1: 2. Da das eine Siliziumkation eine Ladung von +4 und die beiden Sauerstoffanionen jeweils eine Ladung von –2 haben, ist die Ladung ausgeglichen. Aluminium oder andere Kationen wie Natrium oder Kalium werden nicht benötigt. Die Härte und das Fehlen einer Spaltung in Quarz resultieren aus den starken kovalenten / ionischen Bindungen, die für das Siliciumdioxid-Tetraeder charakteristisch sind.
Aufgabe 2.5 Ferromagnesische Silikate?
Silikatmineralien werden entweder als ferromagnesisch oder nicht ferromagnesisch eingestuft, je nachdem, ob ihre Formel Eisen (Fe) und / oder Magnesium (Mg) enthält oder nicht. Eine Reihe von Mineralien und ihre Formeln sind unten aufgeführt. Geben Sie für jedes ein ferromagnesisches Silikat an.
| Mineral | Formel | Ferromagnesisches Silikat? |
|---|---|---|
| Olivin | (Mg, Fe) 2SiO4 | |
| Pyrit | FeS2 | |
| Plagioklas | CaAl2Si2O8 | |
| Pyroxen | MgSiO3 | |
| Hämatit | Fe2O3 | |
| Orthoklas | KAlSi3O8 | |
| Quarz | SiO2 |
| Mineral | Formel * | Ferromagnesisches Silikat? |
|---|---|---|
| Amphibol | Fe7Si8O22 (OH) 2 | |
| Muskovit | K2Al4 Si6Al2O20 (OH) 4 | |
| Magnetit | Fe3O4 | |
| Biotit | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| Dolomit | (Ca, Mg) CO3 | |
| granat | Fe2Al2Si3O12 | |
| Serpentin | Mg3Si2O5 (OH) 4 |
* Einige der Formeln, insbesondere die komplizierteren, wurden vereinfacht.
- Ein Angström ist die Einheit, die üblicherweise für die Expression von Atom verwendet wird -skalige Abmessungen. Ein Angström beträgt 10–10 m oder 0,0000000001 m. Das Symbol für einen Angström ist Å. ↵