Czasopisma | Polityka | Pozwolenie Badania gastroenterologii
Przewidywalność metaplazji żołądka w jelitach przez plamisty rumień plamisty widoczny w endoskopii
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
a Oddział Gastroenterologii i Hepatologii, National Center for Global Health and Medicine (NCGM), Tokio, Japonia
bDepartment of Clinical Research and Informatics International Clinical Research Center Research Institute, NCGM, Tokio, Japonia
cDivision of Internal Medicine, Kosin University College of Medicine, Busan, Korea
dZakład Gastroenterologii i Hepatologii, Wakayama Medical University, Wakayama, Japonia
eDepartment of Clinical Laboratory Pathological Division, NCGM, Tokyo, Japan
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Japan
gKorespondent: Naoyoshi Nagata, Department of sol astroenterology and Hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokio 162-8655, Japonia
Rękopis przyjęty do publikacji 26 września 2011
Krótki tytuł: Diagnostyka endoskopowa metaplazji jelit
doi: https://doi.org/10.4021/gr357w
- Streszczenie
- Wprowadzenie
- Metody
- Wyniki
- Dyskusja
| Streszczenie | ▴Top |
Tło: Metaplazja jelit (IM) jest uważana za zmianę przednowotworową. Jednak endoskopową diagnostykę IM uznano za trudną. Za pomocą endoskopii odkryliśmy unikalny wzór rumienia, „plamisty, niejednolity rumień (MPE)”, który obejmuje ciężką postać domięśniową. Samo zakażenie Helicobacter pylori (Hp) może powodować rumień, który odzwierciedla zmiany histologiczne w błonie śluzowej żołądka. Dlatego też zapisaliśmy do leczenia eradykację Hp pacjentów w celu walidacji związku między MPE a objawami patologicznymi.
Metody: Do badania zakwalifikowano pacjentów z przewlekłym zapaleniem błony śluzowej żołądka, którzy przeszli skuteczną eradykację Hp co najmniej 6 miesięcy przed badaniem. MPE zdefiniowaliśmy jako liczne płaskie lub depresyjne zmiany rumieniowe. Po napotkaniu MPE w endoskopii wykonaliśmy biopsję zarówno w miejscu MPE, jak i miejscu innym niż MPE. Miejsce nie-MPE zdefiniowano jako przylegającą śluzówkę znajdującą się w odległości 3 cm od miejsca MPE. Wszystkie próbki biopsji oceniano immunohistochemicznie pod kątem podtypu IM przy użyciu Barwienie MUC2, MUC5AC, MUC6, CD10 i CDX2. Stopień IM określono zgodnie z zaktualizowanym systemem Sydney. Obliczono dokładność diagnostyczną wyników MPE dla patologicznej IM. Oceniono również związek między MPE i podtypem IM.
Wyniki: Do badania wybrano łącznie 102 pacjentów. Spośród nich 55 (54%) pacjentów miało MPE. Od tych 55 pacjentów pobrano próbki biopsyjne z miejsc MPE i innych niż MPE. Odsetki IM i mediana wyników IM były znacząco wyższe w miejscach MPE (P < 0,001) niż w miejscach bez MPE. Czułość i swoistość MPE w wykrywaniu histologicznego IM wyniosły odpowiednio 72,7% i 84,1%. Nie zaobserwowano żadnych znaczących powiązań w ekspresji MUC2, MUC5AC, MUC6, CD10 i CDX2 między miejscami MPE i miejscami innymi niż MPE. Nie było istotnych różnic w stosunkach (całkowite / niekompletne) podtypów IM między dwiema grupami.
Wnioski: MPE jest użytecznym odkryciem endoskopowym do wykrywania histologicznego IM bez użycia chromoendoskopii i endoskopii powiększającej. Jednak podtyp komunikatora internetowego jest trudny do zidentyfikowania. W erze eradykacji Hp, MPE może stać się odkryciem predykcyjnym dla ryzyka raka żołądka.
Słowa kluczowe: Metaplazja jelit; Zmiana przednowotworowa; Znalezienie endoskopowe; Rumień; Endoskopia w świetle białym; Podtyp, zwalczanie; Helicobacter pylori
| Wprowadzenie | ▴Top |
Uważa się, że rozwój raka żołądka obejmuje wieloetapowy proces, w tym zakażenie Helicobacter pylori (Hp), przewlekłe zapalenie żołądka, atrofię gruczołów, metaplazję jelitową (IM) i wreszcie dysplazja. IM i zanik żołądka są razem uważane za czynniki ryzyka rozwoju raka żołądka typu jelitowego i są uważane za zmiany przednowotworowe.Zanik żołądka można rozpoznać za pomocą endoskopii i koreluje z oceną histologiczną. Jednak rozpoznanie IM przy użyciu standardowej endoskopii światła białego jest uważane za trudne ze względu na brak rozróżnienia w kolorze IM i jego obecność w postaci wielu płaskich zmian.
Ostatnio , stwierdziliśmy, że unikalny rumieniowy objaw w endoskopii można było zaobserwować nawet po eradykacji Hp. Opisujemy to odkrycie jako „Cętkowany nieregularny rumień (MPE)”. MPE można rozpoznać jako liczne płaskie lub lekko zagłębione zmiany rumieniowe w standardowej endoskopii w świetle białym; patologicznie obejmuje ciężką IM. Samo zakażenie Hp może powodować rumień, widoczny w endoskopii, który odzwierciedla zmiany histologiczne, takie jak naciekanie komórek zapalnych i obrzęk. , zakwalifikowaliśmy pacjentów, którzy zostali poddani eradykacji Hp, aby zweryfikować związek między MPE a wynikami patologicznymi.
| Metody | ▴Top |
Wybór pacjentów
Pacjenci z przewlekłym zapaleniem błony śluzowej żołądka, którzy przeszli skuteczną eradykację Hp co najmniej 6 miesięcy przed badaniem, zostali prospektywnie zakwalifikowani do badania w National Center for Global Health and Medicine (NCGM) w okresie od stycznia 2008 do grudnia 2008. Kryteria wykluczenia i w tym stosowanie niesteroidowych leków przeciwzapalnych (NLPZ), leków zobojętniających sok żołądkowy i leków przeciwzakrzepowych w ciągu 4 tygodni przed endoskopią. Wykluczyliśmy również pacjentów z historią operacji żołądka, chorobą krwotoczną, marskością wątroby, niewydolnością nerek, niewydolnością serca i wczesnym lub zaawansowanym rakiem żołądka. Od uczestników uzyskano pisemną świadomą zgodę zgodnie z Deklaracją Helsińską i jej późniejszą rewizją. Protokół badania został zatwierdzony przez Komisję Etyki NCGM.
Eradykacja Helicobacter pylori
Pacjenci z przewlekłym zapaleniem błony śluzowej żołądka i chorobą wrzodową wywołaną zakażeniem Hp byli poddawani terapii eradykacyjnej. Pacjenci byli leczeni 7-dniowym schematem obejmującym amoksycylinę, klarytromycynę i inhibitor pompy protonowej (PPI) dwa razy dziennie, który był standardowym schematem pierwszego rzutu zatwierdzonym w Japonii. Jeśli eradykacja nie powiodła się, podawano drugi schemat obejmujący amoksycylinę, metronidazol i PPI. Eradykację potwierdzono negatywnym badaniem histologicznym biopsji żołądka wraz z ujemnym testem oddechowym mocznika 13C (13C-UBT) 2 do 3 miesięcy po zakończeniu terapii eradykacyjnej. Gdy wszystkie testy dały wynik negatywny, pacjenta uznano za negatywnego pod kątem zakażenia Hp.
Ocena endoskopowa
Co najmniej 6 miesięcy po eradykacji Hp pacjenci przeszli badanie endoskopowe. Użyliśmy endoskopu o wysokiej rozdzielczości bez powiększenia (wideoskop Olympus, model GIF-H260), aby zaobserwować obecność MPE w błonie śluzowej żołądka. Zdefiniowaliśmy MPE jako liczne płaskie lub lekko zagłębione zmiany rumieniowe, które można było odróżnić od przekrwienia błony śluzowej, krwotoku, angioektazji, plamistego rumienia i rumienia liniowego (ryc. 1A, B). Wyróżniliśmy również MPE i czerwonawą błonę śluzową z regenerującym się nabłonkiem, któremu towarzyszy wrzód lub blizna po wrzodzie.
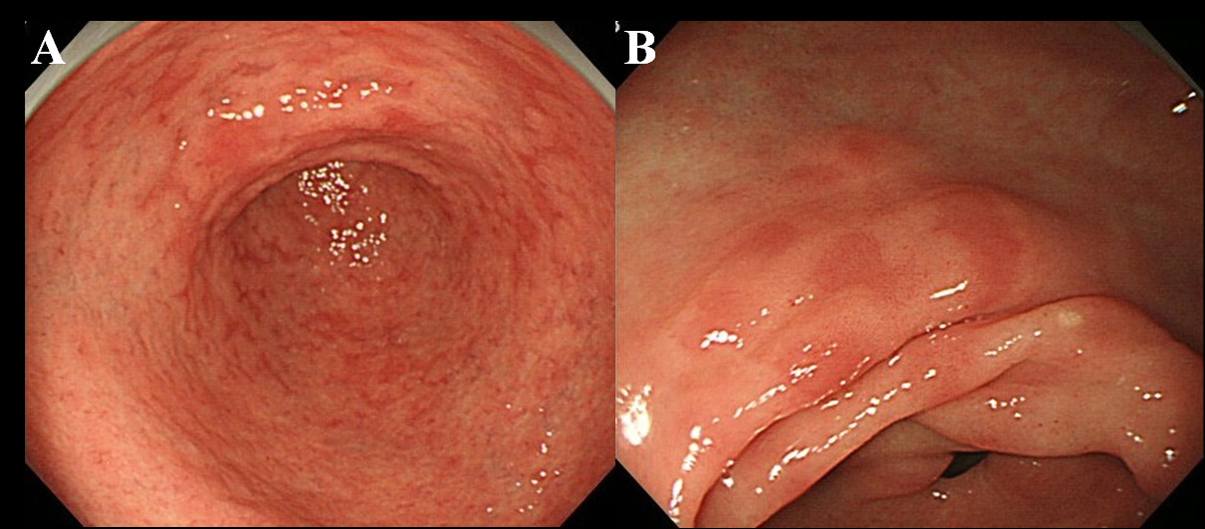 Kliknij, aby wyświetlić duży obraz |
Rysunek 1. Endoskopowe wykrywanie błędów granicznych dopuszczalnych (MPE). (A) mnogi i płaski rumień w okolicy przedramienia; (B) Płaski i wklęsły rumień na mniejszej krzywizny antrum. |
Po znalezieniu wyniku MPE w endoskopii, wykonaliśmy biopsję zarówno miejsca MPE, jak i miejsca nie-MPE. Miejsce inne niż MPE zdefiniowano jako przylegającą śluzówkę znajdującą się w promieniu 3 cm od miejsca MPE (ryc. 2).
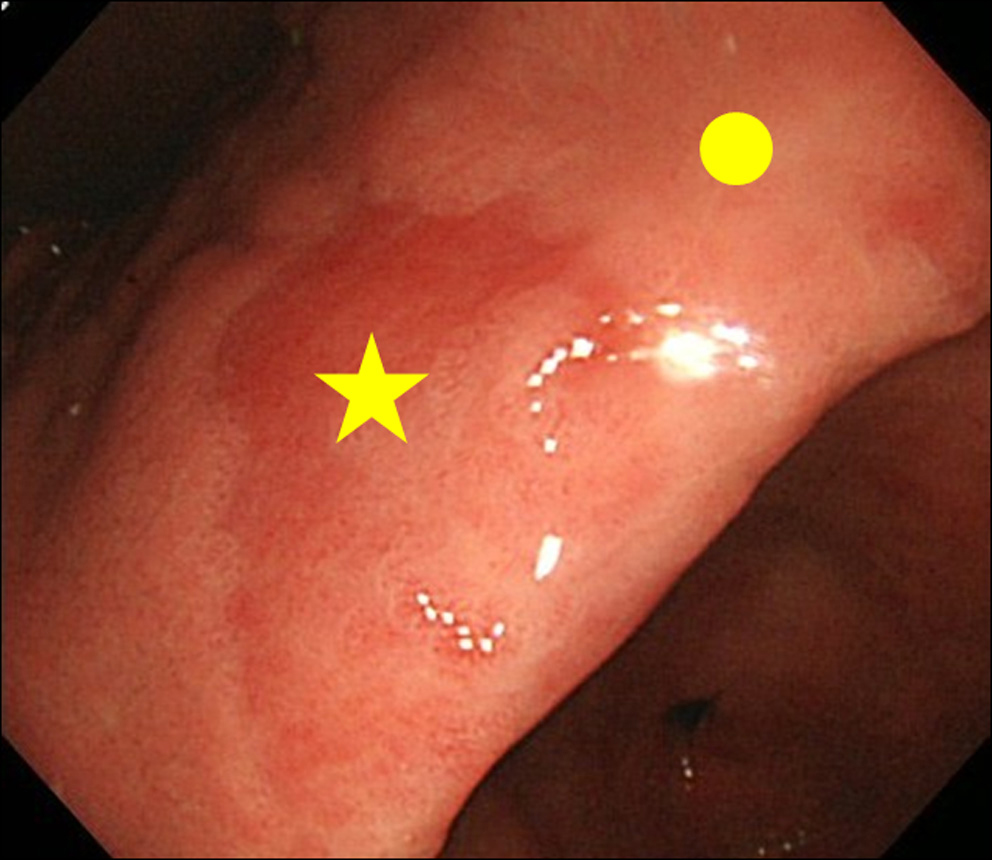 Kliknij, aby wyświetlić duży obraz |
Rysunek 2. Strona biopsji. (★) Miejsce biopsji MPE; (•) Miejsce biopsji nie-MPE. Miejsce inne niż MPE zdefiniowano jako przylegającą śluzówkę znajdującą się w promieniu 3 cm od miejsca MPE. |
Zakres zanikowej granicy został podzielony na 3 etapy: łagodne, umiarkowane i ciężkie, zgodnie z definicją Kimury i Takemoto.
Ocena histologiczna
Próbki biopsyjne zostały wysłane do naszego laboratorium, utrwalone w 10% buforowanej formalinie. Próbki poddano obróbce, zatopiono w parafinie i pocięto na 4 µm skrawki. Szkiełka z każdej próbki wybarwiono hematoksyliną-eozyną (HE) (ryc.3A) i barwienie immunohistochemiczne. Barwienie immunohistochemiczne obejmowało: (1) MUC2, marker mucyny jelitowej, który jest przydatny do wykrywania komórek kubkowych (ryc. 3B), (2) MUC5AC, marker mucyny żołądkowej, która jest wyrażana w komórkach śluzowych szyi i nabłonek dołkowy (ryc. 3C), (3) MUC6, marker mucyny żołądkowej, która jest wyrażana w komórkach śluzowych okolicy szyjnej ciała i gruczołach odźwiernika odźwiernika (ryc. 3D), (4) CD10, a przydatny marker do wykrywania rąbka szczoteczkowego jelita cienkiego (ryc. 3E) oraz (5) CDX2, marker obecności IM (ryc. 3F). Zastosowaliśmy CDX2, ponieważ ostatnie badania wykazały, że ekspresja CDX2 może być szeroko obserwowana w gruczołach IM i nie zanika po eradykacji Hp. Obecność IM została potwierdzona zarówno przez barwienie HE i immunohistochemiczne.
Podtypy IM zostały sklasyfikowane jako pełne lub niekompletne. Pełen typ zdefiniowano jako zmniejszoną ekspresję mucyny żołądkowej (MUC5AC lub MUC6) i koekspresję mucyny jelitowej (MUC2) i CD10 (ryc. 3A-F). Niekompletny typ zdefiniowano jako ekspresję mucyny żołądkowej (MUC5AC lub MUC6) i MUC2. Ponieważ nie istnieją żadne ustalone kryteria klasyfikowania sprawy jako zawierającej zarówno kompletne, jak i niekompletne typy w jednej sekcji, przypisaliśmy podtypy komunikatorów internetowych jako typ dominujący.
IM został oceniony na podstawie zaktualizowanego systemu Sydney (0: brak, 1: łagodne, 2: umiarkowane, 3: zaznaczone).
Analiza statystyczna
Podzieliliśmy pacjentów na dwie grupy na podstawie tego, czy pacjenci mieli dodatni, czy ujemny wynik MPE. Do porównania wieku i okresu eradykacji użyliśmy testu t-Studenta. Do określenia stosunków płci i stopnia atrofii endoskopowej w obu grupach zastosowano test chi-kwadrat lub test dokładnego prawdopodobieństwa Fishera.
Porównaliśmy również wyniki histologiczne między miejscami MPE i miejscami innymi niż MPE. Aby porównać różnice między dwoma miejscami biopsji, zastosowaliśmy test Wilcoxon Matched-Pairs Signed-Ranks Test dla IM mediana punktacji oraz dokładny test Fishera dotyczący częstości występowania IM, podtypów IM i fenotypów IM Obliczono czułość, swoistość, dodatnie i ujemne wartości predykcyjne oraz dodatnie i ujemne współczynniki prawdopodobieństwa MPE obserwowane w endoskopii w celu wykrycia patologicznej IM. Wartości p < 0,05 uznano za istotne. Wszystkie analizy statystyczne przeprowadzono za pomocą oprogramowania Stata w wersji 10 (StataCorp LP, College Station, TX, USA).
| Wyniki | ▴Top |
Charakterystyka pacjentów
W okresie badania 157 pacjentów którzy przeszli endoskopię górną i otrzymali eradykację Hp. Wykluczyliśmy 52 ze 157 pacjentów z analizy pod kątem któregokolwiek z poniższych kryteriów: stosowanie leków zobojętniających (31), leków przeciwzakrzepowych (17) lub NLPZ (3); lub historia marskości wątroby (5), niewydolności serca (1) lub wczesnego raka żołądka (2). W odniesieniu do niektórych pacjentów zastosowano więcej niż jedno kryterium wykluczenia.
W sumie 102 pacjentów wybrano do analizy po wykluczeniu. Spośród nich było 55 (54%) pacjentów z MPE. Nie stwierdzono istotnych różnic w średnim wieku i płci między pacjentami z dodatnim i ujemnym wynikiem MPE (tab. 1). Nie było znaczących różnic między dwiema grupami po okresie eradykacji Hp. Jednak zanik żołądka o większym nasileniu (od umiarkowanego do ciężkiego) pojawiał się istotnie częściej w grupie MPE-dodatniej niż w grupie MPE-ujemnej (65,6% w porównaniu z ujemnym 45,0%, P = 0,035).
 Kliknij, aby wyświetlić |
Tabela 1. Charakterystyka demograficzna pacjentów (n = 102) |
Wyniki badań endoskopowych i cechy patologiczne
 Kliknij, aby wyświetlić |
Tabela 2. Porównanie wyniku dla komunikatorów internetowych między MPE a witryną bez MPE (n = 55) |
Nie zaobserwowano żadnych znaczących powiązań w ekspresji MUC2, MUC5AC, MUC6, C D10 i CDX2 między miejscami MPE i miejscami innymi niż MPE (Tabela 3). Nie było znaczącej różnicy w stosunkach (całkowite / niekompletne) podtypów IM między dwiema grupami (MPE: 18/30 versus non-MPE: 8/10, P = 0,778).
 Kliknij, aby wyświetlić |
Tabela 3. Fenotypy i podtypy metaplazji jelit |
| Dyskusja | ▴Top |
W tym badaniu skupiliśmy się na unikalnym rumieniowym wyglądzie obserwowanym w endoskopii po eradykacji Hp. Nazwaliśmy to odkrycie „MPE” i stwierdziliśmy, że obecność MPE obserwowana w endoskopii była typowa dla patologicznej IM.
Diagnoza IM za pomocą konwencjonalnej endoskopii uznano za trudne, ponieważ IM zwykle pojawia się w płaskiej błonie śluzowej i wykazuje niewiele zmian morfologicznych. Kaminishi i wsp. opisali „zmianę guzkową w kolorze popiołu” jako wskaźnik IM; dokładność wyników tych badaczy była wysoka, ze swoistością 98–99%, ale czułość była niska (6–12%). Kaminishi i wsp. Zauważyli, że konwencjonalna endoskopia jest mniej przydatna do potwierdzenia rozpoznania IM. Niedawno pojawiły się badania dotyczące endoskopowego wykrywania IM przy użyciu endoskopii powiększającej. Donoszono, że charakterystyczne wyniki jam żołądkowych obserwowane podczas chromoendoskopii z błękitem metylenowym i „wygląd przypominający kosmki” obserwowane w endoskopii konfokalnej były przydatne w diagnozowaniu IM. Uedo i wsp. Podali, że pojawienie się „jasnoniebieskiego grzebienia” ( LBC) jest dokładnym znakiem obecności IM, co widać w endoskopii powiększającej obrazowania wąskopasmowego (NBI). Jednak ze względu na wysokie koszty sprzętu oraz dodatkowe umiejętności i czas potrzebny do dokładniejszego zbadania za pomocą specjalnych narzędzi, takich jak NBI czy endoskopia powiększająca, badanie przesiewowe tym sprzętem nie jest praktyczne w codziennej praktyce klinicznej. Ponadto istnieje zwiększone ryzyko uszkodzenia DNA w błonie śluzowej przewodu pokarmowego podczas stosowania chromoendoskopii z użyciem błękitu metylenowego, a następnie światła białego, co wymaga ostrożności podczas jego stosowania. Dlatego korzystniejsze jest zdiagnozowanie IM poprzez wykrycie MPE bez użycia chromoendoskopii i endoskopii powiększającej. Wyniki naszych badań sugerują, że obecność IM można zdiagnozować za pomocą standardowej endoskopii bez biopsji.
Dlaczego MPE można zaobserwować nawet po wyeliminowaniu Hp? Można to przypisać zmianom histologicznym w obrębie błony śluzowej żołądka. Niezwykłe zmiany histologiczne po eradykacji obejmują poprawę infiltracji komórek zapalnych, przerostu nabłonka i obrzęku. Obrazy endoskopowe rumieniowatej i obrzękłej błony śluzowej, które wydają się poprawione, odzwierciedlają te zmiany histologiczne. Dlatego spekulujemy, że MPE składa się z pozostałego obszaru utrzymującego się rumieniowatego IM i szybko odzyskanego obszaru innego niż IM, będącego wynikiem skutecznej eradykacji Hp. Eliminacja Hp spowodowała, że kontrast między obszarem MPE i obszarami bez MPE stał się wyraźniejszy. Jednak nie wiadomo, dlaczego tylko miejsce MPE jest obserwowane jako rumieniowa błona śluzowa. Można prawdopodobnie wywnioskować, że bardzo gęsty obszar mikronaczyń otacza gruczoły metaplastyczne; nie zostało to wyjaśnione w tym badaniu. Dodatkowo, wynik IM w miejscu MPE był znacznie wyższy niż wynik w miejscu innym niż MPE. Spekulujemy, że pojawienie się rumieniowatej błony śluzowej jest związane z obecnością wielu gruczołów metaplastycznych.
Niniejsze badanie wykazało, że podtyp całkowity IM był głównie wykrywany w błonie śluzowej żołądka . Podtypy IM zostały sklasyfikowane jako kompletne lub niekompletne; są to najczęściej używane podtypy. Kilka badań wykazało, że pełny typ nie wykazuje żadnego zwiększonego ryzyka rozwoju raka, podczas gdy niekompletny typ wiąże się ze zwiększonym ryzykiem transformacji złośliwej. Jednak związek między podtypami a ryzykiem raka żołądka nie jest powszechnie akceptowany. Obecnie trudno jest zidentyfikować którykolwiek z podtypów za pomocą standardowej endoskopii.
Donoszono, że terapia eradykacyjna Hp jest skuteczna w zapobieganiu zarówno wrzodom żołądkowo-jelitowym, jak i rozwój raka żołądka. Te zastosowania terapii eradykacyjnej Hp prawdopodobnie pojawią się w praktyce klinicznej w najbliższej przyszłości. Należy jednak zachować ostrożność, aby uniknąć ryzyka rozwoju raka żołądka po eradykacji Hp. Opisywano, że cechy raka żołądka po eradykacji obejmują patologicznie ciężką IM w trzonie i ciężką atrofię żołądka, co wykryto w endoskopii. Dlatego konieczne jest uważne obserwowanie obecności IM nawet po eradykacji Hp.
Podsumowując, obecność MPE w badaniu endoskopowym jest charakterystyczna dla patologicznej IM.W praktyce klinicznej korzystne byłoby zdiagnozowanie patologicznego IM bez chromoendoskopii lub endoskopii powiększającej. MPE może stać się odkryciem predykcyjnym dla ryzyka raka żołądka w erze eradykacji Hp.
Podziękowania
Dziękujemy dr Hidenobu Watanabe i dr Hiroyoshi Ota za ich usługi konsultacyjne w ramach tego badania dotyczącego ocen patologicznych. Pragniemy wyrazić naszą wdzięczność Hisae Kawashiro, koordynatorowi badań klinicznych, za pomoc w gromadzeniu danych.
Wsparcie grantów
Ta praca została wsparta przez grant National Center for Global Health and Medicine (21-108).
Konflikty interesów
Autorzy deklarują, że nie mają konfliktu interesów.
| ▴Top |
- Correa P. Rakotwórczość żołądka człowieka: wieloetapowy i wieloczynnikowy proces – pierwszy wykład o raku przyznany przez American Cancer Society Award Epidemiologia i zapobieganie. Cancer Res. 1992; 52 (24): 6735-6740.
opublikowano - Leung WK, Sung JJ. Artykuł przeglądowy: metaplazja jelitowa i rakotwórczość żołądka. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Infekcja Helicobacter pylori i rozwój raka żołądka. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Endoskopowe rozpoznanie atroficznej granicy i jej znaczenie w przewlekłym zapaleniu żołądka. Endoskopia. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Miejsca biopsji odpowiednie do rozpoznania zakażenia Helicobacter pylori i oceny zasięgu zanikowego zapalenia żołądka. Jestem J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Endoskopowa klasyfikacja przewlekłego zapalenia żołądka na podstawie badań pilotażowych przeprowadzonych przez Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Dysplazja nabłonka żołądka. Jak tło kliniczno-patologiczne wiąże się z leczeniem. Rak. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Endoskopowa diagnostyka metaplazji żołądka w jelitach po eradykacji Helicobacter pylori. Endoskopia. 2009; 41 (dodatek I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Klasyfikacja i stopniowanie zapalenia żołądka. Zaktualizowany system Sydney. Międzynarodowe warsztaty na temat histopatologii zapalenia żołądka, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Ekspresja genu mucyny w normalnym, przednowotworowym i nowotworowym nabłonku żołądka człowieka. Cancer Res. 1995; 55 (12): 2681-2690.
pubmed - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. Mucyny jako kluczowe cząsteczki do klasyfikacji metaplazji jelitowej żołądka. Łuk Virchowsa. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. Metaplazja jelitowa ludzkiego żołądka wykazuje odmienne wzory ekspresji mucyny (MUC1, MUC2, MUC5AC i MUC6). Cancer Res. 1999; 59 (5): 1003-1007.
pubmed - Groisman GM, Amar M, Livne E. CD10: cenne narzędzie do świetlnej mikroskopowej diagnozy chorób wtrętowych mikrokosmków (rodzinna atrofia mikrokosmków). Jestem J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. The ectopeptidases CD10, CD13, CD26 i CD143 są regulowane w górę w raku żołądka. Int J Oncol. 2004; 25 (5): 1223-1232.
opublikowany - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Ektopowa ekspresja białka homeodomen CDX2 w metaplazji jelitowej i raku żołądka. Cancer Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Nieprawidłowa ekspresja CDX2 w błonie śluzowej żołądka z metaplazją jelitową i bez niej: efekt eradykacji Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H, i in. Chromoendoskopia powiększająca w diagnostyce metaplazji i dysplazji przewodu pokarmowego. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Walidacja zewnętrzna klasyfikacji dla chromoendoskopii z błękitem metylenowym w powiększeniu w zmianach przednowotworowych żołądka. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
publikowane doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Endoskopowe wzory błony śluzowej żołądka i ich znaczenie kliniczno-patologiczne. Świat J Gastroenterol. 2003; 9 (11): 2552-2556.
opublikowany - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. Nowa metoda diagnostyki metaplazji żołądka i jelit: obrazowanie wąskopasmowe z powiększającą endoskopią. Endoskopia. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Endoskopia powiększająca: czy poprawia analizę powierzchni błony śluzowej w diagnostyce nowotworów żołądkowo-jelitowych ?. Endoskopia. 2002; 34 (10): 819-822.
pubmed doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Chromoendoskopia z błękitem metylenowym i powiązanymi uszkodzeniami DNA w przełyku Barretta. Lancet. 2003; 362 (9381): 373-374.
publikacja doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Pięcioletnie badanie kontrolne dotyczące zmian histologicznych i endoskopowych w błonie śluzowej żołądka po eradykacji Helicobacter pylori. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Od dwóch do czterech lat histologiczna kontrola błony śluzowej żołądka po Helicobacter pylori. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. Profile mucynowe normalnego żołądka błony śluzowej, metaplazja jelit i jej odmiany oraz rak żołądka. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al. Intestinal metaplasia types and the risk of gastric rak: badanie kohortowe w Słowenii. Int J Cancer. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Wykrywanie zwiększonej częstości występowania wczesnego raka żołądka u pacjentów z metaplazją jelit typu III, którzy są poddawani ścisłej obserwacji. Jelito. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Artykuł przeglądowy: stany przednowotworowe błony śluzowej żołądka – praktyczne podejście dla zdezorientowanego lekarza. Aliment Pharmacol Ther. 2001; 15 (supl 1): 43-50.
opublikowany - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Wpływ eradykacji Helicobacter pylori na częstość występowania metachronicznego raka żołądka po endoskopowej resekcji wczesnego raka żołądka: otwarte, randomizowane badanie kontrolowane. Lancet. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Rak żołądka wykryty po eradykacji Helicobacter pylori. Endoskopia przewodu pokarmowego. 2007; 19: 167-173.
To jest artykuł ogólnodostępny rozpowszechniany na warunkach licencji Creative Commons Attribution License, zezwala na nieograniczone użytkowanie, dystrybucję i powielanie na dowolnym nośniku, pod warunkiem, że oryginalne dzieło jest prawidłowo zacytowane.
Badania gastroenterologiczne są publikowane przez Elmer Press Inc.