Cząsteczka cykloheksanu
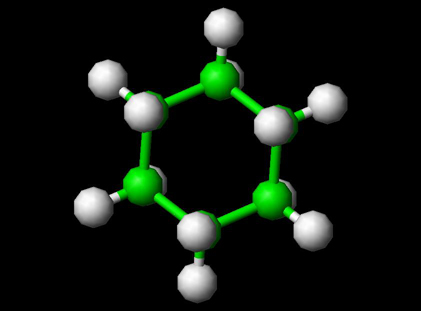
Cykloheksan jest cykloalkanem o wzorze cząsteczkowym C6H12. Cykloheksan jest stosowany jako niepolarny rozpuszczalnik w przemyśle chemicznym, a także jako surowiec do przemysłowej produkcji kwasu adypinowego i kaprolaktamu, które są półproduktami do produkcji nylonu. Na skalę przemysłową cykloheksan jest wytwarzany w reakcji benzenu z wodorem. Ze względu na swoje unikalne właściwości chemiczne i konformacyjne cykloheksan jest również stosowany w laboratoriach w analizie i jako standard.
Cząsteczka cykloheksanu przy użyciu Jsmol patrz – Struktury 3D
Struktura cykloheksanu Cząsteczka
6-wierzchołkowy pierścień nie pasuje do kształtu idealnego sześciokąta. Konformacja płaskiego płaskiego sześciokąta 2D ma znaczne odkształcenie kątowe, ponieważ jego wiązania nie mają 109,5 stopnia; odkształcenie skręcające byłoby również znaczne ze względu na wszystkie zaćmione wiązania. Dlatego, aby zmniejszyć odkształcenia skrętne, cykloheksan przyjmuje trójwymiarową strukturę znaną jako konformacja krzesła. Nowa konformacja ustawia węgle pod kątem 109,5 °. Połowa wodorów znajduje się w płaszczyźnie pierścienia (równikowej), podczas gdy druga połowa jest prostopadła do płaszczyzny (osiowo). Taka konformacja pozwala uzyskać najbardziej stabilną strukturę cykloheksanu. Istnieje inna konformacja cykloheksanu, znana jako konformacja łodzi, ale przekształca się ona wzajemnie w nieco bardziej stabilną formację krzesła. Jeśli cykloheksan jest monopodstawiony dużym podstawnikiem, wówczas podstawnik najprawdopodobniej będzie przyłączony w pozycji równikowej, ponieważ jest to nieco bardziej stabilna konformacja.
Cykloheksan ma najniższy kąt i odkształcenie skrętne wszystkie cykloalkany, w wyniku czego cykloheksan został uznany za 0 w całkowitym odkształceniu pierścienia, połączenie kąta i odkształcenia skrętnego. To sprawia, że cykloheksan jest najbardziej stabilnym z cykloalkanów i dlatego podczas spalania wytwarza najmniej ciepła w porównaniu z innymi cykloalkanami.
Cząsteczka cykloheksanu w kształcie krzesła. Atomy wodoru w pozycjach osiowych są pokazane na czerwono, podczas gdy te w pozycjach równikowych są na niebiesko.
Reakcje z cykloheksanem
Czysty cykloheksan sam w sobie jest raczej niereaktywny, będąc niepolarnym, hydrofobowy węglowodór. Może reagować z bardzo silnymi kwasami, takimi jak układ superkwasów HF + SbF5, co powoduje wymuszoną protonację i „pękanie węglowodorów”. Jednak podstawione cykloheksany mogą być reaktywne w różnych warunkach, z których wiele jest ważnych dla chemii organicznej. Cykloheksan jest wysoce łatwopalny.
Pochodne cykloheksanu
Specyficzne rozmieszczenie grup funkcyjnych w pochodnych cykloheksanu, a właściwie w większości cząsteczek cykloalkanu, jest niezwykle ważne w reakcjach chemicznych, zwłaszcza w reakcjach z udziałem nukleofilów. Podstawniki na pierścieniu muszą być w formacji osiowej, aby reagować z innymi cząsteczkami. Na przykład reakcja bromocykloheksanu i zwykłego nukleofila, anionu wodorotlenkowego, spowodowałaby cykloheksen.
Ta reakcja, powszechnie znana jako reakcja eliminacji lub dehalogenacja (w szczególności E2), wymaga, aby podstawnik bromu był w formacji osiowej, przeciwstawiając się reakcji innego aksjalnego atomu H. Zakładając, że bromocykloheksan był w odpowiedniej formacji do reakcji, reakcja E2 rozpoczęłaby się jako taka:
- Wiązanie pary elektronów między C-Br przesuwa się do Br, tworząc Br∠'i ustawiając go wolny od cykloheksanu
- Nukleofil (-OH) przekazuje parę elektronów do sąsiedniego osiowego H, uwalniając H i łącząc się z nim, tworząc H2O
- Wiązanie pary elektronów między sąsiednim osiowe H przesuwa się do wiązania między dwoma CC, tworząc C = C
Uwaga: Wszystkie trzy kroki zachodzą jednocześnie, charakterystyczne dla wszystkich reakcji E2.
Powyższa reakcja będzie generować głównie reakcje E2, w wyniku czego produktem będzie głównie (~ 70%) cykloheksen. Jednak odsetek ten zależy od warunków i na ogół konkurują ze sobą dwie różne reakcje (E2 i Sn2). W powyższej reakcji reakcja Sn2 zastąpiłaby brom grupę hydroksylową (OH-), ale ponownie, Br musi być osiowy, aby przereagować. Gdy podstawienie SN2 zostanie zakończone, nowo podstawiona grupa OH szybko wróci do bardziej stabilnej pozycji ekwatorialnej (~ 1 milisekunda). utlenianie. Olej KA jest następnie używany jako surowiec do produkcji kwasu adypinowego i kaprolaktamu. Praktycznie, jeśli zawartość cykloheksanolu w oleju KA jest wyższa niż cykloheksanonu, jest bardziej prawdopodobne (ekonomiczne) przekształcenie go w kwas adypinowy, a odwrotnie – produkcja kaprolaktamu jest bardziej prawdopodobna. Taki stosunek w oleju KA można kontrolować dobierając odpowiednie katalizatory utleniające. Część cykloheksanu jest używana jako rozpuszczalnik organiczny.
Cykloheksan w badaniach
Chociaż wiele już wiadomo na temat tego cyklicznego węglowodoru, nadal prowadzi się badania nad mieszaninami cykloheksanu i benzenu oraz cykloheksanem w fazie stałej w celu określenia wydajności wodoru w mieszaninie po napromieniowaniu w 195 ° C.
Historia
W przeciwieństwie do związków takich jak benzen, cykloheksanu nie można łatwo uzyskać z zasobów naturalnych, takich jak węgiel. Pod koniec XIX wieku wczesni badacze chemii musieli polegać na syntezie organicznej. Dopracowanie szczegółów zajęło im 30 lat. W 1867 Marcellin Berthelot zredukował benzen kwasem jodowodorowym w podwyższonych temperaturach. Błędnie zidentyfikował produkt reakcji jako n-heksan nie tylko ze względu na dogodne dopasowanie temperatury wrzenia (69 ° C), ale także dlatego, że nie wierzył, że benzen jest cząsteczką cykliczną (jak jego współczesny August Kekule), ale raczej jakiś rodzaj skojarzenia acetylenowy. W 1870 r. Jeden z jego sceptyków Adolf von Baeyer powtórzył reakcję i wymówił ten sam produkt reakcji heksahydrobenzenem, aw 1890 r. Władimir Markownikow sądził, że jest w stanie destylować ten sam związek z ropy kaukaskiej, nazywając swoją miksturę heksanaftenem.
W 1894 roku Baeyer zsyntetyzowany cykloheksan, rozpoczynając od kondensacji Dieckmanna kwasu pimelinowego, a następnie wielokrotnych redukcji. aw tym samym roku E. Haworth i W.H. Perkin Jr. (1860 – 1929) zrobił to samo w reakcji Wurtza z 1,6-dibromoheksanem, a ich cykloheksany wrzenia o 10 ° C wyższe niż heksahydrobenzen czy heksanaften, ale zagadkę tę rozwiązali w 1895 roku Markownikow, NM Kishner i Nikolay Zelinsky’ego, kiedy ponownie zdiagnozowali heksahydrobenzen i heksanaften jako metylocyklopentan, wynik nieoczekiwanej reakcji przegrupowania.