Fakty dotyczące pierwiastka francuskiego
Pierwiastek chemiczny frank jest sklasyfikowany jako metal alkaliczny. Został odkryty w 1939 roku przez Marguerite Perey.

Strefa danych
| Klasyfikacja: | Francja jest metalem alkalicznym |
| Kolor: | srebrno-szary metalik (przypuszczalnie) |
| Atomowy waga: | (223), brak stabilnych izotopów |
| Stan: | solid |
| Temperatura topnienia: | 27 oC, 300 K |
| Temperatura wrzenia: | 677 oC, 950 K |
| Elektrony: | 87 |
| Protony: | 87 |
| Neutrony w najpowszechniejszym izotopie: | 136 |
| Powłoki elektronowe: | 2, 8,18,32,18,8,1 |
| Konfiguracja elektronowa: | 7s1 |
| Gęstość w 20oC: | 1,873 g / cm3 |
Pokaż więcej, w tym: ciepło, energia, utlenianie,
Reakcje, związki, promienie, przewodnictwo
| Objętość atomowa: | 71,07 cm3 / mol |
| Struktura: | uważana za bcc: sześcienny centrowany na ciele |
| Twardość: | – |
| Ciepło właściwe | – |
| Ciepło topnienia | 2 kJ mol-1 |
| Ciepło atomizacji | 73 kJ mol-1 |
| Ciepło parowania | 64 kJ mol-1 |
| Pierwsza energia jonizacji | 384 kJ mol-1 |
| Druga energia jonizacji | – |
| Trzecia energia jonizacji | – |
| Powinowactwo elektronowe | – |
| Minimalny stopień utlenienia | 0 |
| Min. wspólny nr utlenienia | 0 |
| Maksymalny stopień utlenienia | 1 |
| Max. wspólny nr utleniania | 1 |
| Elektroujemność (skala Paulinga) | 0,7 |
| Polaryzowalność głośność | 48,7 Å3 |
| Reakcja z powietrzem | – |
| Reakcja z 15 M HNO3 | – |
| Reakcja z 6 M HCl | energiczne, ⇒ H2, FrCl |
| Reakcja z 6 M NaOH | energiczny, ⇒ H2, FrOH |
| Tlenek (i) | – |
| Wodorki | – |
| Chlorek (i) | – |
| Promień atomowy | – |
| Promień jonowy (1+ jon) | 194 po południu |
| Promień jonowy (2+ jony) | – |
| Promień jonowy (3+ jony) | – |
| Promień jonowy (1-jonowy) | – |
| Promień jonowy (2-jonowy) | – |
| Promień jonowy (3-jonowy) | – |
| Przewodność cieplna | 3,61 W m-1 K-1 |
| Przewodność elektryczna | – |
| Temperatura krzepnięcia / topnienia: | 27 oC, 300 K |

Ta próbka rudy uranu zawiera około 100 000 atomów fransu-223 (3,3 x 10-20 g). Frank jest radioaktywny; mniej niż 30 g tego znajduje się na Ziemi w danym momencie. Image Ref. (1)
Odkrycie Francium
Francium została odkryta przez Marguerite Perey w 1939 roku, kiedy badała radioaktywny rozpad aktynu-227.
Odkrycie miało miejsce w Instytucie Curie w Paryżu. Nazwa pierwiastka pochodzi od kraju jego odkrycia – Francji.
Odkrycie rozpoczęło się w 1935 roku, kiedy Perey w wieku 26 lat przeczytał artykuł, w którym twierdził, że amerykańscy naukowcy odkryli cząstki beta emitowane przez aktyn, który miała wyższą ilość energii niż normalnie.
Perey była zaciekawiona tym odkryciem i będąc już ekspertem w pracach związanych z aktynem, zdecydowała się przeprowadzić własne eksperymenty z aktynem. Wytworzyła ultra czystą próbkę aktynu i zbadała jego promieniowanie. Perey odkrył, że około 1% radioaktywności aktynu było spowodowane emisją cząstek alfa, a nie cząstek beta.
Perey odkrył, że aktyn-227 może rozpadać się, emitując jądro helu (zwane również cząstką alfa) z własne jądro. Powstałe jądro potomne było nieodkrytym wcześniej pierwiastkiem, który wybrała nazwę francium na cześć swojego rodzinnego kraju, Francji.
227Ac → 223Fr + 4He
Nowy pierwiastek z 87 protonami należał do Grupa 1 układu okresowego, łącząca pozostałe pięć metali alkalicznych: lit, sód, potas, rubid i cez.
Odkrycie francium zakończyło odkrycia przez ludzkość naturalnie występujących pierwiastków.
Wszystkie pierwiastki odkryte od tego czasu zostały odkryte, gdy pierwiastek został wyprodukowany w laboratorium.

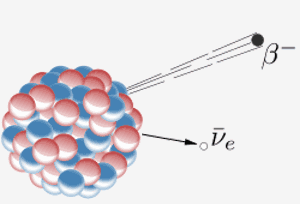
Jądro emituje cząstkę beta ( elektron) i antyneutrino. W rezultacie neutron w jądrze zamienia się w proton. Kiedy pierwiastek 87 w układzie okresowym (francium) robi to, dodatkowy proton oznacza, że staje się pierwiastkiem 88 (radem).
Wygląd i Charakterystyka
Szkodliwe skutki:
Wapń jest wysoce radioaktywny.
Charakterystyka:
Franap to ciężki, niestabilny, radioaktywny metal z maksymalny okres półtrwania tylko 22 minuty. Ma niską temperaturę topnienia (27 oC, 81 oF) i gdyby można było go zgromadzić w wystarczającej ilości, byłby płynny w ciepłym pomieszczeniu.
Wapń jest drugim najrzadszym pierwiastkiem w skorupie ziemskiej obok astatyny. W dowolnym momencie na Ziemi istnieje mniej niż trzydzieści gramów franu.
Fran wapń jest najmniej elektroujemnym ze wszystkich pierwiastków, dlatego powinien być najbardziej reaktywnym chemicznie metalem alkalicznym. Niestety nie jest on dostępny w wystarczających ilościach, aby wykazać, że reaguje z wodą – powstaje w niewielkich ilościach w akceleratorach cząstek. Teoretycznie jego reakcja z wodą byłaby gwałtowniejsza niż cezu i znacznie gwałtowniejsza niż sodu.
Francium badano ostatnio na Uniwersytecie Stony Brook w Nowym Jorku. Tam naukowcy uwięzili do dziesięciu tysięcy atomów franu na raz za pomocą wiązek laserowych w polu magnetycznym w celu zmierzenia ich właściwości.
Zastosowania franka
W handlu nie ma zastosowań franka ze względu na jego rzadkość i niestabilność. Jest używany wyłącznie do celów badawczych.
Rozpad franka
Izotopy franka, o liczbach masowych w zakresie od 200 do 232, najczęściej ulegają rozpadowi alfa lub beta.
Oto kilka przykładów ścieżek rozpadu franu:
Francium-223 to najdłużej żyjący izotop pierwiastka. Ma okres półtrwania 22 minuty. Może emitować cząstkę alfa (jądro helu), tworząc astat-219 lub cząstkę beta, tworząc rad-223. (Cząstka beta to elektron, który jest emitowany z jądra, gdy neutron przekształca się w proton.)
Francium-221 ma okres półtrwania wynoszący 5 minut. Może emitować cząstkę alfa, aby utworzyć astat-217 lub cząstkę beta, aby przekształcić się w rad-221.
Okres półtrwania Francium-216 wynosi 0,7 mikrosekundy. Może emitować cząstkę alfa, tworząc astat-212 lub pozyton, tworząc radon-216.
Francium-212 ma okres półtrwania wynoszący 19 minut. Może emitować cząstkę alfa, tworząc astat-208 lub wychwytywać elektron na orbicie, tworząc radon-212. (2) (Podczas wychwytywania elektronów na orbicie jądro wychwytuje jeden z własnych elektronów atomu i emituje neutrino.)
Obfitość i izotopy
Obfitość skorupy ziemskiej: ~ 0 części na milion , ~ 0 części na milion
Obfitość układu słonecznego: ~ 0 części na miliard wagowo, ~ 0 części na miliard moli
Czysty koszt: $ za 100g
Koszt, luz: $ za 100g
Źródło: frank występuje naturalnie w wyniku rozpadu promieniotwórczego alfa aktynu.
Izotopy: frank ma 33 izotopy, których okres półtrwania są znane, o liczbach masowych od 200 do 232. Żadne nie są stabilne. 223Fr ma najdłuższy okres półtrwania wynoszący 21,8 minuty.

- Zdjęcie: Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, wydanie 6.
Cytuj tę stronę
Aby utworzyć łącze online, skopiuj i wklej jedno z poniższych:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
lub
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Aby zacytować tę stronę w dokumencie akademickim, użyj następujący cytat zgodny z MLA:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.