Fakty dotyczące pierwiastka kadmu
Pierwiastek chemiczny kadm jest sklasyfikowany jako metal przejściowy. Został odkryty w 1817 roku przez Friedricha Stromeyera.

Strefa danych
| Klasyfikacja: | Kadm to metal przejściowy |
| Kolor: | niebieskawo-biały |
| Masa atomowa: | 112,41 |
| Stan: | ciało stałe |
| Temperatura topnienia: | 321,1 oC, 594,3 K |
| Temperatura wrzenia: | 765 oC, 1038 K |
| Elektrony: | 48 |
| Protony: | 48 |
| Neutrony w większości izotopów: | 66 |
| Powłoki elektronowe: | 2,8,18,18,2 |
| Konfiguracja elektronowa: | 4d10 5s2 |
| Gęstość @ 20oC: | 8,65 g / cm3 |
Pokaż więcej, w tym: Ciepła, Energie, Utlenianie, Reakcje,
Związki, Promienie, Przewodności
| Objętość atomowa: | 13,1 cm3 / mol |
| Struktura: | hcp: sześciokątny zwarty |
| Twardość: | 2,0 mohs |
| Ciepło właściwe | 0,23 J g-1 K-1 |
| Ciepło topnienia | 6,192 kJ mol-1 |
| Ciepło atomizacji | 112 kJ mol-1 |
| Ciepło parowania | 99,87 kJ mol-1 |
| Pierwsza energia jonizacji | 867,7 kJ mol-1 |
| Energia drugiej jonizacji | 1631,4 kJ mol-1 |
| Energia trzeciej jonizacji | 3616,2 kJ mol-1 |
| Powinowactwo elektronowe | – |
| Minimalny stopień utlenienia | 0 |
| Min. wspólny nr utlenienia | 0 |
| Maksymalny stopień utlenienia | 2 |
| Max. wspólny nr utleniania | 2 |
| Elektroujemność (skala Paulinga) | 1,69 |
| Polaryzowalność głośność | 7,2 ≥3 |
| Reakcja z powietrzem | łagodna, w / ht ⇒ CdO |
| Reakcja z 15 M HNO3 | łagodne ⇒ Cd (NO3) 2, NOx |
| Reakcja z 6 M HCl | łagodne, ⇒ H2, CdCl2 |
| Reakcja z 6 M NaOH | brak |
| Tlenek (s) | CdO, CdO2 |
| Wodorki | CdH2 |
| Chlorki | CdCl2 |
| Promień atomowy | 151 po południu |
| Promień jonowy (1+ jon) | – |
| Promień jonowy (2+ jon) | 109 po południu |
| Promień jonowy (jon 3+) | – |
| Promień jonowy (1-jonowy) | – |
| Promień jonowy (2-jonowy) | – |
| Promień jonowy (3-jonowy) | – |
| Przewodność cieplna | 96,6 W m-1 K-1 |
| Przewodność elektryczna | 14,7 x 106 S m-1 |
| Temperatura krzepnięcia / topnienia: | 321,1 oC, 594,3 K |

Mała kulka wykonana z kadmu i monety z informacją o rozmiarze.

Friedrich Stromeyer, który odkrył kadm w 1817 roku.
Okolice kadmu okresowego w sąsiedztwie
| Grupa 11 |
Grupa 12 | Grupa 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 In |
| 6 | 79 Au |
80 Hg |
81 Tl |
Odkrycie kadmu
Kadm został odkryty przez niemieckiego chemika Friedricha Stromeyera w 1817 roku jako zanieczyszczenie tlenku cynku. (1)
Stromeyer dokonał odkrycia na prośbę rządu o zbadanie aptek w mieście Hildesheim w Niemczech.
W tamtych czasach tlenek cynku był używany, tak jak jest, w leczeniu chorób skóry. Z jakiegoś powodu apteki Hildesheim sprzedawały węglan cynku zamiast zwykłego tlenku cynku.
Stromeyer był świadomy, że podgrzewanie węglanu cynku do czerwoności spowoduje jego konwersję w tlenek. Zrobił to z próbkami z aptek. Odkrył, że genialny biały węglan zamienił się w tlenek, który powinien być biały, ale w rzeczywistości był żółto-pomarańczowy.
Zwykle ten kolor sugerowałby zanieczyszczenie żelazem lub ołowiem, ale Stromeyer nie mógł znaleźć żadnego śladu tych pierwiastków.
Odwiedził fabrykę w Salzgitter, gdzie apteki kupowały węglan cynku. Zapytał, dlaczego sprzedają węglan cynku zamiast zwykłego tlenku.
Kierownik wyjaśnił mu, że ich węglan cynku ma oczekiwany kolor – biały – i jest łatwy w sprzedaży.
Kiedy próbowali zamienić węglan w tlenek przez ogrzewanie, zawsze stawał się żółty. Ponieważ tlenek cynku powinien być biały, nie mogli go sprzedać. Dokładnie przeanalizowali go pod kątem zanieczyszczenia żelazem, ale nie znaleźli żadnego.
Następnie Stromeyer zdecydował, że sam dokładnie przeanalizuje ten żółty tlenek cynku. Stwierdził, że żółty kolor był spowodowany „obecnością specyficznego metalicznego tlenku, o którego istnieniu nie podejrzewano dotychczas”.
Wyodrębnił ten nowy tlenek metalu z tlenku cynku, a następnie zredukował go, aby wyizolować pierwszy na świecie kadm. Porównał jego wygląd do platyny i zmierzył jego gęstość na 8,75 g / cm3 – bardzo zbliżoną do dzisiejszej zaakceptował wartość.
Wykonał dalsze prace i odkrył, że inne związki cynku również zawierały jego nowy metal. Przeanalizował „czysty” cynk metaliczny i stwierdził, że jego nowy metal był obecny nawet w nim.
Oszacował, że nowy metal był obecny w ilości od 0,1% do 1% w cynku i jego związkach, z którego był w stanie wyodrębnić 3 gramy czystego kadmu.
Stromeyer zasugerował nazwę kadmu po „kadmii” łacińska nazwa kalaminy. Kalamina to stara nazwa rudy cynku.
Kadm został odkryty niezależnie przez niemieckiego chemika Karla Hermanna w 1818 roku. Hermann zauważył nieoczekiwany żółty kolor w siarczku cynku . Zakładano, że kolor żółty pochodzi z zanieczyszczeń arszenikowych, ale Hermann zdał sobie sprawę, że w rzeczywistości jest to spowodowane wcześniej nieznanym ele ment. (2)


Tellurku kadmu używa się do produkcji cienkowarstwowych ogniw słonecznych, pochłaniają ponad 90% światła widzialnego. Obraz: NREL
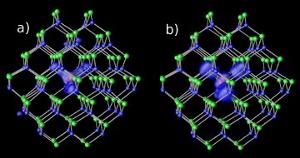
Zanieczyszczenia magnezu w nanokryształach kadmu i selenu na dwóch różnych poziomach szczeliny : (a) rezonansowy i (b) hybrydowy. Obraz: NERSC
Wygląd i charakterystyka
Szkodliwe skutki:
Kadm i jego związki są wysoce toksyczne.
Charakterystyka:
Kadm to miękki, kowalny, ciągliwy, niebieskawo-biały metal, który można łatwo ciąć nożem. Jest doskonałym przewodnikiem elektrycznym i wykazuje dobrą odporność na korozję i atak chemikaliów.
Pod wieloma względami jest podobny do cynku w swoich właściwościach chemicznych.
Kadm matowieje w powietrzu i jest rozpuszczalny w kwasach, ale nie w zasadach.
Metal spala się w powietrzu, tworząc brązowy tlenek kadmu (CdO).
Zastosowania kadmu
Głównym zastosowaniem kadmu jest w bateriach (szczególnie akumulatory niklowo-kadmowe, NiCad, akumulatory).
Kadm ze względu na niski współczynnik tarcia i wysoką odporność na zmęczenie jest stosowany w stopach na łożyska. Kadm jest stosowany w stopach niskotopliwych i jest składnikiem wielu rodzajów lutowia. Znajduje również zastosowanie w galwanotechnice.
Związki zawierające kadm są używane w czarno-białych luminoforach telewizyjnych oraz w niebieskich i zielonych luminoforach w kineskopach do telewizji kolorowej. Siarczek kadmu jest używany jako żółty pigment, a selenek kadmu jako czerwony pigment, często nazywany czerwienią kadmu.
Kadm i tellur można połączyć w cienkowarstwowe moduły fotowoltaiczne CdTe, których właściwości fizyczne są idealne dla produkcja ogniw słonecznych. Są stosunkowo tanie i mają prawie idealne pasmo zabronione do zbierania energii słonecznej.
Obfitość i izotopy
Obfitość skorupy ziemskiej: 150 części na miliard wagowo, 30 części na miliard na mol
Obfitość układu słonecznego: 6 części na miliard wagowo, 70 części na bilion na mole
Koszt, czysty: 46 USD za 100 g
Koszt, luzem: 0,77 USD na 100g
Źródło: Kadm występuje najczęściej w małych ilościach w połączeniu z rudami cynku, takimi jak sfaleryt (ZnS). Greenockite (CdS) jest jedynym minerałem kadmu o jakichkolwiek konsekwencjach. Prawie cały kadm jest uzyskiwany jako produkt uboczny operacji rafinacji rud cynku, miedzi i ołowiu.

- Friedrich Stromeyer, Annals of Philosophy, pod redakcją Thomasa Thomsona, tom XIII, 1819, Robert Baldwin, str. 108
- JW Mellor, A Comprehensive Treatise in Inorganic and Theoretical Chemistry, tom IV, 1929, Longmans, Green and Co. Ltd., str. 404
Cytuj tę stronę
Aby uzyskać linki online , skopiuj i wklej jedną z poniższych:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
lub
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
Do zacytuj tę stronę w dokumencie naukowym, użyj następującego cytatu zgodnego z MLA:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.