Fakty dotyczące pierwiastka polonowego
Pierwiastek chemiczny polon jest klasyfikowany jako chalkogen i metaloid. Został odkryty w 1898 roku przez Marie i Pierre Curie.

Strefa danych
| Klasyfikacja: | Polon to chalkogen i metaloid |
| Kolor: | srebrno-szary |
| Masa atomowa : | (209), brak stabilnych izotopów |
| Stan: | solid |
| Temperatura topnienia: | 254 oC, 527 K |
| Temperatura wrzenia: | 960 oC, 1233 K |
| Elektrony: | 84 |
| Protony: | 84 |
| Neutrony w najpowszechniejszym izotopie: | 125 |
| Powłoki elektronowe: | 2,8 , 18,32,18,6 |
| Konfiguracja elektronowa: | 4f14 5d10 6s2 6p4 |
| Gęstość w 20oC: | 9,4 g / cm3 |
Pokaż więcej, w tym: Ciepła, Energie, Wół idation,
Reakcje, związki, promienie, przewodnictwo
| Objętość atomowa: | 22,23 cm3 / mol |
| Struktura: | prosta sześcienna |
| Twardość: | – |
| Ciepło właściwe | 0,12 J g-1 K-1 0,12 |
| Ciepło topnienia | 13 kJ mol-1 |
| Ciepło atomizacji | 142 kJ mol-1 |
| Ciepło parowania | 120 kJ mol-1 |
| Pierwsza energia jonizacji | 812 kJ mol-1 |
| Druga energia jonizacji | – |
| Trzecia energia jonizacji | – |
| Powinowactwo elektronowe | 180 kJ mol-1 |
| Minimalny stopień utlenienia | -2 |
| Min. wspólny nr utlenienia | -2 |
| Maksymalny stopień utlenienia | 6 |
| Maks. wspólny nr utleniania | 4 |
| Elektroujemność (skala Paulinga) | 2,0 |
| Polaryzowalność głośność | 6,8 Å3 |
| Reakcja z powietrzem | łagodna, ⇒ PoO2 |
| Reakcja z 15 M HNO3 | – |
| Reakcja z 6 M HCl | łagodne, ⇒ PoCl2 |
| Reakcja z 6 M NaOH | brak |
| Tlenek (s) | PoO2, PoO2 |
| Wodorki | PoH2 |
| Chlorek (i) | PoCl2 |
| Promień atomowy | 190 pm |
| Promień jonowy (1+ jon) | – |
| Promień jonowy (2+ jony) | – |
| Jonowy promień (jon 3+) | – |
| Promień jonowy (1-jonowy) | – |
| Promień jonowy (2-jonowy) | – |
| Promień jonowy (3-jonowy) | – |
| Przewodność cieplna | 0,2 W m-1 K-1 |
| Przewodność elektryczna | 0,7 x 106 S m-1 |
| Temperatura krzepnięcia / topnienia: | 254 oC, 527 K |

Marie Curie w 1883, 16 lat. Polon był pierwszym pierwiastkiem, który odkryła 15 lat później.
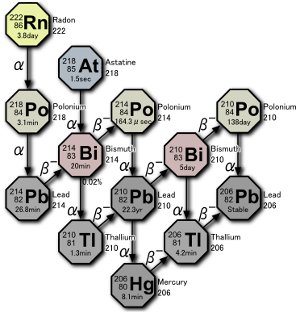
Część seria rozpadu uranu. W naturze powstają trzy izotopy polonu w wyniku rozpadu samego gazu radonowego lub rozpadu atomów będącego wynikiem rozpadu radonu. Zdjęcie: Tosaka.
Odkrycie polonu
Polon był pierwszym pierwiastkiem odkrytym przez Marie i Pierre Curie.
Odkryli polon, a następnie rad w 1898 roku w Paryżu, badając radioaktywność w blendzie smolistej (tlenku uranu). / p>
Napisali: „Uważamy, że substancja, którą wyekstrahowaliśmy z blendy smolistej, zawiera nieznany dotąd metal, podobny do bizmutu w swoich właściwościach analitycznych. Jeśli istnienie tego nowego metalu zostanie potwierdzone, sugerujemy, że powinien on być zwany polonem od nazwy kraju pochodzenia jednego z nas ”.
Zgodnie z życzeniem Curie polon nosi nazwę Polski, w której urodziła się i dorastała Marie Curie.
Zagrożenia związane z pracą z pierwiastkami promieniotwórczymi nie były znane, gdy Curie dokonali swoich odkryć. Ich notatniki laboratoryjne z tego czasu są tak radioaktywne, że są teraz przechowywane w wyłożonej ołowiu walizce. (1)
Wygląd i charakterystyka
Szkodliwe skutki:
Polon jest szkodliwy zarówno ze względu na swoją toksyczność chemiczną, jak i radioaktywność.Polon-210 jest emiterem alfa, dlatego jest bardzo niebezpieczny w przypadku połknięcia lub wdychania.Narażenie na polon zwiększa ryzyko zachorowania na różne rodzaje raka.
Charakterystyka:
Polon jest rzadkim, srebrzystoszarym, radioaktywnym, niskotopliwym metaloidem.
Polon łatwo reaguje z rozcieńczonymi kwasami, ale tylko nieznacznie z zasadami.
Wszystkie jego izotopy są radioaktywne.
210Po emituje niebieską poświatę, ponieważ powietrze wokół niego jest wzbudzane przez rozpad produkty. 1 gram Po emituje tyle cząstek alfa, ile 5 kilogramów radu.
Energia uwalniana przez rozpad alfa polonu jest znaczna i ogrzewa przestrzeń wokół niego. Uwolniona energia jest tak duża (140 W / g), że kapsułka zawierająca około pół grama osiąga temperaturę powyżej 500 ° C.
Zastosowania polonu
Promienie alfa emitowane przez polon może być stosowany do eliminacji elektryczności statycznej wytwarzanej podczas procesów takich jak walcowanie papieru, drutu i blachy. Jednak źródła promieniowania beta są częściej używane, ponieważ są mniej niebezpieczne.
210Po może być używane jako atomowe źródło ciepła, ale ze względu na krótki okres półtrwania izotopu (138,4 dnia) nie zapewnia energii do długotrwałych zastosowań.
Polon jest również używany w szczotkach antystatycznych w celu usunięcia kurzu z kliszy fotograficznej. Jest uszczelniony w szczotkach, aby kontrolować emisje radioaktywne.
Obfitość i izotopy
Obfitość w skorupie ziemskiej: rzędu 1 części na biliard.
Obfitość w Układzie Słonecznym: znikoma
Koszt , czysty: na 100 g
Koszt, luz: za 100 g
Źródło: Polon jest bardzo rzadkim pierwiastkiem ze względu na krótki okres półtrwania wszystkich jego izotopów. Występuje w rudach uranu w niewielkich ilościach. Można go uzyskać przez bombardowanie naturalnego bizmutu 209Bi neutronami, aby uzyskać 210Bi, który następnie rozpada się do 210Po poprzez rozpad β. Około 100 g polonu jest syntetyzowane każdego roku.
Izotopy: polon ma 29 izotopów, których okresy połowicznego rozpadu są znane, o liczbach masowych od 190 do 218. Żaden nie jest stabilny. Najbardziej stabilnym izotopem jest 209Po, którego okres półtrwania wynosi 102 lata.

Cytuj tę stronę
Aby utworzyć łącze online, skopiuj i wklej jedno z następujących:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
lub
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Aby zacytować tę stronę w dokumencie naukowym, użyj następującego cytowania zgodnego z MLA:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.