Frontiers in Immunology (Polski)
Wprowadzenie
Stan przedrzucawkowy jest chorobą związaną z ciążą, która dotyka 3–5% wszystkich ciąż (1, 2). Objawia się nowo powstającym nadciśnieniem tętniczym po 20. tygodniu ciąży i białkomoczem. Łożysko odgrywa kluczową rolę w patogenezie choroby, łącząc matkę z płodem (3). Styk matczyno-płodowy to strefa, w której zróżnicowana genetycznie tkanka pochodzenia płodowego spotyka się z krążeniem matki, śródbłonkiem i układem odpornościowym. Często nazywana chorobą teorii, powszechnie akceptowanym poglądem jest to, że stan przedrzucawkowy wpływa na śródbłonek matki, powodując zaburzenia funkcji śródbłonka, co prowadzi do nadciśnienia i białkomoczu (2). W ciężkiej postaci stan przedrzucawkowy może prowadzić do zahamowania wzrostu płodu, wcześniactwa, a dla matki może spowodować niewydolność narządową nerek i wątroby, a także rzucawkę. Ponadto stan przedrzucawkowy może mieć długoterminowe niekorzystne konsekwencje sercowo-naczyniowe dla matki i noworodka (4). Rozwój łożyska jest uważany za niewystarczający zwłaszcza w procesie transformacji tętnicy spiralnej matki, w którym komórki trofoblastu atakują stronę matczyną w decidua i przekształcają tętnice w przewody o niskim oporze, zastępując także śródbłonek matki (5–7). Zwykle taka przebudowa tętnic macicznych jest nieobecna lub niepełna, zwłaszcza w ciężkiej postaci stanu przedrzucawkowego. Wysoki opór w zwężonych tętnicach macicznych powoduje burzliwy przepływ krwi do przestrzeni międzykomórkowej łożyska, powodując stres oksydacyjny i mechaniczne uszkodzenie kosmków łożyska. Wynikające z tego uszkodzenie zwiększa złuszczanie się mikrocząstek i mediatorów zapalenia przez łożysko, co prowadzi do uogólnionej aktywacji i dysfunkcji śródbłonka (8, 9). Te sekwencyjne zdarzenia na granicy matczyno-płodowej prowadzą do nadciśnienia u matki i innych objawów opisanych powyżej.
Zespół HELLP został po raz pierwszy scharakteryzowany w 1982 roku przez Weinsteina jako oddzielny zespół, często występujący razem ze stanem przedrzucawkowym, ale obserwowany również samodzielnie (10, 11). Zespół HELLP charakteryzuje się hemolizą, podwyższoną aktywnością enzymów wątrobowych i niską liczbą płytek krwi. Często wymaga obserwacji na poziomie intensywnej terapii i leczenia objawowego. Patogeneza tego zespołu wciąż pozostaje w cieniu. Zespół HELLP ma wspólne cechy z mikroangiopatiami zakrzepowymi (TMA), takimi jak zakrzepowa plamica małopłytkowa (TTP) i zespół hemolityczno-mocznicowy (HUS). TMA występują w zróżnicowanej grupie chorób o wspólnych cechach hemolizy mikroangiopatycznej, trombocytopenii i uszkodzenia narządów w wyniku mikrozakrzepów. W TTP defekt genetyczny lub jak w zdecydowanej większości przypadków nabytych autoprzeciwciał przeciwko dezintegrynie i metaloproteinazie z motywem trombospondyny typu 1 13 (ADAMTS13), enzymu rozszczepiającego aktywowany czynnik von Willebranda (vWF), powoduje powstawanie niezwykle dużych aktywowane multimery vWF na komórkach śródbłonka, prowadzące do skrzepów płytek krwi w małych naczyniach i hemolizy. Typowy HUS jest spowodowany infekcją bakteryjną wytwarzającą toksynę Shiga (zwłaszcza Escherichia coli), podczas gdy atypowy HUS (aHUS) odnosi się do typu TMA, w którym leżą u podłoża niedobory genetyczne regulatorów alternatywnego szlaku układu dopełniacza, który w obecności wyzwalacza może powodować chorobę kliniczną (12, 13). Leczenie aHUS zatwierdzone przez FDA polega na infuzji ekulizumabu, antagonisty dopełniacza C5, który zapobiega tworzeniu się kompleksu atakującego błonę (MAC) (ryc. 1). Klinicznie HELLP ma te same objawy, co klasyczne TMA: hemoliza, trombocytopenia i zaburzenia narządowe obserwowane w wątrobie. W zależności od zastosowanej klasyfikacji TMA zespół HELLP jest zwykle klasyfikowany jako część wtórnych lub nabytych TMA (Tabela 1).
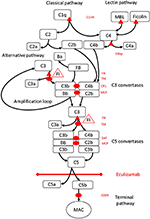
Rysunek 1. Ekulizumab hamuje końcowy szlak aktywacji dopełniacza. Aktywacja dopełniacza może być zapoczątkowana trzema ścieżkami aktywacji, z których wszystkie prowadzą do tworzenia konwertaz C5, które mają zdolność aktywowania szlaku końcowego prowadzącego do tworzenia MAC na powierzchni docelowej. Ta schematyczna ilustracja układu dopełniacza pokazuje jego najważniejsze aktywatory (czarną czcionką) i inhibitory (czerwoną). Aktywatory mogą być związane z błoną (owalne) lub rozpuszczalne (trójkąt). Szlak alternatywny aktywuje się spontanicznie na wszystkich powierzchniach, które nie pozwalają na hamowanie przez rozpuszczalny regulator czynnik H (FH). FH działa jako kofaktor inaktywacji C3b do iC3b przez czynnik I (FI). Trombomodulina ™ zwiększa aktywność kofaktora FH. Rozszczepiony czynnik B (FB) razem z aktywatorem C3b tworzy konwertazę szlaku alternatywnego, która ma zdolność rozszczepiania C3 do C3b, tworząc pętlę amplifikacji aktywacji szlaku alternatywnego.Klasyczny szlak aktywacji dopełniacza może być zapoczątkowany na przykład przez wiązanie kompleksów immunologicznych z C1q, podczas gdy szlak lektynowy jest aktywowany przez mannozę wiążącą lektynę (MBL) lub fikoliny wiążące się na przykład z wzorcami węglowodanów na drobnoustrojach. Aktywacja szlaku lektynowego powoduje, że proteazy serynowe 1 i 2 związane z mannozą (MASP-1 i MASP-2, nie pokazano) rozszczepiają składniki dopełniacza C4 i C2, tworząc klasyczną konwertazę szlaku C4bC2b. Inhibitor C1 (C1inh) i C4bp są rozpuszczalnymi regulatorami szlaku klasycznego, podczas gdy białko kofaktora błonowego (MCP) i receptor 1 dopełniacza (CR1) są regulatorami związanymi z błoną wczesnych szlaków dopełniacza. Tworzenie konwertaz C5 inicjuje końcowy szlak aktywacji dopełniacza i cięcia C5 przy braku regulatorów związanych z powierzchnią, czynnika przyspieszającego rozpad (DAF) i MCP. Montaż MAC jest regulowany przez regulator powierzchniowy CD59 (protektor). Rozszczepienie C3 na wczesnych szlakach i C5 na szlaku końcowym uwalnia anafilatoksyny C3a i C5a i powoduje zapalenie. Ekulizumab jest humanizowanym, rekombinowanym przeciwciałem przeciwko białku C5 dopełniacza, które hamuje rozszczepianie C5 przez konwertazy C5, regulując w ten sposób działanie prozakrzepowe i prozapalne aktywacji dopełniacza. Pacjent opisany w niniejszym opisie przypadku był badany pod kątem mutacji genetycznych w genach kodujących czynnik H (CFH), FHR5 i MCP, CFI, CFB, THBD i ADAMTS13 (ADAMTS13), regulator szlaku vWF kaskady krzepnięcia (nie pokazane). Wyniki testów genetycznych były negatywne.

Tabela 1. Kryteria diagnostyczne HELLP i aHUS.
W tym studium przypadku przedstawiamy pacjentka z powikłanym TMA wywołanym ciążą i pomyślnym przebiegiem leczenia.
Opis przypadku
Dwudziestodziewięcioletnia primigravida została skierowana w wieku ciążowym 34 + 2 do szpitala uniwersyteckiego w Helsinkach ambulatorium z dolegliwościami bólowymi w górnej części brzucha Początkowo jej ciśnienie tętnicze było nieznacznie podwyższone (133/91 mmHg), a test paskowy w moczu był dodatni na obecność białka. Początkowo zgłaszany ból w górnej części brzucha stopniowo ustępował. W badaniu USG płód miał prawidłowy profil biofizyczny (BPP), oszacowano wagę na krzywej wzrostu −2 SD. Kardiotokografia (CTG) była prawidłowa. Hemoglobina we krwi (Hb) wynosiła 115 g / l, płytki krwi 158 E9 / l (norma 150–360 E9 / l), aminotransferaza alaninowa (ALT) była prawidłowa (23 U / l). Test paskowy moczu był dodatni pod względem białka (+2), a obliczony białkomocz wynosił 1,6 g / 24 h. Podjęto decyzję o rozpoczęciu leczenia kortyzonem, aby ułatwić dojrzewanie płuc dziecka. Chory został wypisany z planem powrotu następnego dnia na kontrolę i drugą dawkę kortyzonu. Zgodnie z planem przyszła na kontrolę w 34 + 4 tygodniu ciąży. Ciśnienie krwi 147/87 mmHg, ALT 23, płytki krwi 177, CTG i BPP płodu w USG prawidłowe. Została wypisana i zaplanowano kolejną kontrolę. Po południu tego samego dnia ból w górnej części brzucha powrócił i stopniowo nasilał się pod wieczór. Wróciła do szpitala o 2.20 w nocy.Cierpiała na silny ból w górnej części brzucha, niepokój, dwa razy wymiotowała i drżała. Ciśnienie krwi było wyraźnie podwyższone do 170/94 mmHg, test paskowy w moczu był silnie dodatni, ALT była podwyższona do 159, Hb 122, a liczba płytek krwi 172. Została przyjęta na oddział prenatalny. O 4 rano odczuwała ból głowy. Rozpoczęto leczenie przeciwnadciśnieniowe (trzykrotnie Labetalol 100 mg). Wydalanie białka w moczu osiągnęło szczyt w nocy i wynosiło 13 g / 24 h. Następnie zaczęła wymiotować, miała bóle w górnej części brzucha i głowy, a monitorowanie KTG wykazało spowolnienie. Pacjentkę przewieziono o godzinie 7.11 na oddział porodowy, a ponieważ szyjka macicy była o 3 cm poszerzona, błony płodu zostały sztucznie przerwane w celu wywołania porodu. W tym samym czasie badania laboratoryjne zakończono z użyciem Hb 122, płytki krwi 172. Jednak w tym czasie poziom dehydrogenazy mleczanowej (LD) był wyraźnie podwyższony do 1231 U / l. W KTG spowolnienie utrzymywało się, a wraz z postępującą bradykardią wykonano pilne cięcie cesarskie. Niemowlę płci męskiej (1960 g, -2 SD) urodziło się o 7.25 rano z wartością pH w tętnicy pępowinowej 7,05, BE -6,80, Apgar 1/6/8. Utrata krwi podczas operacji wyniosła 400 ml.
O 9 rano po cesarskim cięciu płytki krwi matki były niskie, osiągając 49, a Hb 102. Po południu ALT wzrosła do 1800, LD 3570 stężenie kreatyniny w surowicy wyniosło 153 (μmol / l), a liczba płytek krwi spadła do 33. Wystąpiły zaburzenia krzepnięcia, na co wskazywał niski poziom fibrynogenu (1,1 g / l, wartości referencyjne 2–4 g / l) i wysoki poziom D -dimer fibryny (30,2 mg / l, < 0,5 mg / l) Wystąpiło pewne krwawienie z rany po cięciu cesarskim, w którym umieszczono dodatkowe szwy.W tym czasie podano osiem jednostek płytek krwi. Poziom potasu wzrósł z 4,7 do 5,6 (mmol / l). Wyraźnie zaobserwowano hemolizę. Wynik testu Coombsa był negatywny. Wydalanie z moczem wynosiło tylko 10 ml / h. Test laboratoryjny wykazał wyraźnie ciężką chorobę z objawami uszkodzenia zarówno nerek, jak i wątroby. Ponadto wystąpiły zaburzenia w układzie krzepnięcia, wykazujące jednocześnie znaczną koagulację i wyraźną fibrynolizę. Wlew siarczanu magnezu rozpoczęto z powodu hiperrefleksji, która jest uważana za predykcyjny objaw drgawek, ciężkiego powikłania stanu przedrzucawkowego. Rozpoczęto dożylne podawanie deksametazonu w dawce 10 mg, a pacjenta przeniesiono na oddział intensywnej terapii (OIOM).
Ponadto wykonano testy laboratoryjne w celu diagnostyki różnicowej innych nagłych przypadków medycznych (tab. 2). Aktywność ADAMTS13 była prawidłowa 62% (40–130%), co wyklucza TTP. Poziom dopełniacza C3 (0,52 g / l, 0,71–1,41 g / l) i C4 (0,07 g / l, 0,12–0,34 g / l) był niski. Poziom rozpuszczalnego końcowego kompleksu dopełniacza (C5b-9, 971 ng / ml, < 366 ng / ml) był podwyższony w pierwszym dniu po porodzie. Nie wykryto przeciwciał antyfosfolipidowych, serologia zakażenia wirusem zapalenia wątroby typu B i C oraz HIV była ujemna. Z próbki kału patogeny wywołujące typowy test HUS są ujemne.

Tabela 2. Kalendarium diagnostyki i leczenia choroby.
Pacjentka była leczona metodą wymiany osocza w pierwszym i drugim dniu po porodzie i była w sumie trzykrotnie hemodializowana w trakcie leczenia (2., 4. i 6. dzień po porodzie).
W trzecim dniu po porodzie pacjentka była stabilna i została przeniesiona z powrotem do sali pooperacyjnej Szpitala Kobiecego. kontynuowano leczenie objawowe. Nadciśnienie leczono amlodypiną 10 mg dwa razy dziennie i labetalolem 200 mg trzy razy dziennie. W czwartym dniu po porodzie liczba płytek krwi nadal się zmniejszała i u pacjentki rozpoznawano aHUS. aHUS polega na samoistnym wyzdrowieniu pacjentek z HELLP, zwykle w trzecim dniu po porodzie. Rozpoczęto leczenie ekulizumabem (900 mg iv.). ent otrzymał szczepienie przeciwko pneumokokom i rozpoczęto profilaktyczne stosowanie antybiotyku (penicyliny). Pacjentka otrzymała łącznie cztery tygodniowe dawki ekulizumabu (900 mg) i zaczęła szybko wracać do zdrowia. Nie wymagała dalszej hemodializy po trzeciej hemodializie w szóstym dniu po porodzie (ryc. 2). Czynność nerek korygowana stopniowo, liczba płytek krwi podwyższona, hemoliza ustąpiła. Cztery tygodnie po porodzie poziomy C3 i C4 w osoczu zostały znormalizowane.
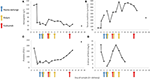
Rysunek 2. Wybrane wartości laboratoryjne obserwowane we wczesnych stadiach choroby oraz czas wymiany osocza, hemodializy i podania ekulizumabu. W panelu (A) przedstawiono rozwój pomiarów hemoglobiny we krwi, w panelu (B) poziom kreatyniny w surowicy, w panelu (C) liczba płytek krwi, aw panelu (D) D-dimer wartości fibryny w ciągu 17 dni okres obserwacji.
W testach genetycznych nie zidentyfikowano żadnych znanych polimorfizmów genów. Została przebadana pod kątem mutacji regulatorów dopełniacza czynnika H (CFH), białka związanego z czynnikiem H (FHR5) i białka kofaktora błonowego (MCP), czynnika inaktywatora alternatywnych szlaków dopełniacza I (CFI), czynnika aktywatora szlaku alternatywnego B (CFB) ) oraz następujące składniki kaskady krzepnięcia: ADAMTS13, trombomodulina (THBD) oraz wewnątrzkomórkowy enzym kinaza diacyloglicerolowa E (DGKE), których mutacje są znanymi przyczynami aHUS (14). Ponadto nie wykryto również przeciwciał przeciwko czynnikowi H. Nie wykryto niedoboru C4.
Podsumowując, nasz pacjent miał ciężki stan przedrzucawkowy i spełnił kryteria diagnostyczne zespołu HELLP. Chociaż testy genetyczne w kierunku aHUS pozostały ujemne, kliniczny przebieg choroby (zwłaszcza ciężki ostry uraz nerek) i odpowiedź na leczenie (zwłaszcza ekulizumab) sugerowały, że nasza pacjentka miała aHUS wywołany ciążą.
Dyskusja
Pierwotnego, opisanego powyżej, zdiagnozowano z ciężkim stanem przedrzucawkowym, zespołem HELLP i aHUS wywołanym ciążą. Nie wykryto żadnych znanych mutacji genów, które mogłyby predysponować do aHUS. Ważna jest diagnostyka różnicowa między typami TMA, TTP, HUS / aHUS i wtórnymi TMA, takimi jak zespół HELLP. Szczególnie TTP należy zidentyfikować wcześnie, ponieważ chorobę leczy się poprzez szybką codzienną wymianę osocza aż do remisji (15).
Obecnie metody analizy laboratoryjnej do testowania mutacji genetycznych potencjalnie wywołujących aHUS są w stanie wykazać mutacje w tylko do 40–60% przypadków aHUS, pozostawiając możliwość fałszywie ujemnych przypadków. Dlatego negatywny wynik testu na mutacje nie wyklucza prawdziwego aHUS (16).Rzadko po ciąży i porodzie wywoływano aHUS. W takich przypadkach w ciągu następnych trzech lat ~ 50% rozwinęło przewlekłą chorobę nerek (PChN), a niektóre nawet schyłkową chorobę nerek (ESKD). Gdy zaobserwowano mutacje genetyczne, nawet u 85% może rozwinąć się PChN lub ESKD (17).
Powszechnie przyjmuje się, że w zaburzeniach nadciśnieniowych ciąży zapalenie łożyska powoduje dysfunkcję śródbłonka. Naruszenie integralności śródbłonka powoduje aktywację dopełniacza i koagulację (18). Postawiono również hipotezę, że zaburzony śródbłonek matki przyczynia się do zachorowalności matek w późniejszym życiu związanej z ciężkim stanem przedrzucawkowym i innymi zaburzeniami ciąży związanymi z nadciśnieniem tętniczym (2, 19). Wykazano, że uszkodzony śródbłonek funkcjonuje nieprawidłowo nawet lata po ustąpieniu początkowych objawów diagnostycznych (20–23).
U aż 46% pacjentów z HELLP opisano mutacje genów w regulatorach szlaku alternatywnego układu dopełniacza (24, 25). We wczesnych stadiach ciąży, gdy łożysko się rozwija, u pacjentek, u których wystąpił później stan przedrzucawkowy, obserwuje się aktywację układu dopełniacza w podwyższonym stężeniu Bb w surowicy (26). Aktywację układu dopełniacza obserwowano w ciężkim stanie przedrzucawkowym i zespole HELLP, a podwyższone poziomy kompleksu końcowego (C5b-9) wykryto w moczu pacjentów z ciężkim stanem przedrzucawkowym. U pacjentów z zespołem HELLP zwiększoną aktywację układu dopełniacza wykazano w teście funkcjonalnym, a ponadto przez niedobory ekspresji w CD55 i CD59, prowadzące do zmniejszonej regulacji i nasilonej aktywacji układu dopełniacza (27–29).
Istnieje wiele podobieństw między zespołem HELLP a aHUS. W obu przypadkach wyraźnie zaangażowane są zaburzenia śródbłonka, po których następuje aktywacja dopełniacza i krzepnięcia. W ciężkim stanie przedrzucawkowym i zespole HELLP ekulizumab podawany we wczesnych objawach ciężkiej choroby i TMA byłby korzystny dla ochrony nerek i śródbłonka matki (30). Zachowanie integralności śródbłonka może potencjalnie chronić pacjenta przed długoterminowymi zagrożeniami dla zdrowia, takimi jak choroby sercowo-naczyniowe. Zazwyczaj w przypadku TMA związanych z ciążą kliniczne objawy hemolizy i trombocytopenii ustępują w ciągu ~ 3 dni. Jeśli choroba utrzymuje się dłużej, należy kontynuować diagnostykę różnicową i dopiero wtedy rozważyć alternatywne leczenie (np. Ekulizumab). Wcześniejsze wprowadzenie leczenia ekulizumabem przyniosłoby korzyści kobietom, ponieważ zapobiegałoby uszkodzeniom nerek i minimalizowało turbulencje w śródbłonku i ogólnoustrojowym zapaleniu. Ekulizumab, podany odpowiednio wcześnie i zaledwie w jednej lub dwóch dawkach, może być wystarczający, aby zatrzymać turbulencje i wystarczyć do zatrzymania kaskady zdarzeń (31). Z jednej strony ekulizumab to bardzo drogi lek, ale z drugiej nieoceniony pozostaje koszt intensywnej terapii, wymiany osocza, hemodializy, ewentualnego przeszczepu nerki, nie wspominając o konsekwencjach emocjonalnych dla matek i rodzin.
Podsumowując, nasz pacjent był ciężko chory, z hemolizą, zaburzeniami krzepnięcia, uszkodzeniem wątroby i niewydolnością nerek, wymagającą przyjęcia na OIOM i poddania hemodializie. Jest możliwe, że ekulizumab, jeśli został zainicjowany wcześniej, przy pierwszych objawach zespołu HELLP, mógł być korzystny w późniejszym przebiegu choroby, potencjalnie łagodząc uszkodzenie nerek, a tym samym zapobiegając potrzebie hemodializy, a później PChN. Dlatego w dobie współczesnej medycyny immunologicznej, czy moglibyśmy zrobić więcej dla matek i rodzin, niż tylko czekać i mieć nadzieję na najlepsze?
Oświadczenie etyczne
Ocena etyczna i aprobata nie były wymagane do badania na ludziach zgodnie z lokalnymi przepisami i wymogami instytucjonalnymi. Pacjenci / uczestnicy wyrazili pisemną zgodę na udział w tym badaniu.
Wkład autorów
AL i JH-E opracowali pomysł na rękopis i napisali manuskrypt. JH-E i MH byli zaangażowani w diagnostykę i terapię chorego. Wszyscy autorzy przejrzeli i zredagowali manuskrypt oraz zatwierdzili jego ostateczną wersję do publikacji.
Konflikt interesów
Autorzy deklarują, że badanie zostało przeprowadzone przy braku jakichkolwiek powiązań handlowych lub finansowych, można zinterpretować jako potencjalny konflikt interesów.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Niekorzystne wyniki ciąży i przyszła choroba sercowo-naczyniowa matki. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” wielkie zespoły położnicze ”są związane z zaburzeniami głębokiego łożyska. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Ogólnoustrojowa stymulacja zapalna w prawidłowej ciąży i stanie przedrzucawkowym: rola krążących mikrocząstek syncytiotrofoblastów. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Aktualizacja pęcherzyków zewnątrzkomórkowych pochodzących z syncytiotrofoblastów w prawidłowej ciąży i stanie przedrzucawkowym. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
10. Zespół Weinsteina L. hemolizy, podwyższona aktywność enzymów wątrobowych i niska liczba płytek krwi liczyć: poważne konsekwencje nadciśnienia tętniczego w ciąży. Am J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Różnicowanie między ciężkim zespołem HELLP oraz mikroangiopatia zakrzepowa, zakrzepowa plamica małopłytkowa i inne imitatory. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Upośledzenie funkcji śródbłonka u kobiet ze stanem przedrzucawkowym w wywiadzie: wskaźnik ryzyka sercowo-naczyniowego. Am J Physiol, słuchajcie Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Personel AC. Czynność śródbłonka i krążące biomarkery są zaburzone u kobiet i dzieci po stanie przedrzucawkowym. Nadciśnienie. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
23. Stanhewicz AE. Resztkowa dysfunkcja naczyniowa u kobiet ze stanem przedrzucawkowym w wywiadzie. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S i in. Mutacje zarodkowe w alternatywnym szlaku dopełniacza predysponują do zespołu HELLP. Wgląd JCI. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, nowy potencjalny sposób leczenia ostrego uszkodzenia nerek związanego ze stanem przedrzucawkowym / zespołem HELLP. Reprezentacja sprawy BMJ (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | Pełny tekst CrossRef | Google Scholar