Frontiers in Physiology (Polski)
Wprowadzenie
Baroreceptory tętnicze służą jako czujniki pierwszej linii do wykrywania zmian ciśnienia krwi w krwiobiegu. Zmiany ciśnienia krwi stymulują mechanoczułe zakończenia nerwowe zlokalizowane w ścianach tętnic. Siła mechaniczna jest przekształcana na sygnały elektryczne na zakończeniach nerwowych, co powoduje zależne od ciśnienia wyładowania potencjału czynnościowego w neuronach baroreceptorowych. Sygnały nerwowe następnie rozprzestrzeniają się do ośrodka kontroli sercowo-naczyniowej w pniu mózgu w celu regulacji ciśnienia krwi odruchowej baroreceptorem (Levy MN, 2007). Ponadto struktury nadrdzeniowe, w tym jądro klinowe śródmózgowia i brzuszna przyśrodkowa kora przedczołowa, również odgrywają rolę hamującą w regulacji odruchu baroreceptorowego (Verberne i wsp., 1997).
Istnieją dwa tętnicze baroreceptory, a mianowicie: baroreceptory aorty i baroreceptory tętnic szyjnych, zlokalizowane odpowiednio w warstwie przydanki łuku aorty i tętnic szyjnych. Baroreceptory aortalne wykrywają ciśnienie krwi w aorcie. Ciała komórkowe (soma) baroreceptorów aorty są zlokalizowane w zwoju guzowatym (NG) (ryc. 1). Sygnały nerwowe z zakończeń nerwowych baroreceptorów aorty są przekazywane do zwoju węzłowego przez nerw czuciowy zwany nerwem depresyjnym aorty (ADN) (ryc. 1). Baroreceptory szyjne wykrywają ciśnienie krwi w tętnicy szyjnej, która dostarcza krew do mózgu. Końcówki nerwowe baroreceptorów szyjnych znajdują się obustronnie przy rozwidleniach tętnic szyjnych, w pobliżu tętnicy szyjnej wewnętrznej. Sygnały nerwowe z baroreceptorów szyjnych wędrują wzdłuż nerwów zatoki szyjnej (CSN) do ich somy zlokalizowanej w zwoju skroniowym (PG). Ganglion Petrosal wystaje poza otwór szyjny (ryc.1) (McDonald, 1983; Shoukas i wsp., 1991; Vander i wsp., 1998; Sato i wsp., 1999; Donnelly i Rigual, 2000; Weijnen i wsp., 2000) . Ponieważ baroreceptory aortalne wyczuwają ciśnienie krwi w aorcie, która dostarcza krew do całego krążenia ogólnoustrojowego, oczekuje się, że te baroreceptory odgrywają ważną rolę funkcjonalną w utrzymaniu ogólnego systemowego ciśnienia krwi. Z drugiej strony, baroreceptory tętnicy szyjnej wykrywają ciśnienie krwi dostarczanej do mózgu. Te baroreceptory mogą być ważniejsze dla utrzymania stabilnego mózgowego ciśnienia krwi i mózgowego przepływu krwi.
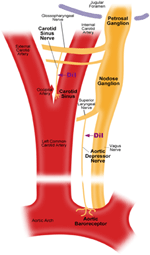
Rycina 1. Schematyczny diagram końcówek i nerwów baroreceptorów aorty i tętnicy szyjnej. Schemat przedstawiający anatomiczne położenie zakończeń nerwowych baroreceptorów aorty i tętnicy szyjnej, ich włókien nerwowych i okolic somaty. Końcówki baroreceptorów aorty znajdują się w łuku aorty. Jego doprowadzające włókno nerwowe jest nerwem depresyjnym aorty. Soma znajduje się w zwoju guzowatym (NG). Baroreceptor szyjny umieszczony jest w tętnicy szyjnej wewnętrznej obok rozwidlenia tętnicy szyjnej. Jej nerw doprowadzający to nerw zatoki szyjnej. Soma znajduje się w zwoju skalistym (PG).
Istnieją sprzeczne doniesienia o tym, które baroreceptory, baroreceptory aorty lub tętnica szyjna baroreceptory są bardziej wrażliwe na zmiany ciśnienia krwi. Niektórzy badacze podali, że baroreceptory tętnicy szyjnej są bardziej wrażliwe na ciśnienie (Donald i Edis, 1971; Fadel i wsp., 2003), podczas gdy inni uważają, że baroreceptory aorty są bardziej wrażliwe na ciśnienie (Glick i Covell, 1968; Pickering i wsp., 2008), a jeszcze inni nie odnotowali różnicy w wrażliwości na ciśnienie między tymi dwoma baroreceptorami (Hainswor i wsp., 1970; James i Daly, 1970). Jednak w prawie wszystkich tych wcześniejszych badaniach jako punkty końcowe testu wrażliwości na baroreceptory stosowano tylko reakcje odruchu z baroreceptorów (takie jak częstość akcji serca i aktywność nerkowego nerwu współczulnego). Nadal nie ma badań, które bezpośrednio rejestrują i porównują wrażliwość na ciśnienie neuronów baroreceptorów aorty i tętnicy szyjnej per se.
Tutaj zastosowaliśmy zacisk ciśnieniowy o dużej prędkości, aby zmienić ciśnienie hydrostatyczne wewnątrz neuronów baroreceptora i odpowiadające odpowiedzi elektrofizjologiczne tych neuronów przez zaciskanie całych komórek. Zastosowaliśmy również jednoosiową komorę rozciągającą do rozciągnięcia neuronów baroreceptorowych i zmierzyliśmy odpowiednie zmiany w cytozolowym Ca2 + w tych neuronach. Ponadto w badaniach na zwierzętach in vivo mierzyliśmy wywołane ciśnieniem wyładowania potencjału czynnościowego w nerwach zatoki aortalnej i szyjnej, które są odpowiednio nerwami czuciowymi baroreceptorów aorty i tętnicy szyjnej.
Materiały i metody
Zwierzęta
Wszystkie doświadczenia na zwierzętach były przeprowadzane na podstawie licencji wydanej przez rząd Hongkongu SRA i zgody Komisji ds. Etyki Eksperymentów na Zwierzętach, Chińskiego Uniwersytetu w Hongkongu.Samce szczurów Sprague-Dawley (S / D) (180–200 g) zostały dostarczone przez Laboratory Animal Services Centre na Chińskim Uniwersytecie w Hongkongu.
Kultura pierwotna
S / D szczury znieczulono pentobarbitalem sodu (100 mg / kg). Lewy obszar szyjki odsłonięto przez nacięcie w linii środkowej w warunkach sterylnych. Jak pokazano na rycinie 1, odsłonięto nerw depresyjny aorty lub nerw zatoki szyjnej i ostrożnie oddzielono 2–3 mm nerwu od otaczających tkanek poprzez preparowanie na tępo. Wokół nerwu nałożono fluorescencyjny lipofilowy znacznik 1,1-dioktadecylo-3,3,3 ′, 3′-tetrametyloindokarbocyjaniny (DiI) kryształy (Invitrogen) i pokryto je Kwik-Sil (World Precision Instruments, USA). Następnie nacięcie zszyto. Szczurom pozwolono wyzdrowieć przez 5-7 dni, aby umożliwić wsteczną dyfuzję barwnika DiI wzdłuż nerwu depresyjnego aorty lub nerwu zatoki szyjnej do somaty zlokalizowanej odpowiednio w zwoju węzłowym lub w zwoju skalistym.
Guz lub zwój skroniowy neurony izolowano od szczurów wyznakowanych DiI i pocięto na kawałki w lodowatym EBSS. Poddawano je trawieniu przez 1 godzinę w 37 ° C trypsyną (1 mg / ml) i kolagenazą IA (1 mg / ml). Pojedyncze neurony rozproszono przez delikatne rozcieranie pipetą Glass Pasteur, a następnie wirowanie. Neurony ponownie zawieszono i hodowano w pożywce DMEM / F-12 uzupełnionej 5% FBS, 1% antybiotykiem przeciwgrzybiczym i 7S NGF (100 ng / ml). Pożywka hodowlana zawierała arabinofuranozyd cytozyny (Ara-C; 10 μM) w celu zahamowania wzrostu dzielących się komórek. Neurony hodowano przez co najmniej 3 dni przed eksperymentami. W celu rejestracji potencjału czynnościowego neurony świeżo izolowano i inkubowano w F12 co najmniej 30 minut przed eksperymentami. We wszystkich eksperymentach komórki inkubowano na szkiełkach pokrytych wstępnie 0,1 mg / ml poli-L-lizyny, z wyjątkiem eksperymentów z rozciąganiem komórek, w których komory silikonowe były wstępnie powlekane 2% żelatyną.
Patch Clamp
Zapis cęgów prądowych w całej komórce uzyskano za pomocą wzmacniacza patch clamp EPC7 (HEKA, Niemcy). Pipety łatkowe o oporności 3–5 MΩ wypełniono roztworem pipety (w mM): 130 K-glukonian, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 przez KOH. Komórki kąpano w sztucznym płynie mózgowo-rdzeniowym (ACSF) (w mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glukozy, zrównoważone karbogenem (95% O2 i 5 % CO2). Podczas rejestracji prądu stałego komórki były utrzymywane na spoczynkowym potencjale błony. Zastosowano szybki system zaciskania ciśnieniowego (HSPC-1, ALA Scientific Instruments, USA) w celu zapewnienia dodatniego ciśnienia do komórki za pomocą mikropipety. Nagrania próbkowano przy 50 kHz i filtrowano przy 5 kHz. Dane analizowano za pomocą PulseFit (HEKA). Wszystkie eksperymenty przeprowadzono w temperaturze pokojowej.
Obrazowanie wapnia
Pomiar cytosolowego Ca2 + przeprowadzono zgodnie z opisem w innym miejscu (Wong i in., 2010). W skrócie, komórki ładowano 5 µM Fluo-4 / AM przez 40 min. Pomiar cytosolowego Ca2 + przeprowadzono za pomocą roztworu buforowanego HEPES (w mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2, 10 HEPES, 10 glukozy, pH 7,4 naOH. Zmianę cytozolowego Ca2 + w odpowiedzi na jednoosiowe rozciąganie przeprowadzono za pomocą STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Komórki stymulowano przez 10, 20 lub 30% jednokierunkowego rozciągania przez 1 sekundę. Odpowiedź cytozolowego Ca2 + mierzono w temperaturze pokojowej. Fluo-4 fluorescencję rejestrowano i analizowano za pomocą skanującego laserowego systemu obrazowania konfokalnego FV1000. Zmiana odpowiedzi cytozolowej na fluorescencję Ca2 + została wyrażona jako stosunek (Fx / F0) fluorescencji w czasie rzeczywistym, gdzie Fx to sygnał fluo-4 / AM w czasie rzeczywistym, a F0 to podstawowy sygnał fluo-4 / AM przed rozciągnięciem.
Rejestracja aktywności nerwów
Szczury znieczulono 100 mg / kg pentobarbitalu sodu. Obszar szyjki odsłonięto przez nacięcie w linii środkowej. Wyizolowano prawą tętnicę szyjną i wprowadzono kaniulę za pomocą cewnika podłączonego do przetwornika ciśnienia (ML221, ADInstruments, USA) w celu rejestracji ciśnienia krwi. Do lewej żyły udowej wprowadzono kaniulę do wstrzyknięć fenylefryny i SNP. Lewy nerw depresorowy aorty lub nerw zatoki szyjnej podłączono do dwubiegunowej elektrody srebrnej, a następnie do wzmacniacza (model 1700 Differential AC Amplifier, A-M Systems Inc., USA). Zarówno ciśnienie krwi, jak i aktywność nerwów były w sposób ciągły rejestrowane przez Wykres 5.0 (AD Instruments). Aktywność nerwów została wzmocniona 10 000 razy i przefiltrowana w paśmie 100–5000 Hz. Wartości średniego ciśnienia tętniczego, tętna i częstości skoków w odpowiedzi na fenylefrynę analizowano za pomocą oprogramowania Chart 5.0. Obliczono zmianę częstości skoków (częstość skoków po fenylefrynie – częstość skoków przed fenylefryną) w odpowiedzi na maksymalną zmianę ciśnienia krwi (średnie ciśnienie tętnicze krwi po podaniu fenylefryny – średnie ciśnienie tętnicze krwi przed fenylefryną) po wstrzyknięciu fenylefryny (Lau i wsp., 2016) .
Analiza statystyczna
Reprezentatywne ślady wykreślono jako ślady przebiegu w czasie. Dane ze wszystkich eksperymentów podsumowano na wykresie słupkowym, który wyrażono jako średnią ± sem poszczególnych eksperymentów. Do analizy statystycznej zastosowano test t Studenta. Tam, gdzie było to właściwe, zastosowano parowy test t-Studenta.
Wyniki
Właściwości neuronów obniżających ciśnienie aorty i neuronów zatoki szyjnej
Dil zastosowano do nerwu depresorowego aorty lub nerwu zatoki szyjnej. Dlatego też neurony znakowane Dil w zwoju węzłowym obejmowały neurony baroreceptorowe unerwiające łuk aorty i neurony chemoreceptorowe unerwiające ciało aorty. Z drugiej strony, neurony znakowane Dil w zwojów skalistych obejmowały neurony baroreceptorowe unerwiające zatokę szyjną i neurony chemoreceptorowe unerwiające ciało szyjne. Najpierw zbadaliśmy podstawowe właściwości tych neuronów znakowanych Dil. Neurony znakowane diI w węzłach nerwowych i zwojach skalistych hodowano oddzielnie i poddawano depolaryzującemu prądowi elektrycznemu jako pokazane na rysunku 2. Zarejestrowano dwa rodzaje odpowiedzi, jeden odpowiadał pojedynczym potencjałem czynnościowym, a drugi ciągłym potencjałem czynnościowym po prądzie depolaryzującym (ryc. 2) (Belmonte i Gallego, 1983). Te neurony następnie poddano protokołowi ciśnienia hydrostatycznego w celu zbadania ich wrażliwości na zmiany ciśnienia hydrostatycznego. Dodatni wzrost ciśnienia hydrostatycznego wprowadzano wewnątrzkomórkowo przez szklaną mikropipetę za pomocą szybkiego systemu dociskowego (HSPC-1, ALA Scientific Instruments, USA), aż do wywołania potencjałów czynnościowych. Wyniki pokazały, że 45% neuronów baroreceptorów aorty wyzwala ciągłe potencjały czynnościowe w odpowiedzi na depolaryzujący prąd elektryczny (Tabela 1A). Spośród nich 91% (41% / 45%) również zareagowało na zmianę ciśnienia hydrostatycznego i wykazało odpalenia z potencjałem czynnościowym zależnym od ciśnienia (Tabela 1A). Pozostałe 55% neuronów baroreceptorów aorty wyemitowało tylko jeden potencjał czynnościowy w odpowiedzi na prąd depolaryzujący (Tabela 1A), a wśród nich 40% (22% / 55%) mogło zareagować na zmianę ciśnienia (Tabela 1A). W przypadku neuronów baroreceptorów tętnicy szyjnej 45% komórek dawało ciągłe potencjały czynnościowe, gdy były stymulowane przez prąd depolaryzujący (Tabela 1B). Wśród nich 82% (37% / 45%) było również wrażliwych na zmianę ciśnienia (tab. 1B). Ponadto wśród neuronów baroreceptorów tętnicy szyjnej, które w odpowiedzi na prąd depolaryzujący wyemitowały tylko jeden potencjał czynnościowy, 24% (13% / 55%) mogło odpowiedzieć na zmianę ciśnienia (Tabela 1B).
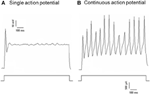
Rycina 2. Rejestracja potencjału czynnościowego z hodowanych neuronów depresora aorty i zatoki szyjnej. Pokazane są ślady potencjałów czynnościowych, które zostały zarejestrowane z dwóch reprezentatywnych neuronów depresora aorty / zatoki szyjnej pod wpływem prądu depolaryzującego. (A) Reprezentatywne neurony, które wyzwalają tylko jeden potencjał czynnościowy podczas aktualnej stymulacji; (B) Reprezentatywne neurony, które podczas bieżącej stymulacji wyzwalają tylko ciągłe potencjały czynnościowe. Dolny panel: protokół do wstrzykiwania prądu. Pasek skali, poziomy, 100 ms, pionowy, 10 mV (górne wykresy) i 500 pA (dolne wykresy). n = 27 in = 38 odpowiednio dla neuronów depresora aorty i zatoki szyjnej.

Tabela 1. Właściwości neuronów depresora aorty i zatoki szyjnej.
Niezależnie od tego, czy wyzwalali pojedynczy potencjał czynnościowy, czy ciągły, 63% neuronów baroreceptorów aorty znakowanych Dil było wrażliwych na zmianę ciśnienia, podczas gdy tylko 50% neuronów baroreceptorów tętnic szyjnych znakowanych Dil było wrażliwych na zmiana ciśnienia (Tabela 1).
Wrażliwość na rozciąganie neuronów baroreceptorów aorty i tętnicy szyjnej
Przeanalizowano próg ciśnienia dla wyładowania potencjału czynnościowego. Jak pokazano na rycinie 3, neurony baroreceptorów aorty miały niższy próg ciśnienia (24 ± 4 mmHg) niż neurony baroreceptorów tętnicy szyjnej (39 ± 4 mmHg).

Rysunek 3. Wrażliwość neuronów baroreceptorów aorty i tętnicy szyjnej na ciśnienie hydrostatyczne. (A, B) Panel górny, reprezentatywne przebiegi czasowe ilustrujące zależne od ciśnienia wyładowania potencjału czynnościowego w neuronach baroreceptorów aorty (A) i tętnicy szyjnej (B). Rampę nacisku (dolny panel) zastosowano do wnętrza komórek za pomocą mikropipety przy użyciu szybkiego systemu docisku (HSPC). Skala pozioma, 1 s, pionowa, 20 mV i 20 mmHg. (C) Podsumowanie pokazujące próg ciśnienia, który inicjuje wyładowania potencjału czynnościowego w neuronach baroreceptorów aorty i tętnicy szyjnej. n = 13 dla neuronów baroreceptorowych aorty in = 15 dla neuronów baroreceptorów tętnicy szyjnej. *** p < 0,01, według testu t Studenta.
Odpowiedź Ca2 + indukowana rozciąganiem w neuronach baroreceptorowych
Hodowane neurony depresora aorty lub zatoki szyjnej poddano 10, 20 lub 30% jednoosiowego rozciągnięcia przez STREX Cell Stretching System, próbując naśladować rozciąganie naczynia krwionośnego pod ciśnieniem krwi. Wyniki pokazały, że jednoosiowe rozciągnięcie o 20% indukowało wyraźny wzrost fluorescencji cytozolowego Ca2 + w neuronach baroreceptorów aorty, ale nie w neuronach baroreceptorów tętnicy szyjnej (ryc. 4A – C). Co więcej, wielkość wzrostu fluorescencji Ca2 + w odpowiedzi na 30% jednoosiowe rozciągnięcie była znacznie większa w neuronach baroreceptorów aorty niż w neuronach baroreceptorów tętnicy szyjnej (ryc. 4A – C).
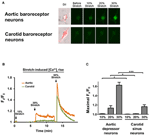
Rysunek 4. Wrażliwość neuronów depresora aorty i zatoki szyjnej na rozciąganie jednoosiowe. Komórki obciążono czułym na Ca2 + barwnikiem fluorescencyjnym Fluo-4 / AM. Przedstawione są reprezentatywne obrazy (A) i ślady w czasie (B) względnych wzrostów cytozolowego Ca2 + w odpowiedzi na jednoosiowe rozciągnięcie 10, 20 i 30% długości komórek w neuronach depresora aorty i zatoki szyjnej. (C) Podsumowanie maksymalnego wzrostu cytozolowego Ca2 + w odpowiedzi na różny stopień rozciągnięcia. Zmiana w cytozolowym Ca2 + została wyrażona jako Fx / F0, gdzie Fx to sygnał fluo-4 / AM w czasie rzeczywistym, a F0 to podstawowy sygnał fluo-4 / AM przed rozciągnięciem. Średnia ± s.e.m. (n = 5). * p < 0,05, *** p < 0,01 w porównaniu z odpowiednią kontrolą za pomocą parowego testu t.
Aktywność baroreceptorów in vivo
Aktywność nerwów dwóch baroreceptorów badano in vivo. Fenylefrynę wstrzyknięto dożylnie. Zmiany ciśnienia krwi po zastosowaniu fenylefryny pokazano w górnym panelu rycin 5A, B. Zmiany podsekwencji w aktywności nerwów baroreceptorowych przedstawiono w dolnym panelu (ryc. 5A, B). Aktywność nerwu wywołana uciskiem była znacznie wyższa w nerwie depresyjnym aorty niż w nerwie zatoki szyjnej (ryc. 5A, B). Zmianę częstości skoków na wzrost mmHg podsumowano na Rysunku 5C. Wynik wskazał, że baroreceptory aorty są bardziej wrażliwe na ciśnienie hydrostatyczne niż baroreceptory tętnicy szyjnej in vivo.
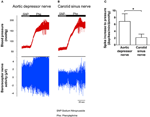
Rysunek 5. Aktywność nerwów baroreceptorowych u szczurów in vivo. (A, B) Reprezentatywne ślady pokazujące zmianę aktywności nerwu depresyjnego aorty (A) i nerwu zatoki szyjnej (B) po podwyższeniu ciśnienia krwi. W obu (A, B) górnym panelu była zmiana ciśnienia krwi przed i po podaniu Phe, co zaznaczono poziomymi słupkami. Dolny panel był odpowiednią zmianą aktywności nerwów. (C) Podsumowanie danych pokazujących zmianę aktywności nerwów na jednostkę zmiany ciśnienia krwi. Średnia ± s.e.m. (n = 8). * p < 0,05 w porównaniu z kontrolą w baroreceptorach aorty, za pomocą parowego testu t.
Ekspresja kanałów TRP
Zgłoszono, że kilka kanałów TRP jest wrażliwych na mechanizmy, w tym TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O „Neil i Heller, 2005; Christensen i Corey, 2007; Pedersen i Nilius, 2007; Patel i wsp., 2010; Lau i wsp., 2016). W tym miejscu zbadaliśmy możliwą rolę tych mechanoczułych kanałów TRP w odniesieniu do aorty i wrażliwości baroreceptorów tętnicy szyjnej. ekspresja kanałów wrażliwych na mechanizmy w zwoju węzłowym może przyczyniać się do wyższej czułości.
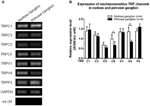
Rysunek 6. Wyrażenie mechanoczułe kanały TRP w zwoju guzowatym i skroniowym. (A) Reprezentatywne obrazy żelu porównujące poziom ekspresji mRNA mechanoczułych kanałów TRP (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) między neuronami węzłowymi i skalistymi. Do porównania poziomów ekspresji mRNA kilku kanałów TRP w stosunku do ekspresji mRNA GAPDH zastosowano półilościową analizę RT-PCR. Wyniki 9 eksperymentów podsumowano w (B). Wartości były średnie ± sem. * p < 0,05, za pomocą parowego testu t.
Dyskusja
W niniejszym badaniu porównano właściwości mechanoczułe baroreceptorów aorty i tętnicy szyjnej. Badania płatkowe całokomórkowe wykazały, że w porównaniu z neuronami zatoki szyjnej wyższy odsetek neuronów depresyjnych aorty wykazywał wrażliwość na rozciąganie. Ponadto stwierdzono, że próg ciśnienia, który może zapoczątkować wyładowania potencjału czynnościowego, jest niższy w neuronach baroreceptorowych aorty niż w neuronach baroreceptorów tętnicy szyjnej. Wzrost cytozolu Ca2 + indukowany jednoosiowym rozciąganiem był również porównywany między neuronami depresora aorty i neuronów zatoki szyjnej.Wielkość wzrostu cytozolowego Ca2 + w odpowiedzi na jednoosiowe rozciągnięcie była znacznie większa w neuronach baroreceptorów aorty niż w neuronach baroreceptorów tętnicy szyjnej. Neurony baroreceptorowe aorty również wykazywały niższy próg cytozolowych odpowiedzi Ca2 + na jednoosiowe rozciągnięcie. W innej serii eksperymentów odkryliśmy, że wywołany ciśnieniem wzrost wyładowań potencjału czynnościowego był większy w nerwie depresyjnym aorty niż w nerwie zatoki szyjnej. Podsumowując, nasze dane dostarczają mocnych dowodów na to, że baroreceptory aorty są bardziej wrażliwe na ciśnienie krwi niż baroreceptory tętnicy szyjnej.
Wcześniej podjęto wiele wysiłków, aby zrozumieć różnicę we wrażliwości między dwoma baroreceptorami. Jednak wyniki są kontrowersyjne. W niektórych raportach stwierdzono, że baroreceptory aorty są bardziej wrażliwe na zmianę ciśnienia (Glick i Covell, 1968; Fan i in., 1996; Pickering i in., 2008), podczas gdy inne stwierdzały, że baroreceptory tętnicy szyjnej są bardziej wrażliwe na zmianę ciśnienia (Donald i Edis, 1971; Fadel i wsp., 2003). Jednak prawie wszystkie z tych wcześniejszych badań obejmowały wysoce skomplikowane procedury chirurgiczne i ostatecznie wykorzystywały reakcje baroreceptorowe, takie jak częstość akcji serca i pojemność współczulna nerek, jako punkty końcowe testu wrażliwości baroreceptorów. Skomplikowane zabiegi chirurgiczne są podatne na wprowadzanie błędów eksperymentalnych, co może skutkować kontrowersyjnymi wnioskami. Ponadto możliwa jest również zmienność wrażliwości na baroreceptory zależna od gatunku zwierzęcia. Co więcej, na odpowiedź odruchową z baroreceptorów wpływa nie tylko wrażliwość na baroreceptory, ale także wiele innych czynników, w tym przewodnictwo nerwowe, pośrednictwo ośrodkowe, kurczliwość naczyń krwionośnych i czynność serca. Dlatego dowody z poprzednich badań są pośrednie i mało idealne. Do chwili obecnej brak jest bezpośrednich badań porównujących wrażliwość neuronów baroreceptorowych na ciśnienie aorty i tętnicy szyjnej. W tym badaniu wrażliwość mechaniczna była badana bezpośrednio w neuronach baroreceptorowych. Dane zdecydowanie sugerują, że baroreceptory aorty są bardziej wrażliwe na ciśnienie niż baroreceptory tętnicy szyjnej. Ta informacja może mieć ważne fizjologiczne znaczenie w regulacji ciśnienia krwi.
Nie jest jasne, jakie mechanizmy leżą u podstaw różnicy wrażliwości na ciśnienie między baroreceptorami aortalnymi i szyjnymi. Porównaliśmy poziom ekspresji kilku mechanoczułych kanałów TRP (Rysunek 6) (O „Neil i Heller, 2005; Christensen i Corey, 2007; Pedersen i Nilius, 2007; Patel i wsp., 2010). Nasze wyniki wykazały, że neurony baroreceptorowe aorty mają wyższą ekspresję kilku mechanoczułych kanałów TRP, w tym TRPV4 i TRPC6. Jest możliwe, że wyższa ekspresja TRPV4 i / lub TRPC6 może przyczyniać się do wrażliwości baroreceptorów aorty na wysokie ciśnienie. Konieczne są dalsze badania w celu zweryfikowania roli tych kanałów jonowych.
Wcześniej donoszono, że zwoje guzowate i zwojowe skaliste zawierają dwa różne typy neuronów (Belmonte i Gallego, 1983). Jeden z nich daje ciągłe potencjały czynnościowe po stymulacji elektrycznej, podczas gdy drugi daje tylko pojedyncze działanie potencjał po stymulacji. Autorzy przypisali pierwszy jako neurony wrażliwe na nacisk, a drugi jako neurony chemo-wrażliwe. Nasze wyniki wskazują, że może to nie być odpowiednie te, aby przypisać neurony wrażliwe na nacisk i neurony niewrażliwe na nacisk tylko na podstawie tego, czy wystrzeliwują pojedynczy potencjał czynnościowy, czy ciągłe potencjały czynnościowe w odpowiedzi na prąd depolaryzujący. W rzeczywistości duży procent komórek, które wyzwalają pojedynczy potencjał czynnościowy w odpowiedzi na stymulację elektryczną, jest również wrażliwych na ciśnienie, a zatem należą do neuronów baroreceptorowych wykrywających ciśnienie (Rysunek 2 i Tabela 1).
Podsumowując, niniejsze badanie dostarcza dowodów, że baroreceptory aorty są bardziej wrażliwe na ciśnienie niż baroreceptory tętnicy szyjnej i dodaje nowe informacje do zrozumienia podstawowej fizjologii.
Wkład autorów
EL i XY projektują eksperymenty i przygotowują rękopis. EL, CL i YY wykonują eksperymenty. XY, YH, AM i LJ poprawiły rękopis. Wszyscy autorzy zatwierdzili ostateczną wersję manuskryptu.
Finansowanie
Praca została wsparta grantami z Hong Kong Research Grant Committee CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, grant China National Science Foundation 31470912 i wspólny grant RGC-NSFC N_CUHK439 / 13.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które można by zinterpretować jako potencjalny konflikt interesów.
James, JEA i Daly, MDB (1970). Porównanie odruchowych odpowiedzi naczynioruchowych na oddzielną i połączoną stymulację baroreceptorów zatoki szyjnej i łuku aorty przez pulsacyjne i nie pulsacyjne ciśnienie u psów. J. Physiol. 209, 257–293. doi: 10,1113 / jphysiol.1970.sp009165
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
Levy MN, P. A. (2007). Fizjologia układu sercowo-naczyniowego. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H., and Luciano, D. S. (1998). Fizjologia człowieka: mechanizm funkcjonowania ciała. Boston, MA: WCB McGraw-Hill.