Granice w mikrobiologii komórkowej i zakażeń
Wprowadzenie
Staphylococcus aureus to ważny ludzki patogen izolowany od hospitalizowanych pacjentów na całym świecie, który powoduje zarówno zakażenia szpitalne, jak i pozaszpitalne ( Lowy, 1998). Ten patogen jest czynnikiem etiologicznym kilku różnych infekcji ogólnoustrojowych, wpływających na skórę i tkanki miękkie, a także na układ mięśniowo-szkieletowy i układ krążenia (Lowy, 1998; Changchien i in., 2016). Donoszono, że S. aureus może przeżyć w makrofagach pochodzących z ludzkich monocytów (Kubica i in., 2008). Zjadliwość S. aureus jest ściśle związana z różnymi wydzielanymi enzymami i toksynami wytwarzanymi przez bakterie (Otto, 2014). Hemolizyna, leukocydyna (leukocydyna Panton-Valentine, PVL) i toksyna-1 zespołu wstrząsu toksycznego (TSST-1), ułatwiające uszkodzenie błony krwinek czerwonych, uszkadzające funkcję fagocytarną leukocytów i wywołujące odpowiednio zespół wstrząsu toksycznego, są krytyczne dla procesy chorobotwórcze S. aureus (Löffler i in., 2010; Vandenesch i in., 2012; Berube i Bubeck Wardenburg, 2013; Andrey i in., 2015; Al Laham i in., 2015). Niedawne badania wykazały, że hemolizyna również uczestniczy w tworzeniu biofilmu S. aureus (den Reijer et al., 2016). Rosnąca częstość występowania szczepów S. aureus opornych na wiele leków w środowiskach szpitalnych i środowiskowych dodatkowo zwiększa ryzyko S. aureus i stanowi poważne wyzwanie dla terapii klinicznej (Voss i Doebbeling, 1995; Evangelista Sde i de Oliveira, 2015).
Ostatnio w naszym szpitalu wykryto szereg szczepów należących do klasy S. aureus z niekompletnym fenotypem hemolitycznym (SIHP). Hemoliza wywołana przez te szczepy SIHP znacznie różni się od pełnego pierścienia hemolitycznego (fenotyp β-hemolityczny) wytwarzanego przez inne szczepy S. aureus. Jednak te szczepy SIHP nie zostały jeszcze zidentyfikowane i kompleksowo scharakteryzowane. Aby zbadać cechy mikrobiologiczne tych szczepów SIHP, zebraliśmy 60 szczepów SIHP i zbadaliśmy je przy użyciu wielu kryteriów, w tym fenotypu hemolitycznego, ekspresji genu hemolizyny, cech lekooporności i zjadliwości. To badanie pokazuje, że SIHP są szczepami opornymi na metycylinę, które wykazują wysoką ekspresję β-hemolizyny i mają wysoki potencjał zjadliwości.
Materiały i metody
Szczepy bakteryjne
Sześćdziesiąt SIHP szczepy izolowano od pacjentów przyjętych do drugiego szpitala stowarzyszonego Uniwersytetu w Soochow w latach 2013–2015. Do analizy pobrano po dwie próbki od każdego pacjenta. Te izolaty następnie hodowano na płytkach agarowych Columbia z krwią owczą (CHROMagar Company, Szanghaj, Chiny) w 35 ° C w atmosferze zawierającej 5% CO2 (obj./obj.). Tożsamość szczepów jako S. aureus potwierdzono za pomocą automatycznego systemu mikrobiologicznego Phoenix-100 (Becton, Dickinson and Company, USA). Kontrolne szczepy S. aureus, z całkowitym fenotypem hemolitycznym, zostały wyizolowane od pacjentów w naszym szpitalu w tym samym okresie. Tutaj S. aureus z pełnym fenotypem hemolitycznym nazwano szczepami SCHP. Szczep referencyjny S. aureus ATCC25923 (Shanghai Center for Clinical Laboratory, Chiny) ma pełny fenotyp hemolityczny i działał również jako szczep kontrolny. Komisja Etyki Lekarskiej Drugiego Szpitala Stowarzyszonego Uniwersytetu w Soochow zatwierdziła to badanie i wszystkie izolaty zostały zebrane za zgodą pacjenta w tym badaniu.
Analizy porównawcze niepełnego fenotypu hemolitycznego
S. aureus szczepy hodowano na komercyjnych płytkach agarowych z krwią różnych firm (CHROMagar, Autobio Diagnostics Co., Ltd., Chiny i BioMérieux, Chiny), jak również na samodzielnie przygotowanych płytkach agarowych z krwią owczą przy użyciu proszku Columbia z agarem z krwią (OXIDE, Wielka Brytania). Bakterie hodowano w 35 ° C w atmosferze zawierającej 5% CO2 (obj./obj.) Przez 24 godziny, a następnie poddawano seryjnemu pasażowaniu. Następnie zaobserwowano zjawisko hemolityczne. Izolowane klinicznie szczepy z całkowitym fenotypem hemolitycznym i szczep referencyjny ATCC25923 były również obserwowane jako kontrola dla analiz porównawczych.
Określenie poziomów mRNA czterech genów hemolizyny S. aureus przy użyciu odwrotnej transkrypcji w czasie rzeczywistym ilościowo PCR (qPCR)
Ekstrakcję całkowitego RNA z SIHP i szczepu odniesienia ATCC25923 przeprowadzono zgodnie z wcześniejszym opisem (Qin i wsp., 2014). Początkowo komórki poddano lizie za pomocą lizostafiny, lizozymu i proteinazy K. RNA następnie ekstrahowano i oczyszczano przy użyciu zestawu RNeasy Mini Kit (Qiagen) zgodnie z protokołem zalecanym przez producenta. Jakość i stężenie RNA oceniano za pomocą NanoDrop1000. RNA następnie odwracano. transkrypcji na cDNA przy użyciu zestawu do odwrotnej transkrypcji (Thermo Fisher Scientific Inc., USA) zgodnie z instrukcjami producenta.W skrócie qPCR przeprowadzono w następujący sposób: wstępna denaturacja w 94 ° C przez 3 min, denaturacja w 94 ° C przez 30 s, wyżarzanie w 52 ° C przez 30 s, wydłużanie w 72 ° C przez 40 s, łącznie 45 cykli . Każda próbka miała trzy techniczne i trzy biologiczne powtórzenia. Profil transkrypcyjny każdego z czterech genów hemolizyny i genu 16s rRNA określono metodą 2 − ΔΔCt. Poziom transkrypcji określono w stosunku do ekspresji genu 16s rRNA. Sekwencje czterech genów hemolizyny (hla, hlb, hlgC i hld) pobrano z bazy danych GenBank. Do zaprojektowania starterów zastosowano oprogramowanie Primer 5.0 (Tabela 1), a startery te zostały zsyntetyzowane przez Sangon Biotech Co., Ltd. (Szanghaj, Chiny).
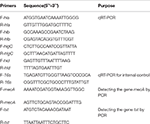
Tabela 1. Startery użyte w tym badaniu.
Do analizy danych wykorzystano SPSS 17.0. Dane pomiarowe przedstawiono jako x̄ ± s. Do porównania względnej ekspresji każdego z czterech genów hemolizyny zastosowano test T dla dwóch niezależnych próbek. Istotność statystyczną zdefiniowano jako p < 0,05.
Wykrywanie ekspresji α-hemolizyny (Hla) metodą Western Blot
Stężenie SIHP i szczep referencyjny S. aureus ATCC25923 dostosowano do 5,0 McFarland za pomocą miernika mętności. Następnie z każdej próbki wyekstrahowano białko całkowite, doprowadzono do tego samego stężenia i poddano elektroforezie na żelu SDS-PAGE. Następnie białka przeniesiono na membranę nitrocelulozową i membranę zablokowano 5% odtłuszczonym mlekiem na 1 godzinę. Dodano kozie przeciwciała poliklonalne przeciwko gronkowcowi a-hemolizyny (Abcam) w końcowym stężeniu 2 µg / ml. Następnie mieszaninę reakcyjną inkubowano w 4 ° C przez noc. Po przemyciu membrany dodano rozcieńczone 1: 1000 znakowane HRP królicze przeciwciała przeciwko kozie IgG i inkubowano w 37 ° C przez 2 godziny. Na koniec dodano substraty chemiluminescencyjne w celu wywołania koloru. Ostatecznie ekspresję α-hemolizyny obserwowano pod obrazem.
Badanie wrażliwości na środki przeciwdrobnoustrojowe SIHP
Do przeprowadzenia skriningu wrażliwości na środki przeciwdrobnoustrojowe zastosowano metodę rozcieńczania bulionu mikrotitracyjnego. Procedura została wykonana zgodnie z instrukcją obsługi zautomatyzowanego systemu mikrobiologicznego Phoenix-100. Wyniki tego badania zostały zinterpretowane przy użyciu kryteriów M100-S24 wprowadzonych przez Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). Status S. aureus opornego na metycylinę (MRSA) określono za pomocą MIC (minimalne stężenie hamujące) dwóch antybiotyków. Dla szczepów SIHP ≥4 μg / ml było MIC dla oksalicyny, a ≥8 μg / ml było MIC dla cefoksytyny.
Wykrywanie genów mecA i tst
Wszystkie 60 SIHP szczepy testowano pod kątem genu lekooporności mecA i genu wirulencji tst. Ekstrakcję wrzenia genomowego DNA przeprowadzono po lizie komórkowej przy użyciu lizostafiny. Następnie geny mecA i tst amplifikowano z genomowego DNA przy użyciu zestawu DreamGreen Taq. Warunki PCR były następujące: wstępna denaturacja w 94 ° C przez 3 min, denaturacja w 94 ° C przez 30 s, przyłączanie w 50 ° C przez 30 s, wydłużanie w 72 ° C przez 1 min. Produkty PCR sekwencjonowano i analizowano za pomocą BLAST, aby potwierdzić, że są oczekiwanymi produktami. Sekwencje genu lekooporności mecA i genu wirulencji tst S. aureus pobrano z bazy danych GenBank. Do zaprojektowania starterów zastosowano oprogramowanie Primer 5.0 (Tabela 1), a startery te zostały zsyntetyzowane przez Sangon Biotech Co., Ltd. (Szanghaj, Chiny).
Detection of the Survival of S. aureus SIHP Strains in Makrofagi
Aby porównać przeżywalność szczepów S. aureus SIHP w makrofagach z przeżywalnością tst ujemnych szczepów S. aureus SCHP, ludzką linię komórek monocytów THP-1 utrzymywano w RPMI-1640 zawierającym 10% (v / v) FBS w 37 ° C w atmosferze zawierającej 5% (v / v) CO2. W przypadku zakażenia makrofagami komórki THP-1 wysiano w ilości 5 x 105 komórek na studzienkę w 24-dołkowych płytkach do hodowli tkankowej i indukowano do różnicowania za pomocą 10-7 M 12-mirystynianu 13-octanu forbolu (PMA) przez 48 godzin. Około 3 × 108 jednostek tworzących kolonie (CFU) bakterii fazy logarytmicznej (OD600 0,5–0,6) osadzono przez odwirowanie, przemyto dwukrotnie PBS i ponownie zawieszono w 1 ml RPMI-1640. Następnie do pojedynczej warstwy komórek dodano bakterie przy MOI 20: 1 i odwirowano przez 5 minut przy 1000 obr./min. Zainfekowane komórki inkubowano przez 20 minut w 37 ° C, następnie przemyto trzykrotnie wstępnie ogrzanym PBS (pH 7,4) i inkubowano przez dodatkową 1 godzinę w pożywce zawierającej 100 µg / ml gentamycyny w celu zabicia bakterii zewnątrzkomórkowych. Komórki przemyto i poddano lizie, aby określić ilościowo wewnątrzkomórkową bakterię jako próbkę w czasie zero (T0). Dodatkowe komórki zebrano po 12 lub 24 godzinach inkubacji w obecności świeżego uzupełnionego pożywki do hodowli tkankowej zawierającej 12 μg / ml gentamycyny.Wzrost bakterii w komórkach THP-1 określono, dzieląc liczbę bakterii wewnątrzkomórkowych po 12 lub 24 godzinach przez liczbę w czasie 0 (T12 / T0 lub T24 / T0). Doświadczenie powtórzono niezależnie trzy razy.
Wykrywanie wydzielania cytokin przez makrofagi zakażone szczepami S. aureus SIHP
Supernatanty hodowli makrofagów THP-1 zakażonych bakteriami przez 12 godzin Zebrane. Poziomy cytokin mierzono metodą cytometrii przepływowej FACSCalibur (BD) przy użyciu zestawu CBA Human Thl / Th2 Cytokine II (BD) zgodnie z instrukcjami producenta.
Typowanie i analiza sekwencji z wieloma ogniskami
Wyniki
Hemolityczny fenotyp szczepów SIHP na płytkach z agarem owczym
Jak pokazano na rysunkach 1A, B, pełny pierścień hemolityczny (fenotyp β-hemolityczny) zaobserwowano w kontroli S . aureus po hodowaniu szczepów na płytkach agarowych z krwią przez 24 h. Jednak w szczepach SIHP wykazano różne fenotypy hemolityczne (zwane tutaj niekompletnym fenotypem hemolitycznym). Ponadto niekompletny fenotyp hemolityczny można było zaobserwować w szczepach SIHP, które rosły w różnych środowiskach warunki obejmujące odpowiednio warunki mikroaerofilne, tlenowe i beztlenowe (ryc. 1C – E). Ponadto, po 10 seryjnych pasażach, ten niekompletny fenotyp hemolityczny był nadal utrzymywany (ryc. 1F).
Względny Poziomy ekspresji mRNA czterech genów hemolizyny
Jak pokazano na rysunku 2, poziomy ekspresji czterech genów hemolizyny hla, hlb, hlgC i hld w szczepach SCHP nie wykazywały statystycznie istotnych różnic (p 0,05) w porównaniu ze szczepami kontrolnymi ATCC25923. Jednak poziomy ekspresji hla, hlgC i hld w szczepach SIHP były znacząco zmniejszone odpowiednio 50-, 16,7- i 8,3-krotnie (p < 0,05) w porównaniu z szczepy kontrolne ATCC25923 i szczepy SCHP, podczas gdy ekspresja hlb w szczepach SIHP była znacząco zwiększona 7,7-krotnie w porównaniu z kontrolnymi (p < 0,05).
Wykrywanie α-hemolizyny metodą Western Blot
α-hemolizyna kodowana przez gen hla jest toksyną tworzącą pory wydzielaną przez S. aureus, a jej masa cząsteczkowa wynosi 33 kDa (Andrey i in., 2015; Al Laham i in., 2015). Analiza Western blot wykazała, że ekspresja α-hemolizyny w szczepach SIHP była 40-krotnie niższa niż w szczepach SCHP i kontrolnych, co jest zgodne z danymi qRT-PCR (Rysunek 3).

Rysunek 3. Western blot α -hemolizyny w S. aureus. ATCC29213: kontrola S. aureus z pełnym fenotypem hemolitycznym; SCHP: S. aureus z pełnym fenotypem hemolitycznym wyizolowanym z próbek klinicznych w tym samym okresie; SIHP: S. aureus z niepełnym fenotypem hemolitycznym.
Lekooporność SIHP
Badana lekowrażliwość przy użyciu rozcieńczeń bulionu do mikromiareczkowania wykazano, że wartości MIC dla oksacyliny i cefoksytyny wynosiły odpowiednio > 2 i > 8 μg / ml w 60 barwieniach SIHP . Zgodnie z wytycznymi CLSI M100-S24 wszystkie 60 szczepów SIHP sklasyfikowano jako szczepy MRSA. PCR wykrył również gen mecA we wszystkich 60 szczepach.
Badanie genu tst
Gen tst jest ważnym czynnikiem zjadliwości u S. aureus. PCR wykazało, że wszystkie 50 szczepów SIHP niosło geny tst.
Zdolność przeżycia szczepów S. aureus SIHP w makrofagach jest większa niż w przypadku tst negatywnych S. aureus
Porównaliśmy zdolności do przeżycia wewnątrzkomórkowego szczepów SIHP i tst-ujemnego szczepu SCHP w makrofagach. Licząc liczbę bakterii odzyskanych z płytek, stwierdziliśmy, że zdolność przeżycia wewnątrzkomórkowego szczepu SIHP była znacznie wyższa niż zdolność tst ujemnego szczepu S. aureus po zakażonych makrofagach pochodzących z THP-1 po 12 lub 24 godzinach (Rysunek 4). Wstępnie spekulowaliśmy, że szczepy SIHP mają potencjalnie wysoką wirulencję i zasugerowano, że na SIHP należy zwrócić większą uwagę w szpitalu.
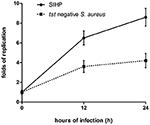
Rycina 4. Przeżywalność szczepów SIHP i tst-ujemnego S. aureus w makrofagach pochodzących z THP-1. Po zakażeniu makrofagów bakteriami przez 12 i 24 godziny, makrofagi poddano lizie i bakterie, które przeżyły wewnątrzkomórkowe, wysiano na agarze LB. Fałdy replikacyjne wewnątrzkomórkowych bakterii, które przeżyły, obliczono na podstawie liczby kolonii na powyższej płytce z agarem LB.
Różnice w wydzielaniu cytokin i chemokin makrofagów zakażonych przez szczepy S. aureus SIHP i tst ujemny S. aureus
Aby porównać różnice w wydzielaniu cytokin i chemokin w makrofagach pochodzących z THP-1 zakażonych szczepem SIHP i tst-ujemnym S.aureus, wykryliśmy cytokiny prozapalne metodą cytometrii przepływowej w supernatancie hodowli makrofagów zakażonych szczepami SIHP i tst-ujemnym szczepem S. aureus. Wyniki wykazały znacznie wyższą indukcję IL-2, IL-6 i IL-17A w szczepach SIHP, ale nie przez tst-ujemny S. aureus, co sugeruje, że szczepy SIHP indukują odpowiedzi cytokin / chemokin w makrofagach (Figura 5). Inne cytokiny IL-4, IL-10, INF-γ i TNF wydzielane przez makrofagi nie stanowiły oczywistych różnic między szczepami SIHP a tst-ujemnymi grupami dotkniętymi S. aureus.
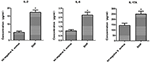
Rysunek 5. Wykrywanie cytokin i chemokin wydzielanych przez makrofagi zakażone S. aureus. * P < 0,05.
Wielokierunkowe wpisywanie sekwencji
Określiliśmy genotyp multilocus 60 izolatów SIHP pobranych od pacjentów przyjętych do naszego szpitala w latach 2013–2014. Zastosowano schemat siedmiu locus zalecany w bazie danych S. aureus MLST. Analiza MLST wykazała, że wszystkie szczepy SIHP zostały sklasyfikowane jako klon ST5.
Dyskusja
Hemolizyna jest jednym z najważniejszych czynników wirulencji S. aureus (Wiseman, 1975). Połączone działanie każdego z czterech rodzajów hemolizyny powoduje zniszczenie błony czerwonych krwinek, co prowadzi do powstania pełnego przezroczystego pierścienia hemolitycznego na płytkach agarowych z krwią. W ostatnich latach SIHP wykryto w próbkach klinicznych drugiego szpitala stowarzyszonego Uniwersytetu Soochow. W tym badaniu staraliśmy się zidentyfikować te szczepy i zbadać ich cechy w mikrobiologii. Początkowo używaliśmy różnych komercyjnych lub samodzielnie przygotowanych płytek agarowych z krwią owczą do izolowania, inkubacji i seryjnego pasażowania szczepów. Pokazaliśmy, że istnieją szczepy, które wykazują i utrzymują niekompletny fenotyp hemolityczny nawet po długotrwałej subkulturze. Zatem można wykluczyć możliwość, że ten fenotyp jest indukowany przez czynniki niebakteryjne. Nasze badania sugerują, że SIHP może być podzbiorem unikalnych szczepów S. aureus.
Poprzednie badania sugerowały, że krwinki czerwone królika są bardzo wrażliwe na α-hemolizynę (Hildebrand i wsp., 1991). Berube i in. podali, że wpływ α-hemolizyny na lizę krwinek czerwonych jest zależny od stężenia (Berube i Bubeck Wardenburg, 2013). γ-hemolizyna może uszkadzać czerwone krwinki ludzi i zwierząt (Kaneko i Kamio, 2004). Podczas gdy δ-hemolizyna uszkadza czerwone krwinki, tylko przy wysokich stężeniach tworzy przezbłonowe pory, które powodują lizę błony komórkowej (Verdon i wsp., 2009). W tym badaniu wykazaliśmy, że ekspresja czterech hemolizyn szczepów SIHP i szczepów SCHP ma znacząco różne profile ekspresji transkrypcyjnej. Ekspresja α-, γ-, δ-hemolizyny w szczepach SIHP, które mogą bezpośrednio uszkadzać czerwone krwinki, jest znacznie niższa niż w szczepach SCHP, podczas gdy β-hemolizyna ma znacznie wyższy poziom ekspresji w porównaniu ze szczepami SCHP. Ponadto poziom ekspresji białka α-hemolizyny został dodatkowo potwierdzony metodą western blot. Poinformowano, że β-hemolizyna głównie zwiększa wrażliwość czerwonych krwinek na inne toksyny zamiast bezpośrednio lizować komórki, chyba że komórki są hodowane w niższych temperaturach (Vandenesch et al., 2012). W tym badaniu wysoką ekspresję β-hemolizyny wykryto w szczepach SIHP, ale w szczepach SIHP nigdy nie zaobserwowano pełnego pierścienia hemolitycznego, nawet po inkubacji w temperaturze 4 ° C. Wyniki te sugerują, że obserwowany niepełny fenotyp szczepów SIHP jest najprawdopodobniej skutkiem działania wszystkich czterech hemolizyn, które są wyrażane w inny sposób niż szczepy SCHP. Wcześniejsze badania wykazały, że podczas przewlekłej patogenezy, połączony efekt presji selekcyjnej wywołanej antybiotykami, w tym cyprofloksacyną i trimetoprymem, a także odpowiedź immunologiczna gospodarza może prowadzić do zwiększonej ekspresji α-hemolizyny, która jest bardzo ważna dla kolonizacji S. . aureus w błonach śluzowych, zwłaszcza w infekcjach dróg oddechowych (Goerke i in., 2006; Huseby i in., 2010). W tym badaniu wszyscy pacjenci zakażeni SIHP otrzymywali długotrwałe leczenie antybiotykami o szerokim spektrum działania, czy to selektywne ciśnienie wywoływało nadekspresję genów lekoopornych i zakłócało ekspresję genów hemolizyny pozostaje możliwością, która wymaga dalszego
Aby zbadać mikrobiologiczne cechy SIHP, przeprowadziliśmy testy wrażliwości na środki przeciwdrobnoustrojowe i wybraliśmy gen wirulencji tst, który jest powiązany z patogennością S. aureus. Odkryliśmy, że wszystkie 60 szczepów SIHP można sklasyfikować jako szczepy MRSA i posiadać gen mecA. Wyniki testów wrażliwości na środki przeciwdrobnoustrojowe wykazały, że nawet po 10 pasażach z tych 60 szczepów SIHP wartości MIC linezolidu i teikoplaniny tylko trzech szczepów SIHP niewiele się zmieniły.Jednak te zmiany wartości MIC nie wpłynęły na ocenę wyników wrażliwości na środki przeciwdrobnoustrojowe. Gen wirulencji tst koduje toksynę zespołu wstrząsu toksycznego (TSST-1) (Kreiswirth, 1989). Jako super antygen TSST-1 wzmacnia wstrząs i odpowiedź immunologiczną indukowaną przez endotoksyny (Kulhankova i wsp., 2014). Test PCR wykazał, że wszystkie 60 szczepów SIHP posiadało gen tst, co sugeruje zwiększoną wirulencję. Ostatnio wiele raportów wykazało, że S. aureus może przeżyć w makrofagach pochodzących z ludzkich monocytów, a te szczepy S. aureus są bardziej zjadliwe (Kubica i wsp., 2008; Tranchemontagne i wsp., 2015; Münzenmayer i wsp., 2016; Nandi i Bishayi, 2016). Dlatego porównaliśmy możliwości przeżycia wewnątrzkomórkowego szczepów SIHP i szczepów SCHP, które są tst ujemne S. aureus u makrofagów i stwierdziliśmy, że zdolność przeżycia wewnątrzkomórkowego szczepu SIHP była znacznie wyższa niż tst ujemnego szczepu S. aureus. Ponadto analiza danych pacjentów wykazała, że efekt terapii przeciwinfekcyjnej u większości pacjentów zakażonych szczepami SIHP był gorszy niż u podobnych pacjentów zakażonych szczepami SCHP (dane nieprzedstawione). Nasze badanie dostarcza wstępnych eksperymentalnych dowodów na spekulacje, że szczepy SIHP mają potencjalnie wysoką wirulencję.
Podczas procesu infekcji inwazyjnym S. aureus, cząsteczki związane z patogenami inicjują wrodzony układ odpornościowy, prowadząc do aktywacji i rekrutacji neutrofili i makrofagów oraz produkcji cytokin prozapalnych, w szczególności TNF-α, IL-1β i IL-6 (Bekeredjian-Ding i wsp., 2015; Giai i wsp., 2016; Zhao i wsp., 2016 ). Stwierdzono, że wydzielanie zapalnych cytokin IL-6 wzrastało wraz ze wzrostem stężenia S. aureus (Chen i wsp., 2016). Ponadto superantygenowe S. aureus są szczególnie skuteczne w stymulowaniu produkcji IL-17 (Islander i wsp., 2010). W tym badaniu szczepy SIHP wykazały istotnie wyższą indukcję IL-2, IL-6 i IL-17A makrofagów w porównaniu z tst ujemnymi szczepami SCHP, co sugeruje, że szczepy SIHP mogą wywoływać większe wydzielanie cytokin, przeciwdziałając zabijającemu efektowi makrofagów. Ponadto analiza MLST wykazała, że wszystkie szczepy SIHP zostały sklasyfikowane jako klon ST5. Co więcej, te szczepy SIHP zostały zgrupowane razem w typ spa t2460 (dane niepokazane).
Podsumowując, SIHP może być nową podgrupą MRSA o potencjalnie wysokiej zjadliwości i należy poświęcić więcej uwagi kontrola i leczenie tych szczepów w szpitalach.
Wkład autorów
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badanie zostało przeprowadzone bez jakichkolwiek lub relacje finansowe, które można zinterpretować jako potencjalny konflikt interesów.
Podziękowania
To badanie było wspierane przez National Natural Science Foundation of China (81572032, 81401636), the Natural Science Foundation of China Foundation for Colleges and Universities in Jiangsu Province (16KJB320006) oraz Program Science and Technology of Suzhou (SYSD2014094, SYS201551, SS201638).
Klinika i laboratorium Instytut Norm (2014). M100-S24 Standardy wydajności do badania wrażliwości na środki przeciwdrobnoustrojowe; Dwudziesty czwarty dodatek informacyjny. Wayne, PA: CLSI.
Nandi, A. i Bishayi, B. (2016). Staphylococcus aureus, który przeżył wewnątrzkomórkowo po fagocytozie, jest bardziej zjadliwy w indukowaniu cytotoksyczności w świeżych mysich makrofagach otrzewnowych wykorzystujących TLR-2 jako potencjalny cel. Microb. Pathog. 97, 131-147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | Pełny tekst CrossRef | Google Scholar
Wiseman, G. M. (1975). Hemolizyny Staphylococcus aureus. Bacteriol. Rev. 39, 317–344.
PubMed Abstract | Google Scholar