Cyclohexane Molecule
O ciclohexano é um cicloalcano com a fórmula molecular C6H12. O ciclohexano é utilizado como solvente apolar para a indústria química e também como matéria-prima para a produção industrial de ácido adípico e caprolactama, sendo ambos intermediários utilizados na produção de náilon. Em escala industrial, o ciclohexano é produzido pela reação do benzeno com o hidrogênio. Devido às suas propriedades químicas e conformacionais únicas, o ciclohexano também é usado em laboratórios de análise e como padrão.
Molécula de ciclohexano usando Jsmol, consulte – Para estruturas 3D
Estrutura do ciclohexano Molécula
O anel com 6 vértices não tem a forma de um hexágono perfeito. A conformação de um hexágono plano 2D plano tem deformação angular considerável devido ao fato de que suas ligações não são 109,5 graus; a tensão de torção também seria considerável devido a todas as ligações eclipsadas. Portanto, para reduzir a tensão de torção, o ciclohexano adota uma estrutura tridimensional conhecida como conformação da cadeira. A nova conformação coloca os carbonos em um ângulo de 109,5 °. Metade dos hidrogênios está no plano do anel (equatorial) enquanto a outra metade está perpendicular ao plano (axial). Esta conformação permite a estrutura mais estável do ciclohexano. Existe outra conformação de ciclohexano, conhecida como conformação de barco, mas ela se interconecta na formação de cadeira um pouco mais estável. Se o ciclohexano for monossubstituído por um substituinte grande, então o substituinte provavelmente será encontrado ligado em uma posição equatorial, pois esta é a conformação ligeiramente mais estável.
O ciclohexano tem o menor ângulo e tensão de torção de todos os cicloalcanos, como resultado, o ciclohexano foi considerado um 0 na deformação total do anel, uma combinação de ângulo e deformação de torção. Isso também torna o ciclohexano o mais estável dos cicloalcanos e, portanto, produzirá a menor quantidade de calor quando queimado em comparação com os outros cicloalcanos.
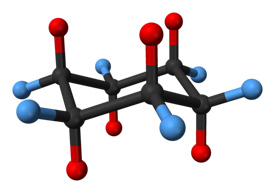
Uma molécula de ciclohexano em conformação de cadeira. Os átomos de hidrogênio em posições axiais são mostrados em vermelho, enquanto aqueles em posições equatoriais estão em azul.
Reações com ciclohexano
O ciclohexano puro em si é bastante não reativo, sendo um apolar, hidrocarboneto hidrofóbico. Pode reagir com ácidos muito fortes, como o sistema superácido HF + SbF5, que causará protonação forçada e “craqueamento de hidrocarbonetos”. Os ciclohexanos substituídos, entretanto, podem ser reativos sob uma variedade de condições, muitas das quais são importantes para a química orgânica. O ciclohexano é altamente inflamável.
Derivados do ciclohexano
O arranjo específico dos grupos funcionais nos derivados do ciclohexano, e na verdade na maioria das moléculas do cicloalcano, é extremamente importante em reações químicas, especialmente reações envolvendo nucleófilos. Os substituintes no anel devem estar na formação axial para reagir com outras moléculas. Por exemplo, a reação de bromociclohexano e um nucleófilo comum, um ânion hidróxido, resultaria em ciclohexeno.
Esta reação, comumente conhecida como uma reação de eliminação ou desalogenação (especificamente E2), requer que o substituinte de bromo seja na formação axial, opondo-se a outro átomo H axial para reagir. Assumindo que o bromociclohexano estava na formação apropriada para reagir, a reação E2 começaria como tal:
- A ligação do par de elétrons entre o C-Br se move para o Br, formando Br∠‘e configurando-o livre de ciclohexano
- O nucleófilo (-OH) dá um par de elétrons ao H axial adjacente, deixando H livre e ligando-se a ele para criar H2O
- A ligação do par de elétrons entre o H adjacente axial H se move para a ligação entre os dois CC tornando-o C = C
Nota: Todas as três etapas acontecem simultaneamente, característica de todas as reações E2.
A reação acima irá gerar principalmente reações E2 e, como resultado, o produto será principalmente (~ 70%) ciclohexeno. No entanto, a porcentagem varia com as condições e, geralmente, duas reações diferentes (E2 e Sn2) competem. Na reação acima, uma reação Sn2 substituiria o bromo por um grupo hidroxila (OH-), mas mais uma vez, o Br deve estar em axial para reagir. Uma vez que a substituição SN2 esteja completa, o grupo OH recém-substituído voltaria rapidamente para a posição equatorial mais estável (~ 1 milissegundo). Usos
Comercialmente, a maior parte do ciclohexano produzido é convertido na mistura de ciclohexanona-ciclohexanol por catalisador oxidação. O óleo KA é então usado como matéria-prima para ácido adípico e caprolactama. Praticamente, se o teor de ciclohexanol do óleo KA for maior do que ciclohexanona, é mais provável (econômico) ser convertido em ácido adípico e, no caso inverso, a produção de caprolactama é mais provável. Tal proporção no óleo KA pode ser controlada selecionando catalisadores de oxidação adequados. Parte do ciclohexano é usada como solvente orgânico.
Ciclohexano em pesquisa
Embora muito já se saiba sobre este hidrocarboneto cíclico, pesquisas ainda estão sendo feitas em misturas de ciclohexano e benzeno e ciclohexano em fase sólida para determinar os rendimentos de hidrogênio da mistura quando irradiado a 195 ° C.
História
Ao contrário de compostos como o benzeno, o ciclohexano não pode ser obtido facilmente de recursos naturais como o carvão. No final do século XIX, os primeiros investigadores químicos dependeram da síntese orgânica. Eles levaram 30 anos para detalhar os detalhes. Em 1867, Marcelin Berthelot reduziu o benzeno com ácido iodídrico a temperaturas elevadas. Ele identificou incorretamente o produto da reação como n-hexano, não apenas por causa da combinação conveniente no ponto de ebulição (69 ° C), mas também porque não acreditava que o benzeno fosse uma molécula cíclica (como seu contemporâneo August Kekule), mas sim algum tipo de associação de acetileno. Em 1870, um de seus céticos Adolf von Baeyer repetiu a reação e pronunciou o mesmo produto de reação hexahidrobenzeno e em 1890 Vladimir Markovnikov acreditou ser capaz de destilar o mesmo composto do petróleo do Cáucaso, chamando sua mistura de hexanaftene
Em 1894 Baeyer ciclohexano sintetizado começando com uma condensação de Dieckmann de ácido pimélico seguida por reduções múltiplas. e no mesmo ano E. Haworth e W.H. Perkin Jr. (1860 – 1929) fez o mesmo em uma reação de Wurtz de 1,6-dibromohexano. Surpreendentemente, seus ciclohexanos ferviam mais 10 ° C do que hexaidrobenzeno ou hexanafteno, mas este enigma foi resolvido em 1895 por Markovnikov, NM Kishner e Nikolay Zelinsky quando eles redefiniram o hexa-hidrobenzeno e o hexanafteno como metilciclopentano, o resultado de uma reação de rearranjo inesperado.