Fatos sobre o elemento de cádmio
O elemento químico cádmio é classificado como um metal de transição. Foi descoberto em 1817 por Friedrich Stromeyer.

Zona de dados
| Classificação: | Cádmio é um metal de transição |
| Cor: | branco-azulado |
| Peso atômico: | 112,41 |
| Estado: | sólido |
| Ponto de fusão: | 321,1 oC, 594,3 K |
| Ponto de ebulição: | 765 oC, 1038 K |
| Elétrons: | 48 |
| Prótons: | 48 |
| Nêutrons no isótopo mais abundante: | 66 |
| Cascas de elétrons: | 2,8,18,18,2 |
| Configuração de elétrons: | 4d10 5s2 |
| Densidade @ 20oC: | 8,65 g / cm3 |
Mostrar mais, incluindo: Calores, Energias, Oxidação, Reações,
Compostos, Raios, Condutividades
| Volume atômico: | 13,1 cm3 / mol |
| Estrutura: | hcp: hexagonal fechado embalado |
| Dureza: | 2,0 mohs |
| Capacidade de calor específico | 0,23 J g-1 K-1 |
| Calor de fusão | 6,192 kJ mol-1 |
| Calor de atomização | 112 kJ mol-1 |
| Calor de vaporização | 99,87 kJ mol-1 |
| 1ª energia de ionização | 867,7 kJ mol-1 |
| 2ª energia de ionização | 1631,4 kJ mol-1 |
| 3ª energia de ionização | 3616,2 kJ mol-1 |
| Afinidade de elétron | – |
| Número mínimo de oxidação | 0 |
| Min. número de oxidação comum | 0 |
| Número máximo de oxidação | 2 |
| Máx. oxidação comum não. | 2 |
| Eletronegatividade (escala de Pauling) | 1,69 |
| Polarizabilidade volume | 7,2 Å3 |
| Reação com ar | leve, com ht ⇒ CdO |
| Reação com HNO3 15 M | leve ⇒ Cd (NO3) 2, NOx |
| Reação com HCl 6 M | leve, ⇒ H2, CdCl2 |
| Reação com 6 M NaOH | nenhum |
| Óxido (s) | CdO, CdO2 |
| Hidreto (s) | CdH2 |
| Cloreto (s) | CdCl2 |
| Raio atômico | 151 pm |
| Raio iônico (íon 1+) | – |
| Raio iônico (íon 2+) | 109 pm |
| Raio iônico (3+ íons) | – |
| Raio iônico (1-íon) | – |
| Raio iônico (2-íons) | – |
| Raio iônico (3-íons) | – |
| O condutividade térmica | 96,6 W m-1 K-1 |
| Condutividade elétrica | 14,7 x 106 S m-1 |
| Ponto de congelamento / fusão: | 321,1 oC, 594,3 K |

Uma pequena bola de cádmio metálico, com uma moeda para referência de tamanho.

Friedrich Stromeyer, que descobriu o cádmio em 1817.
Vizinhança da tabela periódica do cádmio
| Grupo 11 |
Grupo 12 | Grupo 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 In |
| 6 | 79 Au |
80 Hg |
81 Tl |
Descoberta do cádmio
O cádmio foi descoberto pelo químico alemão Friedrich Stromeyer em 1817 como uma impureza no óxido de zinco. (1)
Stromeyer fez sua descoberta após um pedido do governo para inspecionar as farmácias na cidade de Hildesheim, Alemanha.
Naquela época, o óxido de zinco era usado, como ainda é, para tratar doenças de pele. Por algum motivo, as farmácias de Hildesheim vendiam carbonato de zinco em vez do óxido de zinco normal.
Stromeyer estava ciente de que aquecer o carbonato de zinco até que ficasse em brasa o transformaria em óxido. Ele fez isso com amostras das farmácias. Ele descobriu que o carbonato branco brilhante se transformou em um óxido que deveria ser branco, mas na verdade era amarelo / laranja.
Normalmente, essa cor sugeria contaminação por ferro ou chumbo, mas Stromeyer não conseguiu encontrar nenhum vestígio desses elementos.
Ele visitou a fábrica em Salzgitter onde as farmácias haviam comprado o carbonato de zinco. Ele perguntou por que eles estavam vendendo carbonato de zinco em vez do óxido usual.
O gerente explicou a ele que o carbonato de zinco tinha a cor esperada – branco – e era fácil de vender.
Quando eles tentaram converter o carbonato em óxido por aquecimento, sempre ficava amarelo. Como o óxido de zinco deveria ser branco, eles não podiam vendê-lo. Eles o haviam analisado cuidadosamente em busca de contaminação por ferro, mas não conseguiram encontrar nada.
Stromeyer então decidiu que ele próprio analisaria cuidadosamente o óxido de zinco amarelo. Ele descobriu que a cor amarela era causada pela “presença de um óxido metálico peculiar, cuja existência não havia sido suspeitada até então.”
Ele extraiu esse novo óxido de metal do óxido de zinco e o reduziu para isolar o primeiro cádmio metálico do mundo. Ele comparou sua aparência à da platina e mediu sua densidade em 8,75 g / cm3 – muito próxima à de hoje valor aceito.
Ele fez um trabalho adicional e descobriu que outros compostos de zinco também continham seu novo metal. Ele analisou o metal zinco “puro” e descobriu que seu novo metal estava presente até mesmo neste.
Ele estimou que o novo metal estava presente entre 0,1% e 1% no zinco e seus compostos, dos quais ele foi capaz de isolar 3 gramas de metal cádmio puro.
Stromeyer sugeriu o nome de cádmio depois de ‘cadmia’, o nome latino para calamina. Calamina é um nome antigo para minério de zinco.
O cádmio foi descoberto independentemente pelo químico alemão Karl Hermann em 1818. Hermann notou uma inesperada cor amarela no sulfeto de zinco . Presumiu-se que o amarelo era de impurezas de arsênico, mas Hermann percebeu que na verdade era devido a um elemento previamente desconhecido ment. (2)


Telureto de cádmio é usado para fazer células solares de película fina, que podem absorver mais de 90% da luz visível. Imagem: NREL
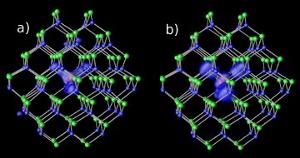
Impurezas de magnésio em nanocristais de cádmio-selênio em dois níveis de lacuna diferentes : (a) ressonante e (b) híbrido. Imagem: NERSC
Aparência e características
Efeitos prejudiciais:
Cádmio e seus compostos são altamente tóxicos.
Características:
O cádmio é um metal macio, maleável, dúctil, branco-azulado, que pode ser facilmente cortado com uma faca. É um excelente condutor elétrico e apresenta boa resistência à corrosão e ao ataque de produtos químicos.
É semelhante em muitos aspectos ao zinco em suas propriedades químicas.
O cádmio mancha no ar e é solúvel em ácidos, mas não em álcalis.
O metal queima no ar para formar óxido de cádmio marrom (CdO).
Usos do cádmio
O principal uso do cádmio é em baterias (especialmente níquel-cádmio recarregável, NiCad, baterias).
Como resultado de seu baixo coeficiente de atrito e alta resistência à fadiga, o cádmio é usado em ligas para rolamentos. O cádmio é usado em ligas de baixo ponto de fusão e é um componente de muitos tipos de solda. Ele também é usado em galvanoplastia.
Os compostos que contêm cádmio são usados em fósforos de televisão a preto e branco e em fósforos de azul e verde para tubos de imagem de televisão a cores. O sulfeto de cádmio é usado como um pigmento amarelo e o seleneto de cádmio é usado como um pigmento vermelho, frequentemente chamado de vermelho de cádmio.
O cádmio e o telúrio podem ser compostos em módulos fotovoltaicos de filme fino de CdTe cujas características físicas são ideais para produção de células solares. Eles têm um custo relativamente baixo e têm um intervalo quase perfeito para a coleta de energia solar.
Abundância e isótopos
Abundância da crosta terrestre: 150 partes por bilhão por peso, 30 partes por bilhão por moles
Sistema solar de abundância: 6 partes por bilhão em peso, 70 partes por trilhão em moles
Custo puro: $ 46 por 100g
Custo, a granel: $ 0,77 por 100g
Fonte: O cádmio ocorre mais frequentemente em pequenas quantidades associadas aos minérios de zinco, como a esfalerita (ZnS). Greenockite (CdS) é o único mineral de cádmio de qualquer consequência. Quase todo o cádmio é obtido como subproduto das operações de refino de minério de zinco, cobre e chumbo.

- Friedrich Stromeyer, Annals of Philosophy, editado por Thomas Thomson, Volume XIII, 1819, Robert Baldwin, p108
- JW Mellor, A Comprehensive Treatise in Inorganic and Theoretical Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
Cite this page
Para links online , copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
ou
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
Para cite esta página em um documento acadêmico, use a seguinte citação compatível com MLA:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.