Fatos sobre o elemento Francium
O elemento químico frâncio é classificado como um metal alcalino. Foi descoberto em 1939 por Marguerite Perey.

Zona de dados
| Classificação: | Francium é um metal alcalino | |
| Cor: | prata-cinza metálico (presumido) | |
| Atômico peso: | (223), sem isótopos estáveis | |
| Estado: | sólido | |
| Ponto de fusão: | 27 oC, 300 K | |
| Ponto de ebulição: | 677 oC, 950 K | |
| Elétrons: | 87 | |
| Prótons: | 87 | |
| Nêutrons no isótopo mais abundante: | 136 | |
| Cascas de elétrons: | 2, 8,18,32,18,8,1 | |
| Configuração de elétrons: | 7s1 | |
| Densidade @ 20oC: | 1,873 g / cm3 |
Mostre mais, incluindo: Calores, Energias, Oxidação,
Reações, compostos, raios, condutividades
| Volume atômico: | 71,07 cm3 / mol |
| Estrutura: | considerada bcc: cúbica centrada no corpo |
| Dureza: | – |
| Capacidade de calor específico | – |
| Calor de fusão | 2 kJ mol-1 |
| Calor de atomização | 73 kJ mol-1 |
| Calor de vaporização | 64 kJ mol-1 |
| 1ª energia de ionização | 384 kJ mol-1 |
| 2ª energia de ionização | – |
| 3ª energia de ionização | – |
| Afinidade de elétron | – |
| Número mínimo de oxidação | 0 |
| Min. número de oxidação comum | 0 |
| Número máximo de oxidação | 1 |
| Máx. oxidação comum não. | 1 |
| Eletronegatividade (escala de Pauling) | 0,7 |
| Polarizabilidade volume | 48,7 Å3 |
| Reação com ar | – |
| Reação com HNO3 15 M | – |
| Reação com HCl 6 M | vigorosa, ⇒ H2, FrCl |
| Reação com 6 M NaOH | vigorosa, ⇒ H2, FrOH |
| Óxido (s) | – |
| Hidreto (s) | – |
| Cloreto (s) | – |
| Raio atômico | – |
| Raio iônico (1+ íon) | 194 pm |
| Raio iônico (2+ íons) | – |
| Raio iônico (3+ íons) | – |
| Raio iônico (1-íon) | – |
| Raio iônico (2 íons) | – |
| Raio iônico (3 íons) | – |
| Condutividade térmica | 3,61 W m-1 K-1 |
| Condutividade elétrica | – |
| Ponto de congelamento / fusão: | 27 oC, 300 K |

Esta amostra de minério de urânio contém cerca de 100.000 átomos de frâncio-223 (3,3 x 10 -20 g). Francium é radioativo; menos de 30g dele existe na Terra a qualquer momento. Imagem Ref. (1)
Descoberta de Francium
Francium foi descoberto por Marguerite Perey em 1939 quando ela pesquisava a decadência radioativa do actínio-227.
A descoberta aconteceu no Instituto Curie de Paris. O elemento leva o nome do país de sua descoberta – França.
A descoberta começou, em 1935, quando Perey, de 26 anos, leu um artigo de pesquisa afirmando que cientistas americanos haviam descoberto partículas beta sendo emitidas por actínio que tinha uma quantidade de energia maior do que o normal.
Perey estava curioso com essa descoberta e, já sendo especialista em trabalhos relacionados ao actínio, decidiu realizar seus próprios experimentos com o actínio. Ela produziu uma amostra de actínio ultra-puro e estudou sua radiação. Perey descobriu que cerca de 1% da radioatividade dos actínios era causada pela emissão de partículas alfa, não partículas beta.
Perey descobriu que o actínio-227 poderia decair emitindo um núcleo de hélio (também chamado de partícula alfa) de seu próprio núcleo. O núcleo filho formado era um elemento ainda não descoberto que ela escolheu chamar de frâncio em homenagem ao seu país de origem, a França.
227Ac → 223Fr + 4Ele
Com 87 prótons, o novo elemento pertencia Grupo 1 da tabela periódica, que reúne os outros cinco metais alcalinos: lítio, sódio, potássio, rubídio e césio.
A descoberta do frâncio completou as descobertas humanas de elementos que ocorrem naturalmente.
Todos os elementos descobertos desde então foram descobertos quando o elemento foi produzido em laboratório.

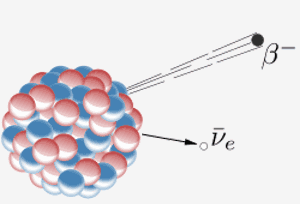
Um núcleo emite uma partícula beta ( um elétron) e um antineutrino. O resultado disso é que um nêutron no núcleo se transforma em um próton. Quando o elemento 87 na tabela periódica (frâncio) faz isso, o próton extra significa que ele se torna o elemento 88 (rádio).
Aparência e características
Efeitos nocivos:
Francium é altamente radioativo.
Características:
Francium é um metal pesado, instável e radioativo com uma meia-vida máxima de apenas 22 minutos. Tem um ponto de fusão baixo (27 oC, 81 oF) e, se o suficiente pudesse ser acumulado, seria líquido em uma sala quente.
O frâncio é o segundo elemento mais raro na crosta terrestre, ao lado de astatine. Menos de trinta gramas de frâncio existem na Terra a qualquer momento.
O frâncio é o menos eletronegativo de todos os elementos, portanto, deve ser o metal alcalino mais reativo quimicamente. Infelizmente, não está disponível em quantidades suficientes para mostrar sua reação com a água – é feito em pequenas quantidades em aceleradores de partículas. Em teoria, sua reação com a água seria mais violenta do que a do césio e muito mais violenta do que a do sódio.
O Francium foi estudado mais recentemente na Stony Brook University, em Nova York. Os cientistas capturaram até dez mil átomos de frâncio por vez, usando feixes de laser em um campo magnético para medir suas propriedades.
Usos do frâncio
Comercialmente, não há usos para o frâncio, devido à sua raridade e instabilidade. É usado apenas para fins de pesquisa.
Decaimento de Francium
Os isótopos de Francium, com números de massa variando de 200 a 232, geralmente sofrem decaimento alfa ou beta.
Aqui estão apenas alguns exemplos de caminhos de decaimento do frâncio:
Francium-223 é o isótopo de vida mais longa do elemento. Tem meia-vida de 22 minutos. Ele pode emitir uma partícula alfa (um núcleo de hélio) para formar astatine-219 ou uma partícula beta para formar o rádio-223. (Uma partícula beta é um elétron que é emitido de um núcleo quando um nêutron se converte em um próton.)
O Francium-221 tem meia-vida de 5 minutos. Ele pode emitir uma partícula alfa para formar astatine-217 ou uma partícula beta para se tornar o rádio-221.
O Francium-216 tem meia-vida de 0,7 microssegundos. Ele pode emitir uma partícula alfa para formar astatine-212 ou um pósitron para formar o radon-216.
O Francium-212 tem meia-vida de 19 minutos. Ele pode emitir uma partícula alfa para formar o astatine-208 ou capturar um elétron orbital para formar o radon-212. (2) (Durante a captura orbital de elétrons, o núcleo captura um dos próprios elétrons do átomo e emite um neutrino.)
Abundância e isótopos
Abundância na crosta terrestre: ~ 0 partes por milhão , ~ 0 partes por milhão
Sistema solar de abundância: ~ 0 partes por bilhão em peso, ~ 0 partes por bilhão em moles
Custo puro: $ por 100g
Custo, volume: $ por 100g
Fonte: Francium ocorre naturalmente como resultado do decaimento radioativo alfa do actínio.
Isótopos: Francium tem 33 isótopos cujas meias-vidas são conhecidos, com números de massa de 200 a 232. Nenhum é estável. 223Fr tem a meia-vida mais longa com 21,8 minutos.

- Foto de Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, Issue 6.
Cite this Page
Para links online, copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
ou
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Para citar esta página em um documento acadêmico, use o seguinte citação compatível com MLA:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.