Fatos sobre o elemento polônio
O elemento químico polônio é classificado como calcogênio e metalóide. Foi descoberto em 1898 por Marie e Pierre Curie.

Zona de dados
| Classificação: | O polônio é um calcogênio e um metalóide | |
| Cor: | cinza prateado | |
| Peso atômico : | (209), nenhum isótopo estável | |
| Estado: | sólido | |
| Ponto de fusão: | 254 oC, 527 K | |
| Ponto de ebulição: | 960 oC, 1233 K | |
| Elétrons: | 84 | |
| Prótons: | 84 | |
| Nêutrons no isótopo mais abundante: | 125 | |
| Cascas de elétrons: | 2,8 , 18,32,18,6 | |
| Configuração de elétrons: | 4f14 5d10 6s2 6p4 | |
| Densidade @ 20oC: | 9,4 g / cm3 |
Mostre mais, incluindo: Calorias, Energias, Boi idação,
Reações, Compostos, Raios, Condutividades
| Volume atômico: | 22,23 cm3 / mol |
| Estrutura: | cúbica simples |
| Dureza: | – |
| Capacidade de calor específico | 0,12 J g-1 K-1 0,12 |
| Calor de fusão | 13 kJ mol-1 |
| Calor de atomização | 142 kJ mol-1 |
| Calor de vaporização | 120 kJ mol-1 |
| 1ª energia de ionização | 812 kJ mol-1 |
| 2ª energia de ionização | – |
| 3ª energia de ionização | – |
| Afinidade de elétron | 180 kJ mol-1 |
| Número mínimo de oxidação | -2 |
| Min. número de oxidação comum | -2 |
| Número máximo de oxidação | 6 |
| Máx. oxidação comum não. | 4 |
| Eletronegatividade (escala de Pauling) | 2.0 |
| Polarizabilidade volume | 6,8 Å3 |
| Reação com ar | suave, ⇒ PoO2 |
| Reação com HNO3 15 M | – |
| Reação com HCl 6 M | leve, ⇒ PoCl2 |
| Reação com 6 M NaOH | nenhum |
| Óxido (s) | PoO2, PoO2 |
| Hidreto (s) | PoH2 |
| Cloreto (s) | PoCl2 |
| Raio atômico | 190 pm |
| Raio iônico (1+ íon) | – |
| Raio iônico (2+ íons) | – |
| Iônico raio (3+ íons) | – |
| Raio iônico (1-íon) | – |
| Raio iônico (2 íons) | – |
| Raio iônico (3 íons) | – |
| Condutividade térmica | 0,2 W m-1 K-1 |
| Condutividade elétrica | 0,7 x 106 S m-1 |
| Ponto de congelamento / fusão: | 254 oC, 527 K |

Marie Curie em 1883, 16 anos. O polônio foi o primeiro elemento que ela descobriu, 15 anos depois.
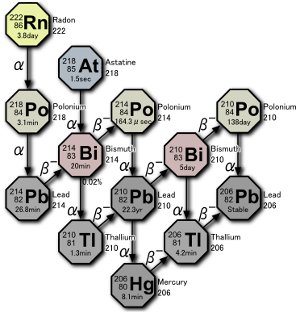
Parte do série de decaimento de urânio. Três isótopos de polônio são produzidos na natureza, seja pela decadência do próprio gás radônio ou pela decadência dos átomos resultantes da decadência do radônio. Imagem de Tosaka.
Descoberta de polônio
O polônio foi o primeiro elemento descoberto por Marie e Pierre Curie.
Eles descobriram o polônio e depois o rádio em 1898 em Paris, enquanto investigavam a radioatividade em pitchblenda (óxido de urânio).
Eles escreveram: “Acreditamos que a substância que extraímos do pitchblende contém um metal nunca conhecido antes, semelhante ao bismuto em suas propriedades analíticas. Se a existência deste novo metal for confirmada, sugerimos que deveria ser chamado polônio após o nome do país de origem de um de nós. ”
De acordo com os desejos dos Curie, o polônio recebeu o nome da Polônia, onde Marie Curie nasceu e cresceu.
Os perigos de trabalhar com elementos radioativos não eram conhecidos quando os Curie fizeram suas descobertas. Seus cadernos de laboratório dessa época são tão radioativos que agora estão armazenados em uma caixa revestida de chumbo. (1)
Aparência e características
Efeitos nocivos:
O polônio é prejudicial tanto por sua toxicidade química quanto por sua radioatividade. O polônio-210 é um emissor alfa. Como tal, é muito perigoso se ingerido ou inalado.A exposição ao polônio aumenta o risco de contrair vários tipos de câncer.
Características:
O polônio é um metalóide raro, cinza-prateado, radioativo e de baixo ponto de fusão.
O polônio reage prontamente com ácidos diluídos, mas apenas ligeiramente com álcalis.
Todos os seus isótopos são radioativos.
210Po emite um brilho azul, pois o ar ao seu redor é excitado pela decomposição produtos. 1 grama de Po emite tantas partículas alfa quanto 5 quilogramas de rádio.
A energia liberada pela decadência alfa do polônio é considerável e aquece o espaço ao seu redor. A energia liberada é tão grande (140 W / g) que uma cápsula contendo cerca de meio grama atinge uma temperatura acima de 500 ° C.
Usos do polônio
Os raios alfa emitidos por o polônio pode ser usado para eliminar a eletricidade estática produzida durante processos como papel para enrolar, arame e chapa metálica. No entanto, as fontes de raios beta são mais comumente usadas, pois são menos perigosas.
210Po pode ser usado como uma fonte de calor atômica, mas por causa da meia-vida curta do isótopo (138,4 dias), ele não fornece energia para usos de longo prazo.
O polônio também é usado em escovas antiestáticas para eliminar a poeira no filme fotográfico. É lacrado em escovas para controlar as emissões radioativas.
Abundância e isótopos
Abundância da crosta terrestre: da ordem de 1 parte por quatrilhão.
Abundância do sistema solar: insignificante
Custo , puro: por 100g
Custo, volume: por 100g
Fonte: Polônio é um elemento muito raro devido à meia-vida curta de todos os seus isótopos. É encontrado em minérios de urânio em quantidades mínimas. Pode ser obtido bombardeando o bismuto natural, 209Bi, com nêutrons para dar 210Bi, que então decai para 210Po via decaimento β. Aproximadamente 100 g de polônio são sintetizados a cada ano.
Isótopos: O polônio tem 29 isótopos cujas meias-vidas são conhecidas, com números de massa de 190 a 218. Nenhum é estável. O isótopo mais estável é 209Po, com meia-vida de 102 anos.

Cite esta página
Para links online, copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
ou
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Para citar esta página em um documento acadêmico, use a seguinte citação compatível com MLA:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.