Fronteiras na fisiologia
Introdução
Os barorreceptores arteriais servem como sensores de linha de frente para detectar mudanças na pressão sanguínea na corrente sanguínea. Mudanças na pressão sanguínea estimulam as terminações nervosas mecanossensíveis que estão localizadas nas paredes arteriais. A força mecânica é transduzida em sinais elétricos nos terminais nervosos, resultando em disparos do potencial de ação dependente da pressão nos neurônios barorreceptores. Os sinais nervosos então se propagam para o centro de controle cardiovascular no tronco cerebral para a regulação barorreflexa da pressão arterial (Levy MN, 2007). Além disso, as estruturas supra-medulares, incluindo o núcleo cuneiforme do mesencéfalo e o córtex pré-frontal medial ventral, também têm um papel inibidor na regulação do barorreflexo (Verberne et al., 1997).
Existem dois barorreceptores arteriais, a saber, os barorreceptores aórticos e os barorreceptores carotídeos, localizados na camada adventícia do arco aórtico e artérias carótidas, respectivamente. Os barorreceptores aórticos detectam a pressão arterial na aorta. Os corpos celulares (soma) dos barorreceptores aórticos estão localizados no gânglio nodoso (NG) (Figura 1). Os sinais nervosos dos terminais nervosos barorreceptores aórticos são transmitidos ao gânglio nodoso por meio de um nervo sensorial denominado nervo depressor aórtico (ADN) (Figura 1). Os barorreceptores carotídeos detectam a pressão sanguínea na artéria carótida, que fornece sangue ao cérebro. Os terminais nervosos dos barorreceptores carotídeos estão localizados bilateralmente nas bifurcações da artéria carótida, próximo à artéria carótida interna. Os sinais nervosos dos barorreceptores carotídeos viajam ao longo dos nervos do seio carotídeo (CSN) até seu soma localizado no gânglio petroso (PG). O gânglio petroso projeta-se para além do forame jugular (Figura 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly e Rigual, 2000; Weijnen et al., 2000) . Como os barorreceptores aórticos detectam a pressão arterial na aorta, que fornece sangue a toda a circulação sistêmica, espera-se que esses barorreceptores desempenhem um papel funcional importante na manutenção da pressão arterial sistêmica geral. Por outro lado, os barorreceptores carotídeos detectam a pressão do sangue que está sendo entregue ao cérebro. Esses barorreceptores podem ser mais importantes para a manutenção de uma pressão sanguínea cerebral estável e do fluxo sanguíneo cerebral.
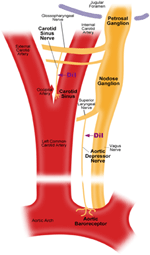
Figura 1. Diagrama esquemático dos terminais e nervos dos barorreceptores da aorta e da carótida. Diagrama ilustrando as posições anatômicas dos terminais nervosos dos barorreceptores da aorta e da carótida, suas fibras nervosas e regiões do somata. Os terminais dos barorreceptores aórticos estão localizados no arco aórtico. Sua fibra nervosa aferente é o nervo depressor aórtico. O soma está no gânglio nodoso (NG). O barorreceptor carotídeo está posicionado na artéria carótida interna próximo à bifurcação carotídea. Seu nervo aferente é o nervo do seio carotídeo. O soma está localizado no gânglio petroso (PG).
Existem relatos conflitantes sobre quais barorreceptores, barorreceptores aórticos ou carótida barorreceptores, são mais sensíveis à mudança da pressão arterial. Alguns pesquisadores relataram que os barorreceptores carotídeos são mais sensíveis à pressão (Donald e Edis, 1971; Fadel et al., 2003), enquanto outros acreditam que os barorreceptores aórticos são mais sensíveis à pressão (Glick e Covell, 1968; Pickering et al., 2008), e ainda outros não relataram nenhuma diferença na sensibilidade à pressão entre esses dois barorreceptores (Hainswor et al., 1970; James e Daly, 1970). No entanto, quase todos esses estudos anteriores usaram apenas as respostas do barorreflexo (como a frequência cardíaca e a atividade do nervo simpático renal) como pontos finais para o ensaio de sensibilidade dos barorreceptores. Ainda não há um estudo que registre e compare diretamente a sensibilidade à pressão dos neurônios barorreceptores da aorta e da carótida per se.
Aqui, usamos uma pinça de pressão de alta velocidade para alterar a pressão hidrostática dentro dos neurônios barorreceptores e medimos as respostas eletrofisiológicas correspondentes desses neurônios por patch clamping de célula inteira. Também usamos uma câmara de alongamento uniaxial para alongar os neurônios barorreceptores e medimos as alterações correspondentes no Ca2 + citosólico nesses neurônios. Além disso, para estudos em animais in vivo, medimos os disparos do potencial de ação induzida por pressão nos nervos depressor aórtico e seio carotídeo, que são os nervos sensoriais dos barorreceptores aórticos e carotídeos, respectivamente.
Materiais e métodos
Animais
Todos os experimentos com animais foram conduzidos sob a autoridade de uma licença emitida pelo Governo da Região Administrativa Especial de Hong Kong e com a aprovação do Comitê de Ética em Experimentação Animal da Universidade Chinesa de Hong Kong.Ratos Sprague-Dawley (S / D) machos (180–200 g) foram fornecidos pelo Centro de Serviços de Animais de Laboratório da Universidade Chinesa de Hong Kong.
Cultura primária
S / D os ratos foram anestesiados com pentobarbital sódico (100 mg / kg). A área cervical esquerda foi exposta por incisão mediana sob condição esterilizada. Conforme mostrado na Figura 1, o nervo depressor aórtico ou nervo do seio carotídeo foi exposto e 2–3 mm do nervo foram cuidadosamente destacados dos tecidos circundantes por dissecção romba. Cristais fluorescentes de traçador lipofílico 1,1-dioctadecil-3,3,3 ′, 3′-tetrametilindocarbocianina (DiI) (Invitrogen) foram aplicados ao redor do nervo e cobertos com Kwik-Sil (World Precision Instruments, EUA). A incisão foi suturada posteriormente. Os ratos puderam se recuperar por 5-7 dias para permitir que o corante DiI se difundisse retrogradamente ao longo do nervo depressor aórtico ou nervo do seio carotídeo até o corpo físico localizado no gânglio nodoso ou gânglio petroso, respectivamente.
Gânglio nodoso ou petroso neurônios foram isolados de ratos marcados com DiI e cortados em pedaços em EBSS gelado. Eles foram submetidos à digestão por 1 h a 37 ° C com tripsina (1 mg / ml) e colagenase IA (1 mg / ml). Neurônios individuais foram dispersos por trituração suave pela pipeta Glass Pasteur, seguida por centrifugação. Os neurônios foram ressuspensos e cultivados em meio DMEM / F-12 suplementado com 5% de FBS, 1% de antibiótico-antimicótico e 7S NGF (100 ng / ml). Citosina arabinofuranosídeo (Ara-C; 10 μM) foi incluída no meio de cultura para inibir o crescimento de células em divisão. Os neurônios foram cultivados por pelo menos 3 dias antes dos experimentos. Para o registro do potencial de ação, os neurônios foram isolados e incubados em F12 pelo menos 30 minutos antes dos experimentos. Para todos os experimentos, as células foram incubadas em lâminas de vidro pré-revestidas com 0,1 mg / ml de poli-L-lisina, exceto para os experimentos de alongamento de células em que as câmaras de silicone foram pré-revestidas com 2% de gelatina.
Patch Clamp
O registro de clamp de corrente de célula inteira foi obtido por um amplificador de patch clamp EPC7 (HEKA, Alemanha). As pipetas de patch com resistência 3–5 MΩ foram preenchidas com solução de pipeta (em mM): 130 K-gluconato, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 por KOH. As células foram banhadas no fluido cerebroespinhal artificial (ACSF) (em mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glicose, equilibrado com carbogênio (95% O2 e 5 % CO2). Na gravação de grampo atual, as células foram mantidas em seu potencial de membrana em repouso. Um sistema de grampo de pressão de alta velocidade (HSPC-1, ALA Scientific Instruments, EUA) foi usado para fornecer pressão positiva à célula por meio de micropipeta. As gravações foram amostradas a 50 kHz e filtradas a 5 kHz. Os dados foram analisados com PulseFit (HEKA). Todos os experimentos foram realizados à temperatura ambiente.
Calcium Imaging
A medição do Ca2 + citosólico foi realizada conforme descrito em outro lugar (Wong et al., 2010). Resumidamente, as células foram carregadas com 5 μM Fluo-4 / AM por 40 min. A medição do Ca2 + citosólico foi realizada com solução tamponada com HEPES (em mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glicose, pH 7,4 por NaOH. A alteração de Ca2 + citosólica em resposta ao alongamento uniaxial foi realizada com STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). As células foram estimuladas por 10, 20 ou 30% do alongamento unidirecional por 1 s. A resposta citosólica de Ca2 + foi medida à temperatura ambiente. A fluorescência do Fluo-4 foi registrada e analisada pelo sistema de imagem confocal de varredura a laser FV1000. A alteração na resposta de fluorescência de Ca2 + citosólica foi expressa como uma razão (Fx / F0) de fluorescência em tempo real, onde Fx é o sinal fluo-4 / AM em tempo real e F0 é o sinal fluo-4 / AM de linha de base antes do alongamento.
Registro da atividade nervosa
Os ratos foram anestesiados com 100 mg / kg de pentobarbital de sódio. A área cervical foi exposta por incisão mediana. A artéria carótida direita foi isolada e canulada por um cateter conectado ao transdutor de pressão (ML221, ADInstruments, EUA) para registro da pressão arterial. A veia femoral esquerda foi canulada para injeção de fenilefrina e SNP. O nervo depressor aórtico esquerdo ou nervo do seio carotídeo foi conectado a um eletrodo de prata bipolar, seguido por um amplificador (Model 1700 Differential AC Amplifier, A-M Systems Inc., EUA). Tanto a pressão arterial quanto a atividade nervosa foram continuamente registradas pelo Quadro 5.0 (instrumentos AD). A atividade do nervo foi amplificada 10.000 vezes e filtrada em banda de 100–5000 Hz. Os valores da pressão arterial média, frequência cardíaca e frequência de pico em resposta à fenilefrina foram analisados pelo software Chart 5.0. Mudança na frequência de pico (frequência de pico após fenilefrina – frequência de pico antes da fenilefrina) em resposta à alteração máxima da pressão arterial (pressão arterial média após fenilefrina – pressão arterial média antes da fenilefrina) após injeção de fenilefrina foi calculada (Lau et al., 2016) .
Análise estatística
Traços representativos foram plotados como traços de curso do tempo. Os dados de todos os experimentos foram resumidos em um gráfico de barras que foi expresso em média ± sem de experimentos individuais. O teste t de Student foi usado para análise estatística. O teste t pareado foi usado quando apropriado.
Resultados
Propriedades de neurônios depressores da aorta e neurônios do seio carotídeo
Dil foi aplicado no nervo depressor aórtico ou no nervo do seio carotídeo. Portanto, os neurônios marcados com Dil no gânglio nodoso incluíam os neurônios barorreceptores que inervam o arco aórtico e os neurônios quimiorreceptores que inervam o corpo aórtico. Por outro lado, neurônios marcados com Dil em O gânglio petroso incluiu os neurônios barorreceptores que inervam o seio carotídeo e os neurônios quimiorreceptores que inervam o corpo carotídeo. Primeiro investigamos as propriedades básicas desses neurônios com marcador Dil. Neurônios marcados com DII em gânglios nodosos e petrosos foram cultivados separadamente e submetidos a uma corrente elétrica despolarizante mostrado na Figura 2. Dois tipos de respostas foram registrados, um respondeu com um único potencial de ação e o outro com potenciais de ação contínuos após a corrente despolarizante (Figura 2) (Belmonte e Gallego, 1983). Esses neurônios foram posteriormente submetidos a um protocolo de pressão hidrostática para testar sua sensibilidade às mudanças na pressão hidrostática. Uma rampa de pressão hidrostática positiva foi aplicada intracelularmente através de uma micropipeta de vidro pelo sistema de grampo de pressão de alta velocidade (HSPC-1, ALA Scientific Instruments, EUA) até que os potenciais de ação fossem eliciados. Os resultados mostraram que 45% dos neurônios barorreceptores aórticos dispararam potenciais de ação contínua em resposta à corrente elétrica despolarizante (Tabela 1A). Dentre eles, 91% (41% / 45%) também responderam à mudança de pressão hidrostática e apresentaram disparos de potencial de ação dependente da pressão (Tabela 1A). Os 55% restantes dos neurônios barorreceptores aórticos dispararam apenas um único potencial de ação em resposta à corrente despolarizante (Tabela 1A) e, entre eles, 40% (22% / 55%) poderiam responder à mudança de pressão (Tabela 1A). Para os neurônios barorreceptores carotídeos, 45% das células deram potenciais de ação contínua quando estimuladas pela corrente despolarizante (Tabela 1B). Dentre eles, 82% (37% / 45%) também foram sensíveis à mudança de pressão (Tabela 1B). Além disso, entre os neurônios barorreceptores carotídeos que dispararam apenas um único potencial de ação em resposta à corrente de despolarização, 24% (13% / 55%) poderiam responder à mudança de pressão (Tabela 1B).
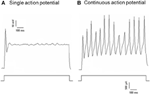
Figura 2. Registro do potencial de ação de cultura de neurônios depressor aórtico e seio carotídeo. São mostrados os traços de potenciais de ação que foram registrados a partir de dois neurônios representativos do depressor aórtico / seio carotídeo em uma corrente despolarizante. (A) Neurônios representativos que disparam apenas um único potencial de ação com a estimulação atual; (B) Neurônios representativos que disparam apenas potenciais de ação contínuos com a estimulação atual. Painel inferior: protocolo para injeção de corrente. Barra de escala, horizontal, 100 ms, vertical, 10 mV (traços superiores) e 500 pA (traços inferiores). n = 27 e n = 38 para neurônios depressor aórtico e seio carotídeo respectivamente.

Tabela 1. Propriedades dos neurônios depressores da aorta e do seio carotídeo.
Independentemente de dispararem um único potencial de ação ou potenciais de ação contínua, 63% dos neurônios barorreceptores aórticos marcados com Dil foram considerados sensíveis à mudança de pressão, enquanto apenas 50% dos neurônios barorreceptores da carótida marcados com Dil eram sensíveis ao alteração da pressão (Tabela 1).
Sensibilidade de alongamento dos neurônios barorreceptores da aorta e da carótida
O limiar de pressão para a descarga do potencial de ação foi analisado. Conforme mostrado na Figura 3, os neurônios barorreceptores da aorta tinham um limiar de pressão mais baixo (24 ± 4 mmHg) do que os neurônios barorreceptores da carótida (39 ± 4 mmHg).

Figura 3. Sensibilidades dos neurônios barorreceptores da aorta e da carótida à pressão hidrostática. (A, B) Painel superior, traços representativos do curso do tempo que ilustram os disparos do potencial de ação dependente da pressão nos neurônios barorreceptores da aorta (A) e da carótida (B). A rampa de pressão (painel inferior) foi aplicada no interior das células por meio de uma micropipeta usando um sistema de grampo de pressão de alta velocidade (HSPC). Barra de escala horizontal, 1 s, vertical, 20 mV e 20 mmHg. (C) Resumo mostrando o limiar de pressão que inicia os disparos do potencial de ação nos neurônios barorreceptores da aorta e da carótida. n = 13 para neurônios barorreceptores aórticos en = 15 para neurônios barorreceptores carotídeos. *** p < 0,01, pelo teste t de Student.
Resposta induzida por estiramento de Ca2 + em neurônios barorreceptores
Cultivados depressor aórtico ou neurônios do seio carotídeo foram submetidos a 10, 20 ou 30% do alongamento uniaxial pelo STREX Cell Stretching System, tentando imitar o alongamento do vaso sanguíneo sob pressão sanguínea. Os resultados mostraram que um alongamento uniaxial de 20% induziu um aumento acentuado na fluorescência de Ca2 + citosólica em neurônios barorreceptores aórticos, mas não em neurônios barorreceptores carotídeos (Figuras 4A-C). Além disso, a magnitude do aumento da fluorescência de Ca2 + em resposta ao alongamento uniaxial de 30% foi muito maior nos neurônios barorreceptores da aorta do que nos neurônios barorreceptores da carótida (Figuras 4A-C).
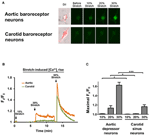
Figura 4. Sensibilidades dos neurônios depressores aórticos e do seio carotídeo ao alongamento uniaxial. As células foram carregadas com corante fluorescente sensível a Ca2 + Fluo-4 / AM. São mostradas imagens representativas (A) e traços de curso de tempo (B) de aumentos de Ca2 + citosólico relativo em resposta ao alongamento uniaxial de 10, 20 e 30% do comprimento da célula em neurônios depressores aórticos e do seio carotídeo. (C) Resumo do aumento citosólico máximo de Ca2 + em resposta a diferentes graus de alongamento. A mudança no Ca2 + citosólico foi expressa como Fx / F0, onde Fx é o sinal fluo-4 / AM em tempo real e F0 é o sinal fluo-4 / AM da linha de base antes do alongamento. Média ± s.e.m. (n = 5). * p < 0,05, *** p < 0,01 em comparação com o controle correspondente, por teste t pareado.
Atividade do nervo barorreceptor in vivo
A atividade nervosa dos dois barorreceptores foi investigada in vivo. A fenilefrina foi injetada por via intravenosa. As mudanças na pressão sanguínea após a aplicação de fenilefrina são mostradas no painel superior das Figuras 5A, B. As mudanças subsequentes na atividade do nervo barorreceptor são mostradas no painel inferior (Figuras 5A, B). A atividade do nervo induzida pela pressão foi muito maior no nervo depressor da aorta do que no nervo do seio carotídeo (Figuras 5A, B). A mudança na frequência de pico por aumento de mmHg está resumida na Figura 5C. O resultado indicou que os barorreceptores aórticos são mais sensíveis à pressão hidrostática do que os barorreceptores carotídeos in vivo.
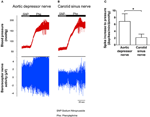
Figura 5. Atividade do nervo barorreceptor em ratos in vivo. (A, B) Traços representativos mostrando a mudança na atividade do nervo depressor aórtico (A) e do nervo do seio carotídeo (B) com a elevação da pressão arterial. Em ambos (A, B), o painel superior era a mudança na pressão arterial antes e após a aplicação de Phe, conforme indicado pelas barras horizontais. O painel inferior foi a mudança correspondente na atividade nervosa. (C) Dados resumidos mostrando a mudança na atividade do nervo por unidade de mudança da pressão arterial. Média ± s.e.m. (n = 8). * p < 0,05 em comparação com o controle em barorreceptores aórticos, por teste t pareado.
Expressão de canais TRP
Vários canais TRP foram relatados como sensíveis à mecânica, incluindo TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O “Neil e Heller, 2005; Christensen e Corey, 2007; Pedersen e Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Aqui, investigamos o possível papel desses canais TRP mecanossensíveis em relação à aorta e sensibilidade do barorreceptor carotídeo. As expressões de mRNA desses canais nos gânglios nodoso e petroso foram comparadas. Verificou-se que as expressões de TRPV4 e TRPC6 foram maiores no gânglio nodoso em comparação ao petroso (Figura 6). É possível que quanto maior a expressão de canais mecanossensíveis no gânglio nodoso pode contribuir para a maior sensibilidade.
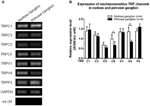
Figura 6. Expressão de canais TRP mecanossensíveis em gânglio nodoso e petroso. (A) Imagens de gel representativas comparando o nível de expressão de mRNA de canais TRP mecanossensíveis, (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) entre neurônios ganglionares nodosos e petrosos. A análise de RT-PCR semiquantitativa foi usada para comparar os níveis de expressão de mRNA de vários canais de TRP em relação à expressão de mRNA de GAPDH. Os resultados de 9 experiências foram resumidos em (B). Os valores estavam em média ± sem. * p < 0,05, por teste t pareado.
Discussão
No presente estudo, as propriedades mecanossensíveis dos barorreceptores da aorta e da carótida foram comparadas. Estudos de patch clamp de células inteiras mostraram que, em comparação com os neurônios do seio carotídeo, uma porcentagem maior de neurônios depressores aórticos eram sensíveis ao estiramento. Além disso, o limiar de pressão que poderia iniciar disparos do potencial de ação foi encontrado para ser menor nos neurônios barorreceptores aórticos do que nos neurônios barorreceptores carotídeos. O aumento do Ca2 + citosólico induzido pelo alongamento uniaxial também foi comparado entre os neurônios depressor aórtico e do seio carotídeo.A magnitude do aumento do Ca2 + citosólico em resposta ao alongamento uniaxial foi muito maior nos neurônios barorreceptores da aorta do que nos neurônios barorreceptores da carótida. Os neurônios barorreceptores aórticos também exibiram um limiar mais baixo de respostas de Ca2 + citosólico ao alongamento uniaxial. Em outra série de experimentos, descobrimos que o aumento induzido pela pressão nos disparos do potencial de ação era maior no nervo depressor aórtico do que no nervo do seio carotídeo. Juntos, nossos dados fornecem fortes evidências de que os barorreceptores aórticos são mais sensíveis à pressão sanguínea do que os barorreceptores carotídeos.
Anteriormente, muito esforço foi feito para compreender a diferença de sensibilidades entre os dois barorreceptores. No entanto, os resultados são controversos. Alguns relatórios concluíram que os barorreceptores da aorta são mais sensíveis à mudança de pressão (Glick e Covell, 1968; Fan et al., 1996; Pickering et al., 2008), enquanto outros afirmaram que os barorreceptores da carótida são mais sensíveis à mudança de pressão (Donald e Edis, 1971; Fadel et al., 2003). No entanto, quase todos esses estudos anteriores envolveram procedimentos cirúrgicos altamente complicados e, em última análise, utilizaram respostas barorreflexas, como frequência cardíaca e débito simpático renal, como pontos finais para o ensaio de sensibilidade dos barorreceptores. Procedimentos cirúrgicos complicados estão sujeitos a erros experimentais, que podem resultar em conclusões controversas. Além disso, a variação dependente da espécie animal na sensibilidade dos barorreceptores também é possível. Além disso, a resposta barorreflexa não é influenciada apenas pela sensibilidade dos barorreceptores, mas também por vários outros fatores, incluindo condução nervosa, mediação central, contratilidade dos vasos sanguíneos e função cardíaca. Portanto, a evidência de estudos anteriores é indireta e dificilmente ideal. Até o momento, faltam estudos diretos comparando a sensibilidade à pressão dos neurônios barorreceptores da aorta e da carótida. Neste estudo, a mecanossensibilidade foi estudada diretamente nos neurônios barorreceptores. Os dados sugerem fortemente que os barorreceptores aórticos são mais sensíveis à pressão do que os barorreceptores carotídeos. Esta informação pode ter relevância fisiológica importante na regulação da pressão arterial.
Não está claro quais mecanismos estão por trás da diferença na sensibilidade à pressão entre os barorreceptores da aorta e da carótida. Comparamos o nível de expressão de vários canais TRP mecanossensíveis (Figura 6) (O “Neil e Heller, 2005; Christensen e Corey, 2007; Pedersen e Nilius, 2007; Patel et al., 2010). Nossos resultados mostraram que os neurônios barorreceptores da aorta têm uma maior expressão de vários canais TRP mecanossensíveis, incluindo TRPV4 e TRPC6. É possível que uma maior expressão de TRPV4 e / ou TRPC6 possa contribuir para a alta sensibilidade à pressão dos barorreceptores aórticos. Mais estudos são necessários para verificar o papel desses canais iônicos.
Foi relatado anteriormente que o gânglio nodoso e o gânglio petroso contêm dois tipos diferentes de neurônios (Belmonte e Gallego, 1983). Um deles fornece potenciais de ação contínuos sob estimulação elétrica, enquanto o outro fornece apenas uma única ação potencial após a estimulação. Os autores atribuíram os primeiros como neurônios sensíveis à pressão e os segundos como neurônios sensíveis à quimio. Nossos resultados indicam que pode não ser apropriado te para designar os neurônios sensíveis à pressão e os neurônios insensíveis à pressão apenas com base no fato de eles dispararem um único potencial de ação ou potenciais de ação contínuos em resposta à corrente despolarizante. Na verdade, uma grande porcentagem de células que disparam um único potencial de ação em resposta à estimulação elétrica também são sensíveis à pressão e, portanto, pertencem aos neurônios barorreceptores sensores de pressão (Figura 2 e Tabela 1).
Em resumo, o presente estudo fornece evidências de que os barorreceptores da aorta são mais sensíveis à pressão do que os barorreceptores da carótida e adiciona novas informações para a compreensão da fisiologia básica.
Contribuições dos autores
EL e XY projetam os experimentos e esboçam o manuscrito. EL, CL e YY realizam os experimentos. XY, YH, AM e LJ revisaram o manuscrito. Todos os autores aprovaram a versão final do manuscrito.
Financiamento
Este trabalho foi financiado por doações do Comitê de Bolsas de Pesquisa de Hong Kong CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, Subsídio 31470912 da China National Science Foundation e RGC-NSFC Joint Grant N_CUHK439 / 13.
Declaração de conflito de interesses
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
James, JEA e Daly, MDB (1970). Comparação das respostas vasomotoras reflexas à estimulação separada e combinada dos barorreceptores do seio carotídeo e do arco aórtico por pressões pulsáteis e não pulsáteis em cães. J. Physiol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
Resumo PubMed | CrossRef Full Text | Google Scholar
Levy MN, P. A. (2007). Fisiologia Cardiovascular. Filadélfia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. e Luciano, D. S. (1998). Fisiologia Humana: o Mecanismo da Função Corporal. Boston, MA: WCB McGraw-Hill.