Geologia Física (Português)
A grande maioria dos minerais que constituem as rochas da crosta terrestre são minerais de silicato. Isso inclui minerais como quartzo, feldspato, mica, anfibólio, piroxênio, olivina e uma grande variedade de minerais de argila. O bloco de construção de todos esses minerais é o tetraedro de sílica, uma combinação de quatro átomos de oxigênio e um átomo de silício. Eles são organizados de forma que os planos traçados através dos átomos de oxigênio formem um tetraedro (Figura 2.6). Como o íon de silício tem uma carga de +4 e cada um dos quatro íons de oxigênio tem uma carga de –2, o tetraedro de sílica tem uma carga líquida de –4.
Nos minerais de silicato, esses tetraedros são arranjados e ligados entre si de várias maneiras, de unidades únicas a estruturas complexas (Figura 2.9). A estrutura de silicato mais simples, a do mineral olivina, é composta por tetraedros isolados ligados a íons de ferro e / ou magnésio. Na olivina, a carga -4 de cada tetraedro de sílica é balanceada por dois cátions divalentes (isto é, +2) de ferro ou magnésio. A olivina pode ser Mg2SiO4 ou Fe2SiO4, ou alguma combinação dos dois (Mg, Fe) 2SiO4. Os cátions divalentes de magnésio e ferro têm raios muito próximos (0,73 contra 0,62 angstroms). Devido a essa semelhança de tamanho e porque ambos são cátions divalentes (ambos têm carga de +2), o ferro e o magnésio podem substituir-se prontamente na olivina e em muitos outros minerais.
| Configuração do tetraedro | Minerais de exemplo | |
|---|---|---|
 |
Isolado (nesossilicatos) | Olivina, granada, zircão, cianita |
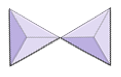 |
Pares (sorosilicatos) | Epidoto, zoisita |
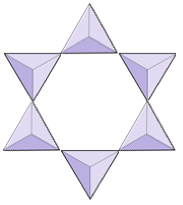 |
Anéis (ciclosilicatos) | Turmalina |
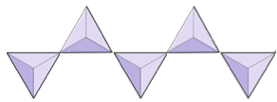 |
Cadeias simples (inosilicatos) | Piroxênios, wollastonita |
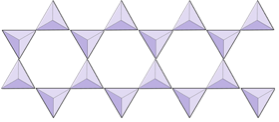 |
Cadeias duplas (inosilicatos) | Anfibólios |
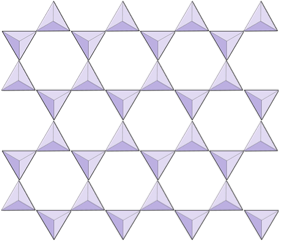 |
Folhas (filossilicatos) | Micas, minerais de argila, serpentina, clorito |
| tridimensional estrutura | Estrutura (tectossilicatos) | Feldspatos, quartzo, zeólito |
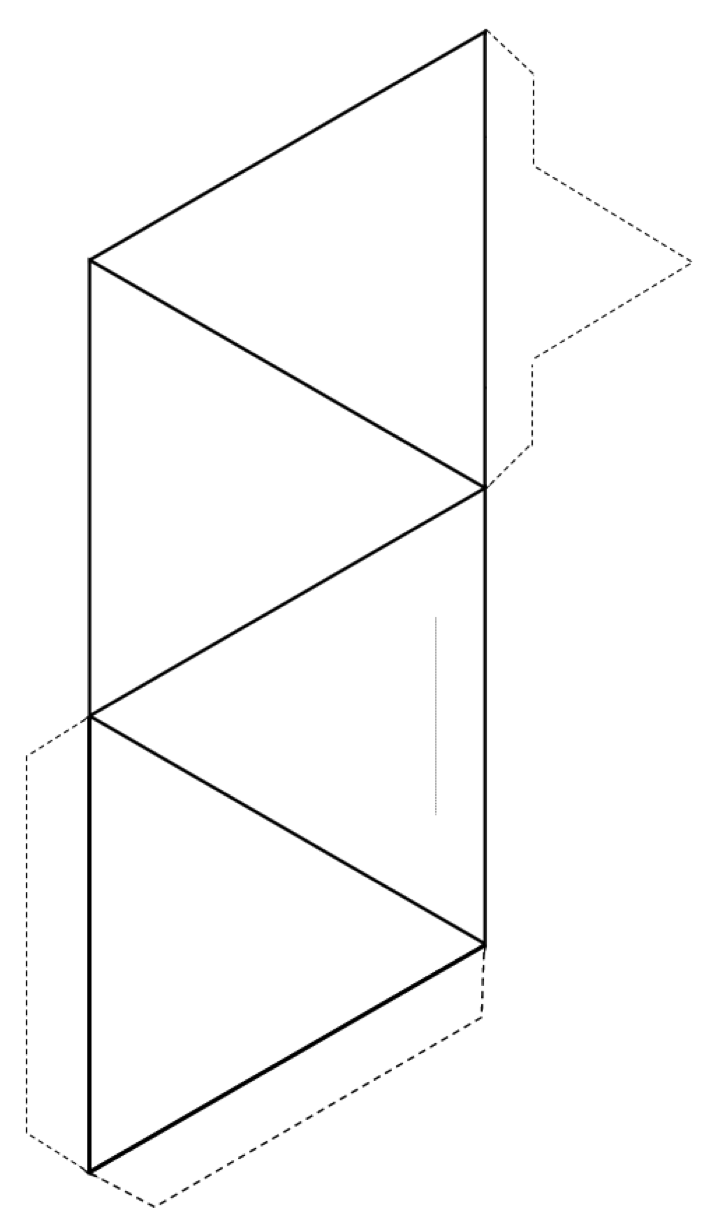
Exercício 2.3 Faça um tetraedro
Corte ao redor da parte externa da forma (linhas sólidas e linhas pontilhadas) e dobre ao longo das linhas sólidas para formar um tetraedro.
Se você tiver cola ou fita, prenda o guias para o tetraedro para mantê-lo unido. Se você não tiver cola ou fita adesiva, faça um corte ao longo da linha cinza fina e insira a aba pontiaguda na fenda.
Se você estiver fazendo isso em uma sala de aula, tente unir seu tetraedro com outros em pares, anéis, cadeias simples e duplas, folhas e até estruturas tridimensionais.
Na olivina, ao contrário da maioria dos outros minerais de silicato, os tetraedros de sílica não estão ligados a cada um outro. Eles estão, no entanto, ligados ao ferro e / ou magnésio, conforme mostrado na Figura 2.10.
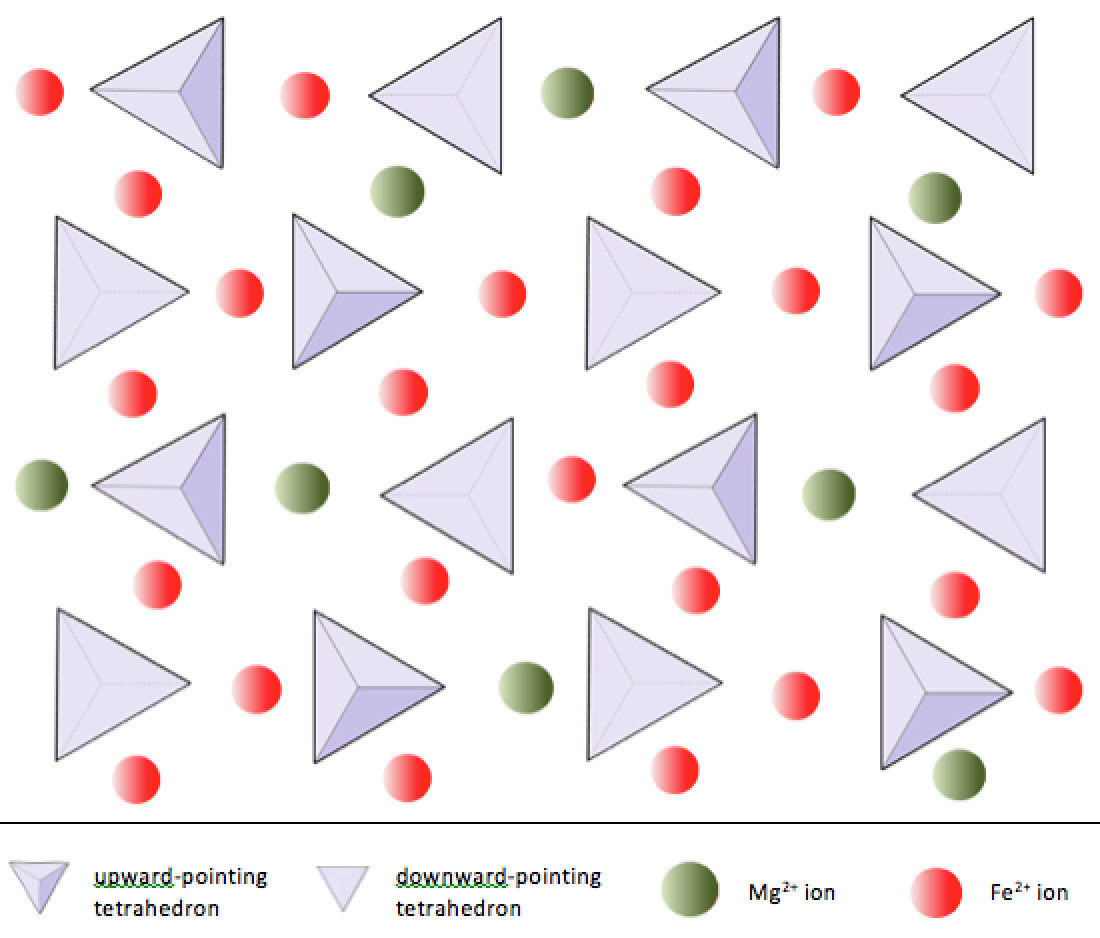
Como já observado, os íons +2 de ferro e magnésio são semelhantes em tamanho (embora não sejam exatamente os mesmos). Isso permite que eles se substituam em alguns minerais de silicato. Na verdade, os íons comuns em minerais de silicato têm uma ampla gama de tamanhos, como mostrado na Figura 2.11. Todos os íons mostrados são cátions, exceto o oxigênio. Observe que o ferro pode existir como íon +2 (se perder dois elétrons durante a ionização) ou como íon +3 (se perder três). Fe2 + é conhecido como ferro ferroso. Fe3 + é conhecido como ferro férrico. Os raios iônicos são essenciais para a composição dos minerais de silicato, por isso nos referiremos a este diagrama novamente.

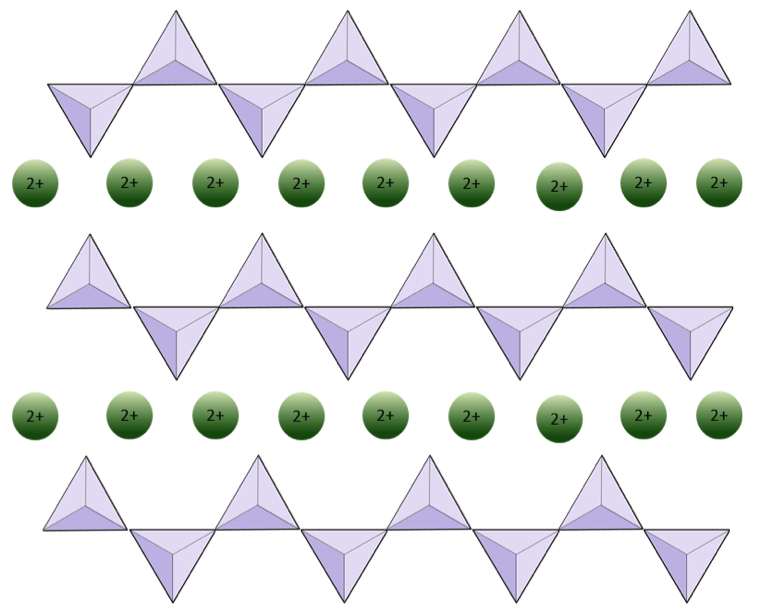
A estrutura da cadeia única piroxênio de silicato é mostrado nas Figuras 2.12 e 2.13. No piroxênio, os tetraedros de sílica estão ligados entre si em uma única cadeia, onde um íon de oxigênio de cada tetraedro é compartilhado com o tetraedro adjacente, portanto, há menos oxigênios na estrutura.O resultado é que a proporção de oxigênio para silício é menor do que na olivina (3: 1 em vez de 4: 1), e a carga líquida por átomo de silício é menor (–2 em vez de –4), uma vez que menos cátions são necessários para equilibrar essa carga. As composições de piroxênio são do tipo MgSiO3, FeSiO3 e CaSiO3, ou alguma combinação destes. O piroxênio também pode ser escrito como (Mg, Fe, Ca) SiO3, onde os elementos entre colchetes podem estar presentes em qualquer proporção. Em outras palavras, o piroxênio tem um cátion para cada tetraedro de sílica (por exemplo, MgSiO3), enquanto a olivina tem dois (por exemplo, Mg2SiO4). Como cada íon de silício é +4 e cada íon de oxigênio é –2, os três oxigênios (–6) e um silício (+4) fornecem uma carga líquida de –2 para a cadeia única de tetraedro de sílica. No piroxênio, um cátion divalente (2+) por tetraedro equilibra essa carga -2. Na olivina, são necessários dois cátions divalentes para equilibrar a carga –4 de um tetraedro isolado.
A estrutura do piroxênio é mais “permissiva” do que a da olivina – o que significa que cátions com uma gama mais ampla de raios iônicos pode caber nele. É por isso que os piroxênios podem ter cátions de ferro (raio 0,63 Å) ou magnésio (raio 0,72 Å) ou cálcio (raio 1,00 Å).
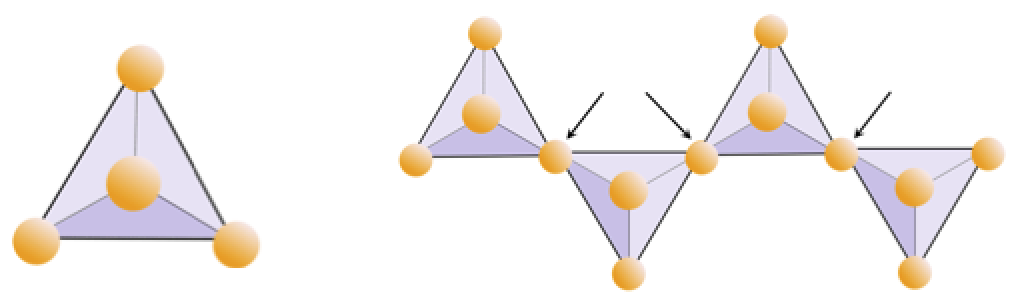
Exercício 2.4 Privação de oxigênio
O diagrama abaixo representa uma única cadeia em um mineral de silicato. Conte o número de tetraedros versus o número de íons de oxigênio (esferas amarelas). Cada tetraedro tem um íon de silício, então isso deve dar a razão de Si para O em silicatos de cadeia simples (por exemplo, piroxênio).
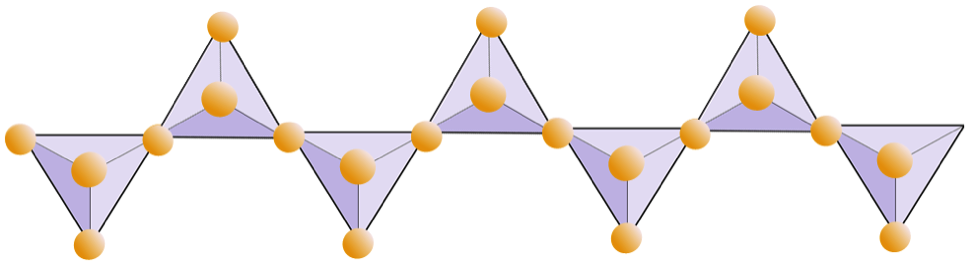
O diagrama abaixo representa uma cadeia dupla em um mineral de silicato. Novamente, conte o número de tetraedros versus o número de íons de oxigênio. Isso deve fornecer a proporção de Si para O em silicatos de cadeia dupla (por exemplo, anfibólio).
Em estruturas de anfibólio, os tetraedros de sílica estão ligados em uma cadeia dupla que tem uma proporção de oxigênio para silício inferior à do piroxênio e, portanto, ainda menos cátions são necessários para equilibrar a carga. O anfibólio é ainda mais permissivo que o piroxênio e suas composições podem ser muito complexas. Hornblenda, por exemplo, pode incluir sódio, potássio, cálcio, magnésio, ferro, alumínio, silício, oxigênio, flúor e o íon hidroxila (OH–).
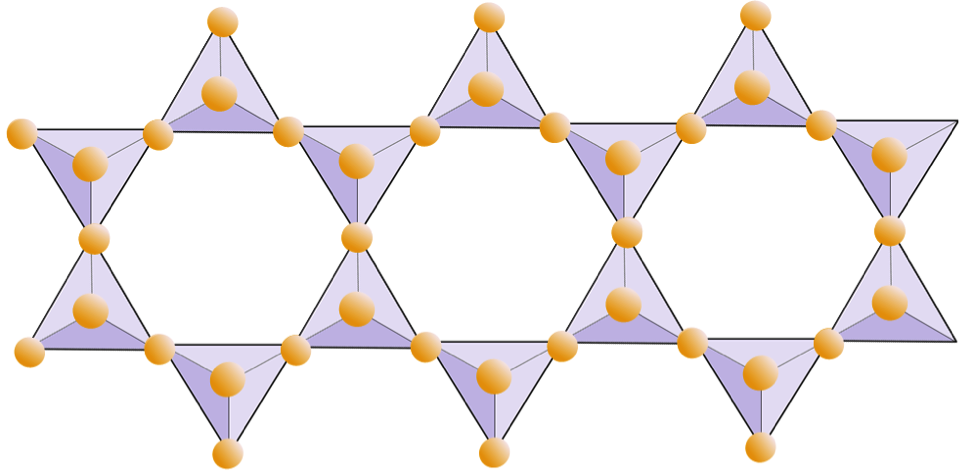
Em estruturas de mica, o tetraedros de sílica são arranjados em folhas contínuas, onde cada tetraedro compartilha três ânions de oxigênio com tetraedros adjacentes. Há ainda mais compartilhamento de oxigênios entre tetraedros adjacentes e, portanto, menos cátions de equilíbrio de carga são necessários para minerais de silicato de folha. A união entre as folhas é relativamente fraca, e isso explica a clivagem unidirecional bem desenvolvida (Figura 2.14). A mica biotita pode conter ferro e / ou magnésio, o que a torna um mineral de silicato ferromagnésio (como olivina, piroxênio e anfibólio). O clorito é outro mineral semelhante que comumente inclui magnésio. Na mica muscovita, os únicos cátions presentes são o alumínio e o potássio; portanto, é um mineral de silicato não ferromagnesiano.

Além da muscovita, biotita e clorita, existem muitos outros silicatos de folha (ou filossilicatos), que geralmente existem como fragmentos do tamanho de argila (ou seja, menos de 0,004 mm). Estes incluem os minerais de argila caulinita, ilita e esmectita e, embora sejam difíceis de estudar devido ao seu tamanho muito pequeno, eles são componentes extremamente importantes das rochas e especialmente dos solos.
Todo o silicato de folha os minerais também têm água em sua estrutura.
Os tetraedros de sílica estão ligados em estruturas tridimensionais tanto no feldspato quanto no quartzo. Estes são minerais não ferromagnesianos – eles não contêm ferro ou magnésio.Além dos tetraedros de sílica, os feldspatos incluem os cátions alumínio, potássio, sódio e cálcio em várias combinações. O quartzo contém apenas tetraedros de sílica.
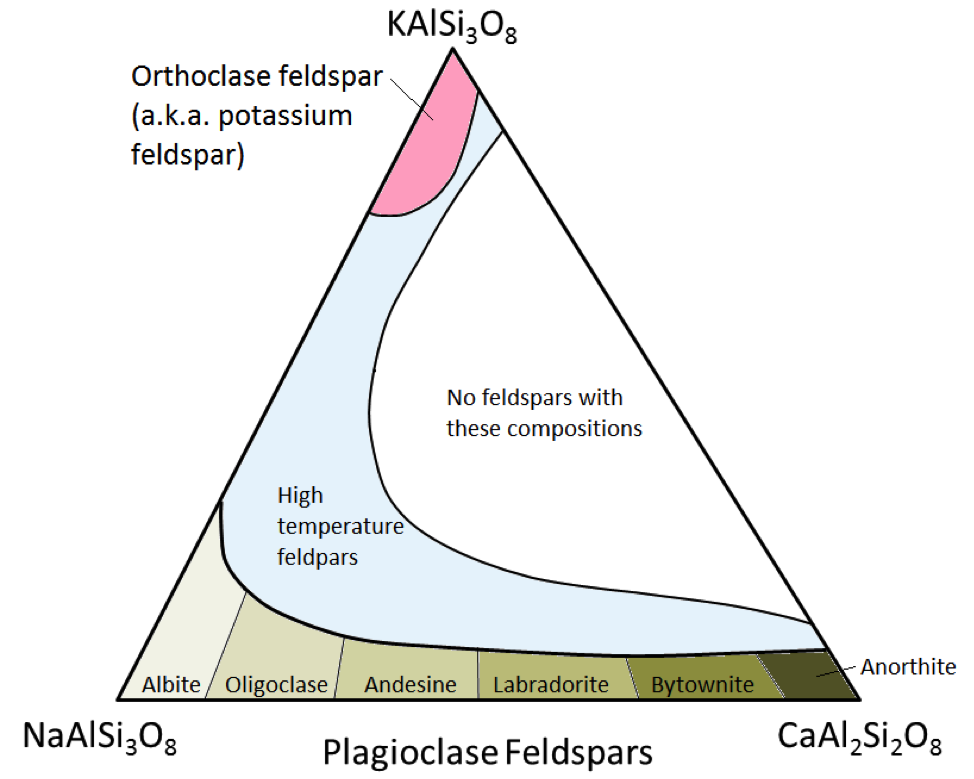
Os três principais minerais de feldspato são o feldspato de potássio (também conhecido como feldspato K ou K-spar) e dois tipos de feldspato de plagioclásio: albita (apenas sódio) e anortita (apenas cálcio) . Como é o caso do ferro e do magnésio na olivina, existe uma faixa contínua de composições (séries de solução sólida) entre a albita e a anortita no plagioclásio. Isso ocorre porque os íons de cálcio e sódio são quase idênticos em tamanho (1,00 Å versus 0,99 Å). Qualquer composição intermediária entre CaAl2Si3O8 e NaAlSi3O8 pode existir (Figura 2.15). Isso é um pouco surpreendente porque, embora sejam muito semelhantes em tamanho, os íons de cálcio e sódio não têm a mesma carga (Ca2 + versus Na +). Este problema é explicado pela substituição correspondente de Al3 + por Si4 +. Portanto, a albita é NaAlSi3O8 (um Al e três Si) enquanto a anortita é CaAl2Si2O8 (dois Al e dois Si), e os feldspatos de plagioclásio de composição intermediária possuem proporções intermediárias de Al e Si. Isso é chamado de “substituição acoplada”.
Os feldspatos de plagioclásio de composição intermediária são oligoclases (10% a 30% de Ca), andesina (30% a 50% de Ca), labradorita (50% a 70 % Ca) e bytownita (70% a 90% Ca). K-feldspato (KAlSi3O8) tem uma estrutura ligeiramente diferente da do plagioclásio, devido ao tamanho maior do íon potássio (1,37 Å) e devido a este tamanho grande , potássio e sódio não se substituem prontamente, exceto em altas temperaturas. Esses feldspatos de alta temperatura são provavelmente encontrados apenas em rochas vulcânicas porque as rochas ígneas intrusivas esfriam lentamente o suficiente para atingir baixas temperaturas para que os feldspatos se transformem em um dos formas de baixa temperatura.
No quartzo (SiO2), os tetraedros de sílica são ligados em uma estrutura tridimensional “perfeita”. Cada tetraedro está ligado a quatro outros tetraedros (com um oxigênio compartilhado em cada canto de cada tetraedro) e, como resultado, a proporção de silício para oxigênio é de 1: 2. Como o cátion de silício tem uma carga +4 e os dois ânions de oxigênio cada um tem uma carga –2, a carga é balanceada. Não há necessidade de alumínio ou qualquer outro cátion, como sódio ou potássio. A dureza e a falta de clivagem no quartzo resultam das fortes ligações covalentes / iônicas características do tetraedro de sílica.
Exercício 2.5 Silicatos ferromagnesianos?
Os minerais de silicato são classificados como ferromagnesianos ou não ferromagnesianos, dependendo de terem ou não ferro (Fe) e / ou magnésio (Mg) em sua fórmula. Vários minerais e suas fórmulas estão listados abaixo. Para cada um, indique se é ou não um silicato ferromagnesiano.
| Mineral | Fórmula | Silicato Ferromagnesiano? |
|---|---|---|
| olivina | (Mg, Fe) 2SiO4 | |
| pirita | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| piroxênio | MgSiO3 | |
| hematita | Fe2O3 | |
| ortoclase | KAlSi3O8 | |
| quartzo | SiO2 |
| Mineral | Fórmula * | Silicato ferromagnesiano? |
|---|---|---|
| anfibólio | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetita | Fe3O4 | |
| biotita | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomita | (Ca, Mg) CO3 | |
| granada | Fe2Al2Si3O12 | |
| serpentina | Mg3Si2O5 (OH) 4 |
* Algumas das fórmulas, especialmente as mais complicadas, foram simplificadas.
- Um angstrom é a unidade comumente usada para a expressão de atômico -escala dimensões. Um angstrom é de 10–10 m ou 0,0000000001 m. O símbolo de um angstrom é Å. ↵