Revistas | Política | Permissão Pesquisa Gastroenterologia
Previsibilidade da Metaplasia Gástrica Intestinal por Eritema Manchado e Manchado Visto na Endoscopia
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
aDepartamento de Gastroenterologia e Hepatologia, Centro Nacional de Saúde e Medicina Global (NCGM), Tóquio, Japão
bDepartamento de Pesquisa Clínica e Informática International Clinical Research Center Institute, NCGM, Tóquio, Japão
cDivisão de Medicina Interna, Kosin University College of Medicine, Busan, Coréia
dDepartamento de Gastroenterologia e Hepatologia, Wakayama Medical University, Wakayama, Japão
eDepartment of Clinical Laboratory Pathological Division, NCGM, Tokyo, Japan
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Japão
g Autor correspondente: Naoyoshi Nagata, Department of G astroenterologia e Hepatologia, Centro Nacional de Saúde e Medicina Global, 1-21-1 Toyama, Shinjuku-ku, Tóquio 162-8655, Japão
Manuscrito aceito para publicação em 26 de setembro de 2011
Título abreviado: Diagnóstico endoscópico de metaplasia intestinal
doi: https://doi.org/10.4021/gr357w
- Resumo
- Introdução
- Métodos
- Resultados
- Discussão
| Abstrato | ▴Top |
Antecedentes: A metaplasia intestinal (IM) é considerada uma lesão pré-maligna. No entanto, o diagnóstico endoscópico de MI tem sido considerado difícil. Usando a endoscopia, encontramos um padrão único de eritema, “Eritema manchado de manchas (MPE)”, que inclui MI grave. A própria infecção pelo Helicobacter pylori (Hp) pode causar eritema, que reflete alterações histológicas na mucosa gástrica. Portanto, inscrevemos a erradicação do Hp pacientes para validar a relação entre MPE e achados patológicos.
Métodos: Foram incluídos pacientes com gastrite crônica que foram submetidos à erradicação do Hp com sucesso pelo menos 6 meses antes do estudo. Definimos MPE como múltiplas lesões eritematosas planas ou deprimidas. Ao encontrar MPE na endoscopia, realizamos biópsia tanto no local MPE quanto no local não MPE. O local não MPE foi definido como uma mucosa adjacente localizada dentro de 3 cm do local MPE. Todas as amostras de biópsia foram avaliadas imunoistoquimicamente para o subtipo IM usando Colorações de MUC2, MUC5AC, MUC6, CD10 e CDX2. O grau de IM foi definido de acordo com o Sistema Sydney Atualizado. A precisão do diagnóstico dos achados de MPE para IM patológico foi calculada. relação entre MPE e subtipo IM também foi avaliada.
Resultados: Um total de 102 pacientes foram selecionados para o estudo. Destes, 55 (54%) pacientes tinham MPE. As amostras de biópsia foram retiradas dos locais MPE e locais não MPE desses 55 pacientes. As porcentagens de IM e pontuações medianas de IM foram significativamente maiores nos locais MPE (P < 0,001) do que nos locais não MPE. A sensibilidade e especificidade para MPE na detecção de MI histológica foram 72,7% e 84,1%, respectivamente. Não foram observadas associações significativas na expressão de MUC2, MUC5AC, MUC6, CD10 e CDX2 entre os locais MPE e não MPE. Não houve diferenças significativas nas proporções (completo / incompleto) dos subtipos de IM entre os dois grupos.
Conclusões: MPE é um achado endoscópico útil para detectar IM histológico sem o uso de cromoendoscopia e endoscopia de aumento. No entanto, o subtipo IM é difícil de identificar. Na era da erradicação do Hp, o MPE tem o potencial de se tornar um achado preditivo para o risco de câncer gástrico.
Palavras-chave: Metaplasia intestinal; Lesão pré-maligna; Achado endoscópico; Eritema; Endoscopia de luz branca; Subtipo, erradicação; Helicobacter pylori
| Introdução | ▴Top |
Acredita-se que o desenvolvimento do câncer gástrico envolve um processo de várias etapas, incluindo infecção por Helicobacter pylori (Hp), gastrite crônica, atrofia glandular, metaplasia intestinal (IM) e, finalmente displasia. IM e atrofia gástrica são considerados fatores de risco para o desenvolvimento de câncer gástrico do tipo intestinal e são considerados lesões pré-malignas.A atrofia gástrica pode ser reconhecida por endoscopia e se correlaciona com a avaliação histológica. No entanto, o diagnóstico de MI usando a endoscopia de luz branca padrão foi considerado difícil devido à falta de distinção na cor da MI e sua presença como lesões planas múltiplas.
Recentemente , descobrimos que um achado eritematoso único na endoscopia pode ser observado mesmo após a erradicação do Hp. Descrevemos essa descoberta como “Eritema manchado e manchado (MPE)”. MPE pode ser reconhecida como múltiplas lesões eritematosas planas ou levemente deprimidas sob a endoscopia de luz branca padrão; patologicamente, inclui IM grave. A própria infecção pelo Hp pode causar eritema, visto na endoscopia, que reflete alterações histológicas, como infiltração de células inflamatórias e edema. Portanto , inscrevemos pacientes submetidos à erradicação do Hp para validar a relação entre MPE e achados patológicos.
| Métodos | ▴Top |
Seleção do paciente
Pacientes com gastrite crônica que foram submetidos à erradicação do Hp com sucesso pelo menos 6 meses antes do estudo foram prospectivamente inscritos para o estudo no Centro Nacional de Saúde e Medicina Global (NCGM) entre janeiro de 2008 e dezembro de 2008. Critérios de exclusão i incluiu o uso de antiinflamatórios não esteroidais (AINEs), antiácidos e antitrombóticos nas 4 semanas anteriores à endoscopia. Também excluímos pacientes com história de cirurgia gástrica, doença hemorrágica, cirrose hepática, insuficiência renal, insuficiência cardíaca e câncer gástrico precoce ou avançado. O consentimento informado por escrito foi obtido dos participantes de acordo com a Declaração de Helsinque e sua revisão subsequente. O protocolo do estudo foi aprovado pelo Comitê de Ética do NCGM.
Erradicação do Helicobacter pylori
Pacientes com gastrite crônica e úlcera péptica induzida por infecção por Hp foram submetidos à terapia de erradicação. Os pacientes foram tratados com um regime de 7 dias consistindo de amoxicilina, claritromicina e um inibidor da bomba de prótons (PPI) duas vezes ao dia, que era o regime de primeira linha padrão aprovado no Japão. Se a erradicação não fosse bem-sucedida, um segundo esquema consistindo de amoxicilina, metronidazol e PPI era administrado. A erradicação foi confirmada por exame histológico negativo das biópsias gástricas, juntamente com um teste respiratório com 13C-ureia negativo (13C-UBT) 2 a 3 meses após a conclusão da terapia de erradicação. Quando todos os testes foram negativos, um paciente foi definido como negativo para infecção por Hp.
Avaliação endoscópica
Pelo menos 6 meses após a erradicação do Hp, os pacientes foram submetidos a exame endoscópico. Utilizou-se um endoscópio de alta resolução sem aumento (videoscópio Olympus, modelo GIF-H260) para observar a presença de MPE na mucosa gástrica. Definimos MPE como múltiplas lesões eritematosas planas ou levemente deprimidas que eram distinguíveis de mucosa congestionada, hemorragia, angioectasia, eritema manchado e eritema linear (fig. 1A, B). Também distinguimos entre MPE e mucosa avermelhada com epitélio em regeneração acompanhado de úlcera ou cicatriz de úlcera.
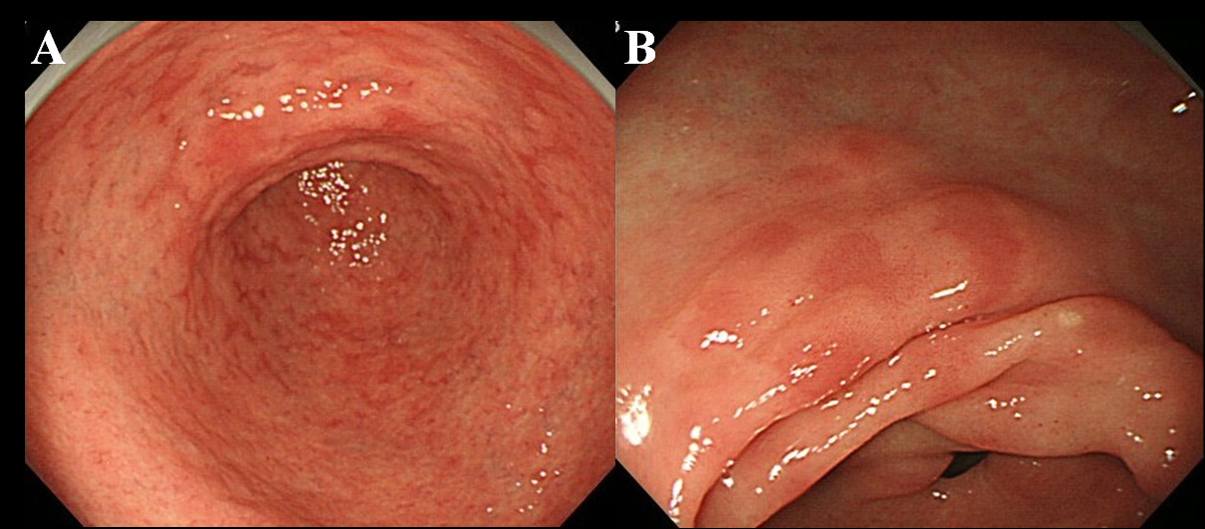 Clique para obter uma imagem grande |
Figura 1. Achado endoscópico de MPE. (A) Eritema múltiplo e plano no antro; (B) Eritema plano e deprimido na curvatura menor do antro. |
Ao encontrar um achado de MPE na endoscopia, realizamos biópsia tanto do local MPE quanto do local não MPE. O local não MPE foi definido como uma mucosa adjacente localizada dentro de 3 cm do local MPE (Fig. 2).
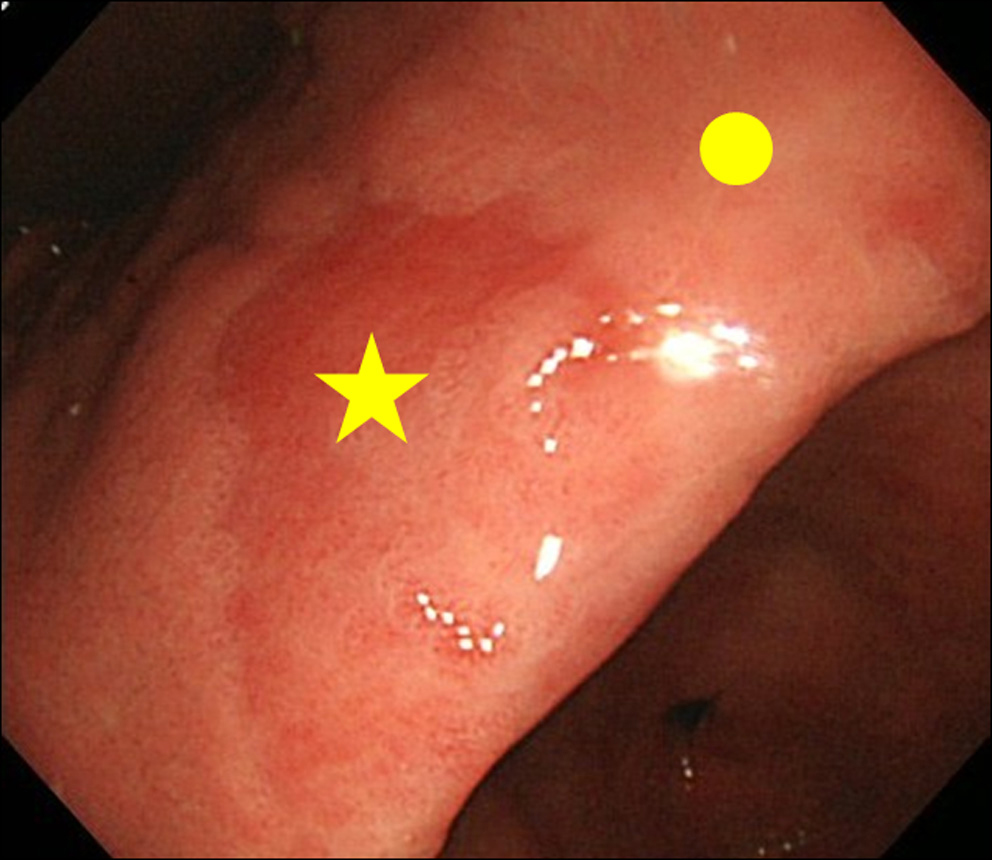 Clique para obter uma imagem grande |
Figura 2. Local da biópsia. (★) Local de biópsia de MPE; (•) Local de biópsia de não MPE. O sítio não MPE foi definido como uma mucosa adjacente localizada dentro de 3 cm do sítio MPE. |
A extensão da borda atrófica foi classificada em 3 estágios: leve, moderado e grave, conforme definido por Kimura e Takemoto.
Avaliação histológica
As amostras de biópsia foram enviadas ao nosso laboratório, fixadas em formalina tamponada a 10%. Os espécimes foram processados, incluídos em parafina e cortados em seções de 4 µm. As lâminas de cada amostra foram coradas com hematoxilina-eosina (HE) (Fig.3A) e coloração imuno-histoquímica. As colorações imunohistoquímicas incluíram o seguinte: (1) MUC2, um marcador de mucina intestinal que é útil para a detecção de células caliciformes (Fig. 3B), (2) MUC5AC, um marcador de mucina gástrica, que é expresso em células mucosas do pescoço e epitélio foveolar (Fig. 3C), (3) MUC6, um marcador para mucina gástrica, que é expresso nas células mucosas da zona do pescoço do corpo e glândulas pilóricas do antro (Fig. 3D), (4) CD10, a marcador útil para detectar a borda em escova do intestino delgado (Fig. 3E), e (5) CDX2, um marcador para a presença de MI (Fig. 3F). Usamos CDX2 porque estudos recentes mostraram que a expressão de CDX2 pode ser observada extensivamente nas glândulas IM e não desaparece após a erradicação do Hp. A presença de IM foi confirmada por coloração com HE e imunohistoquímica.
Os subtipos de IM foram classificados como completos ou incompletos. O tipo completo foi definido como expressão diminuída de mucina gástrica (MUC5AC ou MUC6) e co-expressão de mucina intestinal (MUC2) e CD10 (Fig. 3A-F). O tipo incompleto foi definido como a expressão de mucina gástrica (MUC5AC ou MUC6) e MUC2. Como não existem critérios estabelecidos para categorizar um caso como tendo os tipos completo e incompleto em uma seção, atribuímos os subtipos de IM como o tipo predominante.
O grau de O MI foi pontuado com base no Sistema Atualizado de Sydney (0: nenhum, 1: leve, 2: moderado, 3: marcado).
Análise estatística
Dividimos os pacientes em dois grupos com base em se os pacientes eram positivos ou negativos para MPE. Usamos o teste t de Student para comparar a idade e o período de erradicação. O teste do qui-quadrado ou o teste de probabilidade exato de Fisher foram usados para as proporções sexuais e o grau de atrofia endoscópica nos dois grupos.
Também comparamos os achados histológicos entre os locais MPE e os locais não MPE. Para comparar as diferenças entre os dois locais de biópsia, usamos o Wilcoxon Matched-Pairs Signed-Ranks Test para o IM pontuação mediana e teste exato de Fisher para a prevalência de MI, subtipos de MI e fenótipos de MI. A sensibilidade, especificidade, valores preditivos positivos e negativos e razões de probabilidade positiva e negativa de MPE vistos na endoscopia para a detecção de MI patológico foram calculados. Os valores de P < 0,05 foram considerados significativos. Todas as análises estatísticas foram realizadas com o software Stata, versão 10 (StataCorp LP, College Station, TX, EUA).
| Resultados | ▴Top |
Características do paciente
Durante o período do estudo, 157 pacientes que realizaram endoscopia digestiva alta e receberam erradicação do Hp foram revisados. Excluímos da análise 52 dos 157 pacientes para qualquer um dos seguintes critérios: uso de antiácidos (31), antitrombóticos (17) ou AINEs (3); ou história de cirrose hepática (5), insuficiência cardíaca (1) ou câncer gástrico precoce (2). Mais de um critério de exclusão aplicado a alguns pacientes.
Um total de 102 pacientes foram selecionados para análise após a exclusão. Destes, havia 55 (54%) pacientes com MPE. Não foram observadas diferenças significativas na média de idade e sexo entre os pacientes MPE-positivos e -negativos (Tabela 1). Não houve diferenças significativas entre os dois grupos após o período de erradicação do Hp. No entanto, a atrofia gástrica com uma gravidade mais elevada (moderada a grave) apareceu significativamente mais frequentemente no grupo MPE-positivo em comparação com o grupo MPE-negativo (positivo 65,6% versus negativo 45,0%, P = 0,035).
 Clique para visualizar |
Tabela 1. Características demográficas dos pacientes (n = 102) |
Achados endoscópicos e características patológicas
 Clique para visualizar |
Tabela 2. Comparação da pontuação de IM entre MPE e site não MPE (n = 55) |
Nenhuma associação significativa foi observada na expressão de MUC2, MUC5AC, MUC6, C D10 e CDX2 entre os sites MPE e os sites não MPE (Tabela 3). Não houve diferença significativa nas proporções (completo / incompleto) dos subtipos IM entre os dois grupos (MPE: 18/30 versus não MPE: 8/10, P = 0,778).
 Clique para visualizar |
Tabela 3. Fenótipos e subtipos de metaplasia intestinal |
| Discussão | ▴Top |
Neste estudo, focamos em uma aparência eritematosa única observada na endoscopia após a erradicação do Hp. Chamamos esse achado de “MPE” e descobrimos que a presença de MPE observada na endoscopia era tipicamente característica de MI patológica.
O diagnóstico de MI com endoscopia convencional tem foi considerado difícil porque a MI geralmente aparece na mucosa plana e exibe poucas alterações morfológicas. Kaminishi et al relataram “alteração nodular na cor de cinza” como um indicador para MI; a precisão das descobertas desses investigadores foi alta, com uma especificidade de 98-99%, mas a sensibilidade foi baixa (6-12%). Kaminishi et al observaram que a endoscopia convencional é menos útil para confirmar o diagnóstico de MI. Estudos recentes surgiram a respeito do achado endoscópico de MI usando endoscopia de aumento. Foi relatado que os achados distintos de fossas gástricas vistas com cromoendoscopia com azul de metileno e a “aparência de vilosidade” observada com endoscopia confocal têm sido úteis para o diagnóstico de MI. Uedo et al relataram que o aparecimento de “uma crista azul clara” ( LBC) é um sinal preciso da presença de MI, conforme observado na endoscopia ampliada por imagem de banda estreita (NBI). No entanto, devido aos altos custos do equipamento e às habilidades adicionais e ao tempo necessário para um exame mais detalhado usando ferramentas especiais como NBI ou endoscopia de aumento, a triagem com este equipamento não é prática na prática clínica diária. Além disso, há um risco aumentado de danos ao DNA da mucosa gastrointestinal ao se utilizar a cromoendoscopia com azul de metileno seguido de luz branca, exigindo cautela no seu uso. Portanto, é mais benéfico diagnosticar MI encontrando MPE sem o uso de cromoendoscopia e endoscopia de aumento. Os resultados do nosso estudo sugerem que a presença de MI pode ser diagnosticada com endoscopia padrão sem biópsia.
Por que MPE pode ser observado mesmo após a erradicação do Hp? Isso pode ser atribuído às alterações histológicas na mucosa gástrica. As mudanças histológicas notáveis após a erradicação incluem melhorias na infiltração de células inflamatórias, hiperplasia epitelial e edema. As imagens endoscópicas da mucosa eritematosa e edematosa que parecem ter melhorado refletem essas alterações histológicas. Portanto, especulamos que o MPE consiste em uma área remanescente de MI eritematosa persistente e uma área não MI de recuperação rápida resultante da erradicação bem-sucedida do Hp. A erradicação do Hp fez com que o contraste entre a área MPE e as áreas não MPE ficasse mais claro. No entanto, não se sabe por que apenas o local do MPE é observado como uma mucosa eritematosa. Provavelmente, pode-se inferir que uma área altamente densa de microvasos circunda as glândulas metaplásicas; isso não foi elucidado neste estudo. Além disso, a pontuação IM no site MPE foi significativamente maior do que a pontuação no site não MPE. Especulamos que o aparecimento de mucosa eritematosa está associado à presença de muitas glândulas metaplásicas.
O presente estudo demonstrou que o subtipo IM completo foi encontrado predominantemente na mucosa gástrica . Os subtipos de MI foram classificados em tipo completo ou incompleto; esses são os subtipos mais amplamente usados. Vários estudos demonstraram que o tipo completo não apresenta nenhum risco aumentado de desenvolver carcinoma, enquanto o tipo incompleto está associado a um risco aumentado de transformação maligna. No entanto, a associação entre os subtipos e o risco de câncer gástrico não é amplamente aceita. No momento, é difícil identificar qualquer um dos subtipos usando endoscopia padrão.
Foi relatado que a terapia de erradicação do Hp é eficaz na prevenção de úlcera gastrointestinal, bem como o desenvolvimento de câncer gástrico. Esses usos da terapia de erradicação do Hp provavelmente surgirão na prática clínica em um futuro próximo. No entanto, deve-se ter cuidado com o risco de desenvolvimento de câncer gástrico após a erradicação do Hp. Foi relatado que as características do câncer gástrico após a erradicação incluem IM patologicamente grave no corpo e atrofia gástrica grave, conforme detectado na endoscopia. Portanto, é necessário observar cuidadosamente a presença de MI mesmo após a erradicação do Hp.
Em conclusão, a presença de MPE no exame endoscópico é característica de MI patológica.Seria benéfico na prática clínica ser capaz de diagnosticar MI patológica sem cromoendoscopia ou endoscopia de aumento. MPE tem o potencial de se tornar um achado preditivo para o risco de câncer gástrico na era da erradicação do Hp.
Agradecimentos
Agradecemos ao Dr. Hidenobu Watanabe e ao Dr. Hiroyoshi Ota por seus serviços consultivos neste estudo a respeito das avaliações patológicas. Gostaríamos de expressar nossa gratidão a Hisae Kawashiro, Coordenadora de Pesquisa Clínica, pela ajuda na coleta de dados.
Grant Support
Este trabalho foi financiado pela concessão do Centro Nacional de Saúde e Medicina Global (21-108).
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
| ▴Top |
- Correa P. Carcinogênese gástrica humana: um processo de várias etapas e multifatorial – Primeira palestra sobre câncer do American Cancer Society Award Epidemiologia e Prevenção. Cancer Res. 1992; 52 (24): 6735-6740.
pubmed - Leung WK, Sung JJ. Artigo de revisão: metaplasia intestinal e carcinogênese gástrica. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Infecção por Helicobacter pylori e o desenvolvimento de câncer gástrico. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Um reconhecimento endoscópico da borda atrófica e seu significado na gastrite crônica. Endoscopia. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Locais de biópsia adequados para o diagnóstico de infecção por Helicobacter pylori e avaliação da extensão da gastrite atrófica. Am J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Classificação endoscópica de gastrite crônica com base em um estudo piloto da Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Displasia epitelial gástrica. Como o histórico clínico-patológico se relaciona ao manejo. Câncer. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Diagnóstico endoscópico de metaplasia intestinal gástrica após erradicação do Helicobacter pylori. Endoscopia. 2009; 41 (suppl I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Classificação e graduação da gastrite. O Sistema Sydney atualizado. Workshop Internacional sobre Histopatologia da Gastrite, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Expressão do gene da mucina no epitélio gástrico humano normal, pré-neoplásico e neoplásico. Cancer Res. 1995; 55 (12): 2681-2690.
pubmed - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simões J, Serpa J, et al. As mucinas como moléculas-chave para a classificação da metaplasia intestinal do estômago. Arco de Virchows. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. A metaplasia intestinal do estômago humano exibe padrões distintos de expressão de mucina (MUC1, MUC2, MUC5AC e MUC6). Cancer Res. 1999; 59 (5): 1003-1007.
pubmed - Groisman GM, Amar M, Livne E. CD10: uma ferramenta valiosa para o diagnóstico microscópico de luz da doença de inclusão microvilosa (atrofia microvilosa familiar). Am J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. The ectopeptidases CD10, CD13, CD26, e CD143 são regulados positivamente no câncer gástrico. Int J Oncol. 2004; 25 (5): 1223-1232.
pubmed - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Expressão ectópica da proteína homeodomínio CDX2 em metaplasia intestinal e carcinomas do estômago. Cancer Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Expressão aberrante de CDX2 na mucosa gástrica com e sem metaplasia intestinal: efeito da erradicação do Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H., et al. Cromoendoscopia de ampliação para o diagnóstico de metaplasia e displasia intestinal gástrica. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Validação externa de uma classificação para cromoendoscopia com aumento de azul de metileno em lesões gástricas pré-malignas. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Padrões endoscópicos da mucosa gástrica e seu significado clínico-patológico. World J Gastroenterol. 2003; 9 (11): 2552-2556.
pubmed - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. Um novo método de diagnóstico de metaplasia intestinal gástrica: imagem de banda estreita com endoscopia de aumento. Endoscopia. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Endoscopia de ampliação: melhora a análise da superfície da mucosa para o diagnóstico de neoplasias gastrointestinais ?. Endoscopia. 2002; 34 (10): 819-822.
pubmed doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Cromoendoscopia com azul de metileno e danos associados ao DNA no esôfago de Barrett. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Estudo de acompanhamento de cinco anos sobre alterações histológicas e endoscópicas na mucosa gástrica após a erradicação do Helicobacter pylori. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Acompanhamento histológico de dois a quatro anos da mucosa gástrica após Helicobacter erradicação de pylori. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. Os perfis de mucina do estômago normal mucosa, metaplasia intestinal e suas variantes e carcinoma gástrico. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al. Tipos de metaplasia intestinal e o risco de gástrica câncer: um estudo de coorte na Eslovênia. Int J Cancer. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Detecção de um aumento na incidência de câncer gástrico precoce em pacientes com metaplasia intestinal tipo III que são acompanhados de perto. Intestino. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Artigo de revisão: estados pré-neoplásicos da mucosa gástrica – uma abordagem prática para o clínico perplexo. Aliment Pharmacol Ther. 2001; 15 (Suplemento 1): 43-50.
pubmed - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Efeito da erradicação do Helicobacter pylori na incidência de carcinoma gástrico metacrônico após ressecção endoscópica de câncer gástrico precoce: um ensaio clínico controlado randomizado aberto. Lanceta. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Câncer gástrico detectado após a erradicação do Helicobacter pylori. Endoscopia digestiva. 2007; 19: 167-173.
Este é um artigo de acesso aberto distribuído sob os termos da Creative Commons Attribution License, que permite o uso irrestrito, distribuição e reprodução em qualquer meio, desde que o trabalho original seja devidamente citado.
Gastroenterology Research é publicado por Elmer Press Inc.