Fapte despre elementele de Francium
Elementul chimic franciu este clasificat ca metal alcalin. A fost descoperit în 1939 de Marguerite Perey.

Zona de date
| Clasificare: | Francium este un metal alcalin |
| Culoare: | argintiu-gri-metalic (presupus) |
| Atomic greutate: | (223), fără izotopi stabili |
| Stat: | solid |
| Punct de topire: | 27 oC, 300 K |
| Punct de fierbere: | 677 oC, 950 K |
| Electroni: | 87 |
| Protoni: | 87 |
| Neutronii din izotopul cel mai abundent: | 136 |
| Cochilii de electroni: | 2, 8,18,32,18,8,1 |
| Configurație electronică: | 7s1 |
| Densitate @ 20oC: | 1,873 g / cm3 |
Afișați mai multe, inclusiv: încălziri, energii, oxidare,
Reacții, compuși, raze, conductivități
| Volumul atomic: | 71,07 cm3 / mol |
| Structură: | considerată a fi bcc: cubic centrat pe corp |
| Duritate: | – |
| Capacitate de căldură specifică | – |
| Căldură de fuziune | 2 kJ mol-1 |
| Căldură de atomizare | 73 kJ mol-1 |
| Căldură de vaporizare | 64 kJ mol-1 |
| Prima energie de ionizare | 384 kJ mol-1 |
| A doua energie de ionizare | – |
| A treia energie de ionizare | – |
| Afinitate electronică | – |
| Număr minim de oxidare | 0 |
| Min. nr. obișnuit de oxidare. | 0 |
| Numărul maxim de oxidare | 1 |
| Max. oxidare comună nr. | 1 |
| Electronegativitate (Pauling Scale) | 0.7 |
| Polarizabilitate volum | 48,7 Å3 |
| Reacție cu aer | – |
| Reacție cu 15 M HNO3 | – |
| Reacție cu 6 M HCl | viguros, ⇒ H2, FrCl |
| Reacție cu NaOH 6 M | viguros, ⇒ H2, FrOH |
| Oxid (i) | – |
| Hidrură (e) | – |
| Clorură (e) | – |
| Raza atomică | – |
| Raza ionică (1+ ion) | 194 pm |
| Raza ionică (2+ ion) | – |
| Raza ionică (3+ ion) | – |
| Raza ionică (1- ion) | – |
| Raza ionică (2- ion) | – |
| Raza ionică (3- ion) | – |
| Conductivitate termică | 3,61 W m-1 K-1 |
| Conductivitate electrică | – |
| Punct de îngheț / topire: | 27 oC, 300 K |

Această probă de minereu de uraniu conține aproximativ 100 000 de atomi de franciu-223 (3,3 x 10 -20 g). Franciul este radioactiv; mai puțin de 30g din ea există pe Pământ la un moment dat. Ref. Imagine (1)
Descoperirea Francium
Francium a fost descoperit de Marguerite Perey în 1939 când cerceta dezintegrarea radioactivă a actinium-227.
Descoperirea a avut loc la Institutul Curie din Paris. Elementul își ia numele din țara descoperirii sale – Franța.
Descoperirea a început, în 1935, când Perey, în vârstă de 26 de ani, a citit o lucrare de cercetare care susținea că oamenii de știință americani au descoperit particule beta emise de actiniu care avea o cantitate mai mare de energie decât în mod normal.
Perey era curioasă de această descoperire și fiind deja expertă în activități legate de actiniu, a decis să efectueze propriile experimente pe actiniu. Ea a produs o probă de actiniu ultra-pură și a studiat radiația sa. Perey a descoperit că aproximativ 1% din radioactivitatea actiniilor a fost cauzată de emiterea de particule alfa, nu de particule beta.
Perey a descoperit că actiniul-227 se poate descompune prin emiterea unui nucleu de heliu (numit și o particulă alfa) din propriul nucleu. Nucleul fiic format a fost un element nedescoperit anterior pe care a ales să-l numească francium pentru a-și onora țara natală, Franța.
227Ac → 223Fr + 4He
Cu 87 de protoni aparținea noului element Grupul 1 al tabelului periodic, alăturându-se celorlalte cinci metale alcaline: litiu, sodiu, potasiu, rubidiu și cesiu.
Descoperirea franciului a desăvârșit descoperirile omenirii cu privire la elementele naturale.
Toate elementele descoperite de atunci au fost descoperite când elementul a fost produs în laborator.

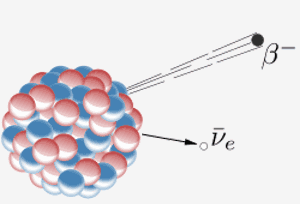
Un nucleu emite o beta-particulă ( un electron) și un antineutrino. Rezultatul este că un neutron din nucleu se transformă într-un proton. Când elementul 87 din tabelul periodic (francium) face acest lucru, protonul suplimentar înseamnă că devine elementul 88 (radium).
Aspect și caracteristici
Efecte nocive:
Franciul este extrem de radioactiv.
Caracteristici:
Franciul este un metal radioactiv greu, instabil, cu un timp de înjumătățire maximă de numai 22 de minute. Are un punct de topire scăzut (27 oC, 81 oF) și, dacă s-ar putea acumula suficient din el, ar fi lichid într-o cameră caldă.
Franciul este al doilea cel mai rar element din scoarța Pământului, alături de astatine. Mai puțin de treizeci de grame de franciu există pe Pământ la un moment dat.
Franciul este cel mai puțin electronegativ dintre toate elementele, prin urmare ar trebui să fie cel mai reactiv chimic metal alcalin. Din păcate, nu este disponibil în cantități suficiente pentru a arăta că reacționează cu apa – este produs în cantități mici în acceleratoare de particule. În teorie, reacția sa cu apa ar fi mai violentă decât cea de cesiu și mult mai violentă decât cea de sodiu.
Franciul a fost studiat cel mai recent la Universitatea Stony Brook, New York. Oamenii de știință de acolo au prins până la zece mii de atomi de franciu folosind fascicule laser într-un câmp magnetic pentru a le măsura proprietățile.
Utilizările franciului
Din punct de vedere comercial, nu există utilizări pentru franciu, datorită rarității și instabilității sale. Este utilizat numai în scopuri de cercetare.
Dezintegrarea Francium
Izotopii Francium, cu un număr de mase cuprins între 200 și 232, cel mai frecvent suferă decadere alfa sau beta.
Iată doar câteva exemple de căi de degradare a franciului:
Francium-223 este cel mai longeviv izotop al elementului. Are un timp de înjumătățire de 22 de minute. Poate emite o particulă alfa (un nucleu de heliu) pentru a forma astatine-219 sau o particulă beta pentru a forma radiu-223. (O particulă beta este un electron care este emis dintr-un nucleu atunci când un neutron se transformă într-un proton.)
Francium-221 are un timp de înjumătățire de 5 minute. Poate emite o particulă alfa pentru a forma astatine-217 sau o particule beta pentru a deveni radiu-221.
Francium-216 are un timp de înjumătățire de 0,7 microsecunde. Poate emite o particulă alfa pentru a forma astatine-212 sau un pozitron pentru a forma radon-216.
Francium-212 are un timp de înjumătățire de 19 minute. Poate emite o particulă alfa pentru a forma astatine-208 sau captura un electron orbital pentru a forma radon-212. (2) (În timpul captării electronilor orbitali, nucleul captează unul dintre electronii atomului și emite un neutrin.)
Abundență și izotopi
Abundență scoarță terestră: ~ 0 părți pe milion , ~ 0 părți pe milion
Sistem solar cu abundență: ~ 0 părți pe miliard în greutate, ~ 0 părți pe miliard cu moli
Cost, pur: $ pe 100g
Cost, vrac: $ per 100g
Sursă: Franciul apare în mod natural ca urmare a decăderii alfa radioactive a actiniului.
Izotopi: Francium are 33 de izotopi ale căror perioade de înjumătățire sunt cunoscute, cu numere de masă de la 200 la 232. Niciuna nu este stabilă. 223Fr are cel mai lung timp de înjumătățire la 21,8 minute.

- Fotografie de Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, Numărul 6.
Citează această pagină
Pentru conectarea online, copiați și inserați unul dintre următoarele:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
sau
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Pentru a cita această pagină într-un document academic, vă rugăm să utilizați următoarea citare conformă MLA:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.