Fapte despre elementele de poloniu
Elementul chimic poloniu este clasificat ca calcogen și metaloid. A fost descoperit în 1898 de Marie și Pierre Curie.

Zona de date
| Clasificare: | Poloniul este un calcogen și un metaloid |
| Culoare: | gri-argintiu |
| Greutate atomică : | (209), fără izotopi stabili |
| Stat: | solid |
| Punct de topire: | 254 oC, 527 K |
| Punct de fierbere: | 960 oC, 1233 K |
| Electroni: | 84 |
| Protoni: | 84 |
| Neutronii din izotopul cel mai abundent: | 125 |
| Cochilii de electroni: | 2,8 , 18,32,18,6 |
| Configurare electronică: | 4f14 5d10 6s2 6p4 |
| Densitate @ 20oC: | 9,4 g / cm3 |
Afișați mai multe, inclusiv: încălziri, energii, boi idație,
Reacții, compuși, raze, conductivități
| Volum atomic: | 22,23 cm3 / mol |
| Structură: | simplu cubic |
| Duritate: | – |
| Capacitate termică specifică | 0,12 J g-1 K-1 0,12 |
| Căldură de fuziune | 13 kJ mol-1 |
| Căldura de atomizare | 142 kJ mol-1 |
| Căldură de vaporizare | 120 kJ mol-1 |
| Prima energie de ionizare | 812 kJ mol-1 |
| A doua energie de ionizare | – |
| A treia energie de ionizare | – |
| Afinitate electronică | 180 kJ mol-1 |
| Număr minim de oxidare | -2 |
| Min. nr. obișnuit de oxidare. | -2 |
| Numărul maxim de oxidare | 6 |
| Max. oxidare comună nr. | 4 |
| Electronegativitate (Pauling Scale) | 2.0 |
| Polarizabilitate volum | 6.8 Å3 |
| Reacție cu aer | ușoară, ⇒ PoO2 |
| Reacție cu 15 M HNO3 | – |
| Reacție cu 6 M HCl | ușoară, ⇒ PoCl2 |
| Reacție cu NaOH 6 M | niciunul |
| Oxid (i) | PoO2, PoO2 |
| Hidrură (e) | PoH2 |
| Clorură (e) | PoCl2 |
| Raza atomică | 190 pm |
| Raza ionică (1+ ion) | – |
| Raza ionică (2+ ion) | – |
| Ionic raza (3+ ion) | – |
| Raza ionică (1- ion) | – |
| Raza ionică (2-ion) | – |
| Raza ionică (3- ion) | – |
| Conductivitate termică | 0.2 W m-1 K-1 |
| Conductivitate electrică | 0,7 x 106 S m-1 |
| Punct de îngheț / topire: | 254 oC, 527 K |

Marie Curie în 1883, 16 ani. Polonium a fost primul element pe care l-a descoperit, 15 ani mai târziu.
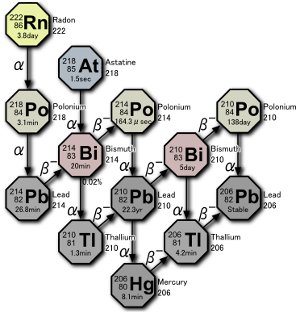
Parte din seria de degradare a uraniului. Trei izotopi de poloniu sunt produși în natură, fie prin decăderea gazului radon în sine, fie prin decăderea atomilor rezultată din decăderea radonului. Imagine de Tosaka.
Descoperirea Polonium
Polonium a fost primul element descoperit de Marie și Pierre Curie.
Au descoperit poloniul și apoi radiul în 1898 la Paris, în timp ce investigau radioactivitatea în pitchblendă (oxid de uraniu).
Ei au scris: „Credem că substanța pe care am extras-o din pitchblende conține un metal niciodată cunoscut până acum, similar cu bismutul în proprietățile sale analitice. Dacă se confirmă existența acestui nou metal, sugerăm că ar trebui să fie numit polonium după numele țării de origine a unuia dintre noi. ”
În conformitate cu dorințele Curies, poloniul poartă numele Poloniei, unde Marie Curie s-a născut și a crescut.
Pericolele de a lucra cu elemente radioactive nu erau cunoscute când Curies Caietele lor de laborator din acest moment sunt atât de radioactive încât sunt acum depozitate într-o carcasă cu plumb. (1)
Aspect și caracteristici
Efecte nocive:
Poloniul este dăunător atât prin toxicitatea chimică, cât și prin radioactivitate. Polonium-210 este un emițător alfa. Ca atare, este foarte periculos dacă este înghițit sau inhalat.Expunerea la poloniu crește riscul de apariție a diferitelor tipuri de cancer.
Caracteristici:
Poloniul este un metaloid rar, cenușiu-argintiu, radioactiv, cu topire redusă.
Poloniul reacționează ușor cu acizii diluați, dar doar ușor cu alcalii.
Toți izotopii săi sunt radioactivi.
210Po emite o strălucire albastră, deoarece aerul din jurul său este excitat de dezintegrare. produse. 1 gram de Po emite atâtea particule alfa cât 5 kilograme de radiu.
Energia eliberată de decăderea alfa a poloniului este considerabilă și încălzește spațiul din jurul său. Energia eliberată este atât de mare (140 W / g) încât o capsulă care conține aproximativ o jumătate de gram atinge o temperatură peste 500 ° C.
Utilizări ale poloniului
Razele alfa emise de poloniul poate fi utilizat pentru a elimina electricitatea statică produsă în timpul proceselor precum hârtia de rulare, sârmă și tablă. Cu toate acestea, sursele de raze beta sunt mai frecvent utilizate, deoarece sunt mai puțin periculoase.
210Po poate fi utilizat ca sursă de căldură atomică, dar din cauza perioadei de înjumătățire scurtă a izotopului (138,4 zile), nu oferă energie pentru utilizări pe termen lung.
Polonium este, de asemenea, utilizat în perii antistatic pentru a elimina praful de pe filmul fotografic. Este sigilat în perii pentru a controla emisiile radioactive.
Abundența și izotopii
Abundența scoarței terestre: De ordinul a 1 parte pe patruliard.
Abundența sistemului solar: neglijabil
Cost , pur: la 100g
Cost, vrac: la 100g
Sursa: Poloniul este un element foarte rar datorită perioadei de înjumătățire scurtă a tuturor izotopilor săi. Se găsește în minereuri de uraniu în cantități mici. Poate fi obținut prin bombardarea bismutului natural, 209Bi, cu neutroni pentru a da 210Bi, care apoi se descompune la 210Po prin decadere β. Aproximativ 100 g de poloniu sunt sintetizați în fiecare an.
Izotopi: Poloniul are 29 de izotopi ale căror perioade de înjumătățire sunt cunoscute, cu numere de masă de la 190 la 218. Niciunul nu este stabil. Cel mai stabil izotop este 209Po, cu un timp de înjumătățire de 102 ani.

Citați această pagină
Pentru conectarea online, copiați și inserați unul dintre următoarele:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
sau
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Pentru a cita această pagină într-un document academic, vă rugăm să utilizați următoarea citare conformă MLA:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.