Frontiere în fiziologie
Introducere
Baroreceptorii arteriali servesc drept senzori de linie frontală pentru a detecta modificările tensiunii arteriale în fluxul sanguin. Modificările tensiunii arteriale stimulează terminațiile nervoase mecanosensibile care sunt localizate în pereții arteriali. Forța mecanică este transdusă în semnale electrice la terminalele nervoase, ducând la declanșarea potențială de acțiune dependentă de presiune în neuronii baroreceptor. Semnalele nervoase se propagă apoi către centrul de control cardiovascular din trunchiul cerebral pentru reglarea baroreflexă a tensiunii arteriale (Levy MN, 2007). În plus, structurile supra-medulare, incluzând nucleul cuneiform midbrain și cortexul prefrontal medial ventral, au, de asemenea, un rol inhibitor în reglarea baroreflexului (Verberne și colab., 1997).
Există doi baroreceptori arteriali, și anume, baroreceptorii aortici și baroreceptorii carotizi, localizați în stratul de adventie al arcului aortic și respectiv al arterelor carotide. Baroreceptorii aortici detectează tensiunea arterială în aortă. Corpurile celulare (soma) ale baroreceptorilor aortici sunt situate la ganglionul nodoz (NG) (Figura 1). Semnalele nervoase de la terminalele nervoase aortice baroreceptoare sunt transmise ganglionului nodoz printr-un nerv senzorial numit nerv depresor aortic (ADN) (Figura 1). Baroreceptorii carotizi detectează tensiunea arterială în artera carotidă, care furnizează sânge creierului. Terminalele nervoase ale baroreceptorilor carotide sunt situate bilateral la bifurcațiile arterei carotide, aproape de artera carotidă internă. Semnalele nervoase de la baroreceptorii carotizi se deplasează de-a lungul nervilor sinusului carotidian (CSN) către soma lor localizată în ganglionul petrosal (PG). Ganglionul petrosal iese dincolo de foramenul jugular (Figura 1) (McDonald, 1983; Shoukas și colab., 1991; Vander și colab., 1998; Sato și colab., 1999; Donnelly și Rigual, 2000; Weijnen și colab., 2000) . Deoarece baroreceptorii aortici simt tensiunea arterială în aortă, care furnizează sânge întregii circulații sistemice, se așteaptă ca acești baroreceptori să joace un rol funcțional important în menținerea tensiunii arteriale sistemice generale. Pe de altă parte, baroreceptorii carotizi detectează presiunea sângelui care este livrat în creier. Acești baroreceptori pot fi mai importanți pentru menținerea unei tensiuni cerebrale stabile și a unui flux sanguin cerebral.
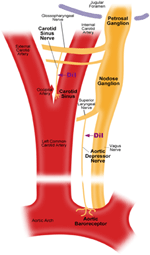
Figura 1. Diagrama schematică a terminalelor și nervilor baroreceptorului aortic și carotidian. Diagramă care ilustrează pozițiile anatomice ale terminalelor nervoase ale baroreceptorilor aortici și carotizi, ale fibrelor nervoase și ale regiunilor somate. Terminalele baroreceptorului aortic sunt situate într-un arc aortic. Fibra nervoasă aferentă este nervul depresor aortic. Soma se află în ganglionul nodoz (NG). Baroreceptorul carotidian este poziționat în artera carotidă internă lângă bifurcația carotidă. Nervul său aferent este nervul sinusal carotidian. Soma este localizat în ganglionul petrosal (PG).
Există rapoarte contradictorii cu privire la care baroreceptori, baroreceptori aortici sau carotide baroreceptorii, sunt mai sensibili la modificarea tensiunii arteriale. Unii cercetători au raportat că baroreceptorii carotizi sunt mai sensibili la presiune (Donald și Edis, 1971; Fadel și colab., 2003), în timp ce alții consideră că baroreceptorii aortici sunt mai sensibili la presiune (Glick și Covell, 1968; Pickering și colab., 2008), și totuși alții nu au raportat nicio diferență în sensibilitatea la presiune dintre acești doi baroreceptori (Hainswor și colab., 1970; James și Daly, 1970). Cu toate acestea, aproape toate aceste studii anterioare au folosit doar răspunsurile baroreflex (cum ar fi ritmul cardiac și activitatea nervului simpatic renal) ca puncte finale pentru analiza sensibilității baroreceptorilor. Încă nu există niciun studiu care să înregistreze și să compare în mod direct sensibilitatea la presiune a neuronilor baroreceptori aortici și carotizi în sine.
Aici, am folosit o clemă de presiune de mare viteză pentru a modifica presiunea hidrostatică din interiorul neuronilor baroreceptor și am măsurat răspunsurile electrofiziologice corespunzătoare ale acestor neuroni prin prinderea plasturelui cu celule întregi. De asemenea, am folosit o cameră de întindere uniaxială pentru a întinde neuronii baroreceptor și am măsurat modificările corespunzătoare ale Ca2 + citosolic în acești neuroni. În plus, pentru studii in vivo pe animale am măsurat focurile potențiale de acțiune induse de presiune în depresorul aortic și nervii sinusului carotidian, care sunt nervii senzoriali ai baroreceptorilor aortici și, respectiv, carotizi.
Materiale și metode
Animale
Toate experimentele pe animale au fost efectuate sub autoritatea unei licențe emise de Guvernul SAR Hong Kong și aprobarea Comitetului de etică pentru experimentarea animalelor, Universitatea chineză din Hong Kong.Șobolani Sprague-Dawley masculi (S / D) (180-200 g) au fost furnizați de Laboratory Animal Services Center din cadrul Universității chineze din Hong Kong.
Cultura primară
S / D șobolanii au fost anesteziați cu pentobarbital sodic (100 mg / kg). Zona cervicală stângă a fost expusă prin incizie în linia mediană în condiții sterilizate. Așa cum se arată în Figura 1, nervul depresor aortic sau nervul sinusal carotidian a fost expus și 2-3 mm din nerv au fost detașați cu atenție de țesuturile înconjurătoare prin disecție contondentă. Trasor lipofil fluorescent 1,1-dioctadecil-3,3,3 ′, 3′-tetrametilindocarbocianină (DiI) (Invitrogen) au fost aplicate în jurul nervului și acoperite cu Kwik-Sil (World Precision Instruments, SUA). Incizia a fost suturată după aceea. Șobolanilor li s-a permis să se recupereze timp de 5-7 zile pentru a permite coloranței DiI să difuzeze retrograd de-a lungul nervului depresor aortic sau al nervului sinusal carotidian către somatele situate în ganglionul nodoz sau respectiv ganglion petrosal.
Nodoză sau ganglion petrosal. neuronii au fost izolați de la șobolani marcați DiI și tăiați în bucăți în EBSS rece ca gheața. Au fost supuși digestiei timp de 1 oră la 37 ° C cu tripsină (1 mg / ml) și colagenază IA (1 mg / ml). Neuronii unici au fost dispersați prin triturare ușoară prin pipeta Glass Pasteur, urmată de centrifugare. Neuronii au fost resuspendați și cultivați în medii DMEM / F-12 suplimentate cu 5% FBS, 1% antibiotic-antimicotic și 7S NGF (100 ng / ml). Citozina arabinofuranozidă (Ara-C; 10 μM) a fost inclusă în mediul de cultură pentru a inhiba creșterea celulelor care se divid. Neuronii au fost cultivați cu cel puțin 3 zile înainte de experimente. Pentru înregistrarea potențialului de acțiune, neuronii au fost proaspăt izolați și incubați în F12 cu cel puțin 30 de minute înainte de experimente. Pentru toate experimentele, celulele au fost incubate pe lamele de sticlă pre-acoperite cu 0,1 mg / ml poli-L-lizină, cu excepția experimentelor de întindere a celulelor în care camerele de silicon au fost pre-acoperite cu 2% gelatină.
Patch Clamp
Înregistrarea clampului de curent cu celule întregi a fost realizată de un amplificator EPC7 patch clamp (HEKA, Germania). Pipetele de patch-uri cu rezistență 3-5 MΩ au fost umplute cu soluție de pipetă (în mM): 130 K-gluconat, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 de KOH. Celulele au fost scăldate în lichidul cefalorahidian artificial (ACSF) (în mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glucoză, echilibrat cu carbogen (95% O2 și 5 % CO2). În înregistrarea curentă a clemelor, celulele au fost ținute la potențialul său de membrană de repaus. Un sistem de prindere cu presiune de mare viteză (HSPC-1, ALA Scientific Instruments, SUA) a fost utilizat pentru a furniza presiune pozitivă celulei prin micropipetă. Înregistrările au fost eșantionate la 50 kHz și filtrate la 5 kHz. Datele au fost analizate cu PulseFit (HEKA). Toate experimentele au fost efectuate la temperatura camerei.
Imaginea cu calciu
Măsurarea citosolică a Ca2 + a fost efectuată așa cum este descris în altă parte (Wong și colab., 2010). Pe scurt, celulele au fost încărcate cu 5 μM Fluo-4 / AM timp de 40 de minute. Măsurarea citosolică a Ca2 + a fost efectuată cu soluție tamponată HEPES (în mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glucoză, pH 7,4 prin NaOH. Modificarea citosolică a Ca2 + ca răspuns la întinderea uniaxială a fost efectuată cu STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Celulele au fost stimulate cu 10, 20 sau 30% de întindere unidirecțională timp de 1 s. Răspunsul citosolic Ca2 + a fost măsurat la temperatura camerei. Fluorescența Fluo-4 a fost înregistrată și analizată de sistemul de imagini confocale cu scanare laser FV1000. Modificarea răspunsului la fluorescență Ca2 + citosolic a fost exprimată ca un raport (Fx / F0) al fluorescenței în timp real, unde Fx este semnalul fluo-4 / AM în timp real și F0 este semnalul de bază fluo-4 / AM înainte de întindere.
Înregistrarea activității nervoase
Șobolanii au fost anesteziați cu 100 mg / kg pentobarbital sodic. Zona cervicală a fost expusă prin incizie pe linia mediană. Artera carotidă dreaptă a fost izolată și canulată de un cateter care a fost conectat la traductorul de presiune (ML221, ADInstruments, SUA) pentru înregistrarea tensiunii arteriale. Vena femurală stângă a fost canulată pentru fenilefrină și injecție SNP. Nervul depresor aortic stâng sau nervul sinusal carotidian a fost conectat la un electrod bipolar de argint, urmat de un amplificator și un amplificator (Model 1700 Amplificator CA diferențial, A-M Systems Inc., SUA). Atât tensiunea arterială, cât și activitatea nervoasă au fost înregistrate continuu de diagrama 5.0 (AD Instruments). Activitatea nervoasă a fost amplificată de 10.000 de ori și filtrată la bandpass de 100-5000 Hz. Valorile presiunii arteriale medii, ale ritmului cardiac și ale frecvenței vârfurilor ca răspuns la fenilefrină au fost analizate prin software-ul Chart 5.0. S-a calculat modificarea frecvenței vârfurilor (frecvența vârfurilor după fenilefrină – frecvența vârfurilor înainte de fenilefrină) ca răspuns la modificarea maximă a tensiunii arteriale (tensiunea arterială medie după fenilefrină – tensiunea arterială medie înainte de fenilefrină) la injecția cu fenilefrină (Lau și colab., 2016) .
Analiza statistică
Urmele reprezentative au fost trasate ca urme ale cursului de timp. Datele din toate experimentele au fost rezumate într-o diagramă cu bare care a fost exprimată în medie ± sem a experimentelor individuale. Testul t al studentului a fost utilizat pentru analiza statistică. Testul t în perechi a fost utilizat acolo unde este cazul.
Rezultate
Proprietățile neuronilor depresorului aortic și ale neuronilor sinusului carotidian
Dil a fost aplicat fie pe nervul depresor aortic, fie pe nervul sinusal carotidian. Prin urmare, neuronii marcați Dil din ganglionul nodozei includ neuronii baroreceptori care inervează arcul aortic și neuronii chemoreceptori care inervează corpul aortic. Pe de altă parte, neuronii marcați Dil din ganglionul petrosal a inclus neuronii baroreceptori care inervează sinusul carotidian și neuronii chemoreceptori care inervează corpul carotidian. Am investigat mai întâi proprietățile de bază ale acestor neuroni marca Dil. prezentate în Figura 2. Au fost înregistrate două tipuri de răspunsuri, unul a răspuns cu un singur potențial de acțiune și celălalt cu potențial de acțiune continuă după curentul de despolarizare (Figura 2) (Belmonte și Gallego, 1983). Acești neuroni au fost ulterior supuși unui protocol de presiune hidrostatică pentru a-și testa sensibilitatea la modificările presiunii hidrostatice. O rampă de presiune hidrostatică pozitivă a fost aplicată intracelular printr-o micropipetă de sticlă de către sistemul de prindere de presiune de mare viteză (HSPC-1, ALA Scientific Instruments, SUA) până când au fost obținute potențialele de acțiune. Rezultatele au arătat că 45% dintre neuronii baroreceptorilor aortici au declanșat potențiale de acțiune continuă ca răspuns la curentul electric depolarizant (Tabelul 1A). Dintre aceștia, 91% (41% / 45%) au răspuns, de asemenea, la modificarea presiunii hidrostatice și au arătat potențiale focuri de acțiune dependente de presiune (Tabelul 1A). Restul de 55% din neuronii baroreceptorilor aortici au declanșat un singur potențial de acțiune ca răspuns la curentul de depolarizare (Tabelul 1A), iar printre aceștia, 40% (22% / 55%) ar putea răspunde la modificarea presiunii (Tabelul 1A). Pentru neuronii baroreceptorilor carotizi, 45% din celule au dat potențial de acțiune continuă atunci când au fost stimulați de curentul de depolarizare (Tabelul 1B). Dintre aceștia, 82% (37% / 45%) au fost, de asemenea, sensibili la schimbarea presiunii (tabelul 1B). În plus, printre neuronii baroreceptorilor carotizi care au declanșat un singur potențial de acțiune ca răspuns la curentul de depolarizare, 24% (13% / 55%) ar putea răspunde la modificarea presiunii (Tabelul 1B).
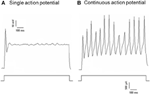
Figura 2. Înregistrarea potențialului de acțiune de la depresorul aortic cultivat și neuronii sinusului carotidian. Sunt prezentate urmele potențialelor de acțiune care au fost înregistrate de la doi neuroni reprezentativi ai depresorului aortic / sinusului carotidian la un curent depolarizant. (A) Neuroni reprezentativi care declanșează doar un singur potențial de acțiune asupra stimulării actuale; (B) Neuroni reprezentativi care declanșează numai potențiale de acțiune continuă asupra stimulării actuale. Panoul inferior: protocol pentru injecția curentă. Bara de scalare, orizontală, 100 ms, verticală, 10 mV (urmele superioare) și 500 pA (urmele inferioare). n = 27 și n = 38 pentru depresia aortică și respectiv neuronii sinusului carotidian.

Tabelul 1. Proprietățile depresorului aortic și ale neuronilor sinusului carotidian.
Indiferent dacă au declanșat un singur potențial de acțiune sau potențial de acțiune continuă, 63% dintre neuronii baroreceptorilor aortici marcați Dil s-au dovedit a fi sensibili la schimbarea presiunii, în timp ce doar 50% dintre neuronii baroreceptorilor carotizi marcați Dil erau sensibili la schimbarea presiunii (Tabelul 1).
Sensibilitatea la întindere a neuronilor baroreceptorului aortic și carotidian
A fost analizat pragul de presiune pentru descărcarea potențialului de acțiune. Așa cum se arată în Figura 3, neuronii baroreceptorilor aortici au avut un prag de presiune mai mic (24 ± 4 mmHg) decât cel al neuronilor baroreceptorilor carotizi (39 ± 4 mmHg).

Figura 3. Sensibilitățile neuronilor baroreceptorilor aortici și carotizi la presiunea hidrostatică. (A, B) Panoul superior, urme reprezentative ale timpului, ilustrând potențialul de acțiune dependent de presiune, declanșare în neuronii baroreceptorilor aortici (A) și carotide (B). Rampa de presiune (panoul inferior) a fost aplicată în interiorul celulelor printr-o micropipetă utilizând un sistem de prindere cu presiune de mare viteză (HSPC). Bara de scalare orizontală, 1 s, verticală, 20 mV și 20 mmHg. (C) Rezumatul care prezintă pragul de presiune care inițiază acțiunile potențiale de declanșare în neuronii baroreceptorilor aortici și carotizi. n = 13 pentru neuronii baroreceptorilor aortici și n = 15 pentru neuronii baroreceptorilor carotizi. *** p < 0.01, prin testul t al Studentului.
Răspunsul Ca2 + indus de întindere în neuronii baroreceptorilor
Depresorii aortici cultivați sau neuronii sinusului carotidian au fost supuși 10, 20 sau 30% din întinderea uniaxială prin sistemul STREX Cell Stretching System, încercând să imite vasul de sânge care se întinde sub tensiune. Rezultatele au arătat că o întindere uniaxială de 20% a indus o creștere marcată a fluorescenței citosolice Ca2 + în neuronii baroreceptorilor aortici, dar nu și în neuronii baroreceptorilor carotizi (Figurile 4A-C). Mai mult, magnitudinea fluorescenței Ca2 + crește ca răspuns la întinderea uniaxială de 30% a fost mult mai mare în neuronii baroreceptorilor aortici decât în neuronii baroreceptorilor carotizi (Figurile 4A-C).
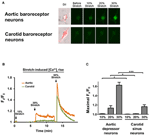
Figura 4. Sensibilitățile depresorului aortic și ale neuronilor sinusului carotidian la întinderea uniaxială. Celulele au fost încărcate cu colorant fluorescent sensibil la Ca2 + Fluo-4 / AM. Sunt prezentate imagini reprezentative (A) și urme de parcurs în timp (B) ale creșterii relative a Ca2 + citosolicului ca răspuns la întinderea uniaxială de 10, 20 și 30% din lungimea celulei în neuronii depresori aortici și ai sinusului carotidian. (C) Rezumatul creșterii maxime citosolice a Ca2 + ca răspuns la diferite grade de întindere. Modificarea Ca2 + citosolică a fost exprimată ca Fx / F0, unde Fx este semnalul fluo-4 / AM în timp real și F0 este semnalul de bază fluo-4 / AM înainte de întindere. Media ± s.e.m. (n = 5). * p < 0.05, *** p < 0.01 în comparație cu controlul corespunzător, prin testul t în perechi.
Activitatea nervoasă a baroreceptorului in vivo
Activitatea nervoasă a celor doi baroreceptori a fost investigată in vivo. Fenilefrina a fost injectată intravenos. Modificările tensiunii arteriale la aplicarea fenilefrinei sunt prezentate în panoul superior din figurile 5A, B. Modificările ulterioare ale activității nervului baroreceptor sunt prezentate în panoul inferior (Figurile 5A, B). Activitatea nervoasă indusă de presiune a fost mult mai mare în nervul depresor aortic decât în nervul sinusal carotidian (Figurile 5A, B). Schimbarea frecvenței vârfurilor pe mmHg este rezumată în Figura 5C. Rezultatul a indicat faptul că baroreceptorii aortici sunt mai sensibili la presiunea hidrostatică decât baroreceptorii carotizi in vivo.
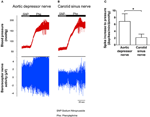
Figura 5. Activitatea nervului baroreceptor la șobolan in vivo. (A, B) Urme reprezentative care arată schimbarea activității nervului depresor aortic (A) și a nervului sinusal carotidian (B) la creșterea tensiunii arteriale. În ambele (A, B), panoul superior a fost modificarea tensiunii arteriale înainte și după aplicarea Phe, așa cum este indicat de barele orizontale. Panoul inferior a fost modificarea corespunzătoare a activității nervoase. (C) Date rezumate care arată schimbarea activității nervoase pe unitate de modificare a tensiunii arteriale. Media ± s.e.m. (n = 8). * p < 0.05 în comparație cu controlul în baroreceptori aortici, prin testul t în perechi.
Exprimarea canalelor TRP
S-a raportat că mai multe canale TRP sunt sensibile la mecanic, inclusiv TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O „Neil și Heller, 2005; Christensen și Corey, 2007; Pedersen și Nilius, 2007; Patel și colab., 2010; Lau și colab., 2016). Aici, am investigat rolul posibil al acestor canale TRP mecanosensibile în relație cu aortica și sensibilitatea baroreceptorului carotidian. Expresiile ARNm ale acestor canale în ganglionul nodoză și petrosală au fost comparate. S-a constatat că expresiile TRPV4 și TRPC6 au fost mai mari în ganglionul nodozei în comparație cu ganglionul petrosal (Figura 6). Este posibil ca expresia canalelor mecanosensibile în ganglionul nodoz poate contribui la o sensibilitate mai mare.
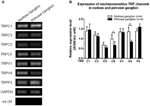
Figura 6. Exprimarea canale TRP mecanosensibile în ganglionul nodoz și petrosal. (A) Imagini reprezentative pe gel comparând nivelul de expresie a ARNm al canalelor TRP mecanosensibile, (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) între neuronii ganglionilor nodoză și petrosală. Analiza semicantitativă RT-PCR a fost utilizată pentru a compara nivelurile de expresie a ARNm ale mai multor canale TRP în raport cu expresia ARNm GAPDH. Rezultatele a 9 experimente au fost rezumate în (B). Valorile au fost în medie ± sem. * p < 0.05, prin testare t în perechi.
Discuție
În prezentul studiu, s-au comparat proprietățile mecanosensibile ale baroreceptorilor aortici și carotizi. Studiile cu cleme de patch-uri cu celule întregi au arătat că, comparativ cu neuronii sinusului carotidian, un procent mai mare de neuroni depresori aortici au fost sensibili la întindere. Mai mult, pragul de presiune care ar putea declanșa focuri de acțiune potențiale sa dovedit a fi mai mic în neuronii baroreceptorilor aortici decât în neuronii baroreceptorilor carotizi. Creșterea citosolică a Ca2 + indusă de întindere uniaxială a fost, de asemenea, comparată între depresorul aortic și neuronii sinusului carotidian.Mărimea creșterii citosolice a Ca2 + ca răspuns la întinderea uniaxială a fost mult mai mare în neuronii baroreceptorilor aortici decât în neuronii baroreceptorilor carotizi. Neuronii baroreceptori aortici au prezentat, de asemenea, un prag mai scăzut al răspunsurilor citosolice Ca2 + la întinderea uniaxială. Într-o altă serie de experimente, am constatat că creșterea indusă de presiune în focurile potențiale de acțiune a fost mai mare în nervul depresor aortic decât în nervul sinusal carotidian. Luate împreună, datele noastre oferă dovezi puternice că baroreceptorii aortici sunt mai sensibili la tensiunea arterială decât baroreceptorii carotizi. Cu toate acestea, rezultatele sunt controversate. Unele rapoarte au concluzionat că baroreceptorii aortici sunt mai sensibili la schimbarea presiunii (Glick și Covell, 1968; Fan și colab., 1996; Pickering și colab., 2008), în timp ce alții au afirmat că baroreceptorii carotizi sunt mai sensibili la schimbarea presiunii (Donald și Edis, 1971; Fadel și colab., 2003). Cu toate acestea, aproape toate aceste studii anterioare au implicat proceduri chirurgicale extrem de complicate și au utilizat în cele din urmă răspunsuri baroreflex, cum ar fi ritmul cardiac și producția simpatică renală, ca puncte finale pentru analiza sensibilității baroreceptorilor. Procedurile chirurgicale complicate sunt predispuse să introducă erori experimentale, care pot duce la concluzii controversate. Mai mult, este posibilă și variația dependentă de speciile de animale în sensibilitatea baroreceptorilor. Mai mult, răspunsul baroreflex nu este influențat doar de sensibilitatea baroreceptorilor, ci și de alți factori multipli, inclusiv conducerea nervoasă, medierea centrală, contractilitatea vaselor de sânge și funcția inimii. Prin urmare, dovezile din studiile anterioare sunt indirecte și greu ideale. Până în prezent, există o lipsă de studii directe care să compare sensibilitatea la presiune a neuronilor baroreceptori aortici vs. În acest studiu, mecanosensibilitatea a fost studiată direct în neuronii baroreceptorilor. Datele sugerează cu tărie că baroreceptorii aortici sunt mai sensibili la presiune decât baroreceptorii carotizi. Aceste informații pot avea o relevanță fiziologică importantă în reglarea tensiunii arteriale.
Nu este clar ce mecanisme stau la baza diferenței de sensibilitate la presiune între baroreceptorii aortici și carotizi. Am comparat nivelul de expresie al mai multor canale TRP mecanosensibile (Figura 6) (O „Neil și Heller, 2005; Christensen și Corey, 2007; Pedersen și Nilius, 2007; Patel și colab., 2010). Rezultatele noastre au arătat că neuronii baroreceptorilor aortici au o expresie mai mare a mai multor canale TRP mecanosensibile, inclusiv TRPV4 și TRPC6. Este posibil ca o expresie mai mare a TRPV4 și / sau TRPC6 să contribuie la sensibilitatea la presiune ridicată a baroreceptorilor aortici. Sunt necesare studii suplimentare pentru a verifica rolul acestor canale ionice.
S-a raportat anterior că ganglionul nodoz și ganglionul petrosal conțin două tipuri diferite de neuroni (Belmonte și Gallego, 1983). Unul dintre aceștia oferă potențiale de acțiune continuă la stimularea electrică, în timp ce celălalt oferă doar o singură acțiune. Autorii i-au atribuit pe primii neuroni sensibili la presiune și pe cei din urmă ca neuroni sensibili la chimio. Rezultatele noastre indică faptul că este posibil să nu fie adecvată Trebuie să atribuiți neuronii sensibili la presiune și neuronii insensibili la presiune doar pe baza faptului că declanșează un singur potențial de acțiune sau potențial de acțiune continuă ca răspuns la curentul de depolarizare. De fapt, un procent mare de celule care declanșează un singur potențial de acțiune ca răspuns la stimularea electrică sunt, de asemenea, sensibile la presiune și, prin urmare, aparțin neuronilor baroreceptor care detectează presiunea (Figura 2 și Tabelul 1).
Pe scurt, prezentul studiu oferă dovezi că baroreceptorii aortici sunt mai sensibili la presiune decât baroreceptorii carotizi și adaugă informații noi la înțelegerea fiziologiei de bază.
Contribuțiile autorului
EL iar XY proiectează experimentele și redactează manuscrisul. EL, CL și YY efectuează experimentele. XY, YH, AM și LJ au revizuit manuscrisul. Toți autorii au aprobat versiunea finală a manuscrisului.
Finanțare
Această lucrare a fost susținută de subvenții din partea Comitetului pentru subvenții pentru cercetare din Hong Kong CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 și RGC-NSFC Joint Grant N_CUHK439 / 13.
Declarația privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
James, JEA și Daly, MDB (1970). Comparația răspunsurilor vasomotorii reflexe la stimularea separată și combinată a sinusului carotidian și a baroreceptorilor arcului aortic prin presiuni pulsatile și non-pulsatile la câine. J. Fiziol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
PubMed Abstract | Text integral CrossRef | Google Scholar
Levy MN, P. A. (2007). Fiziologie cardiovasculară. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. și Luciano, D. S. (1998). Fiziologia umană: mecanismul funcției corpului. Boston, MA: WCB McGraw-Hill.