Frontiere în imunologie
Introducere
Preeclampsia este o boală specifică sarcinii care afectează 3-5% din toate sarcinile (1, 2). Se manifestă cu hipertensiune arterială recent debutată după 20 de săptămâni de gestație și proteinurie. Placenta este centrală în patogeneza bolii prin conectarea mamei la făt (3). Interfața materno-fetală este zona în care țesutul genetic diferit de origine fetală se întâlnește cu circulația maternă, endoteliul și sistemul imunitar. Adesea numită boala teoriilor, o perspectivă general acceptată este că preeclampsia afectează endoteliul matern provocând perturbări ale funcției endoteliului, ceea ce duce la hipertensiune și proteinurie (2). În forma sa severă, preeclampsia poate duce la întârzierea creșterii fetale, prematuritate, iar pentru mamă poate provoca insuficiență de organ în rinichi și ficat, precum și eclampsie. În plus, preeclampsia poate avea consecințe cardiovasculare negative pe termen lung pentru mamă și nou-născut (4). Dezvoltarea placentei este considerată inadecvată în mod specific în procesul de transformare a arterei spirale materne, unde celulele trofoblaste invadează latura maternă în deciduă și transformă arterele în conducte cu rezistență scăzută, înlocuind și endoteliul matern (5-7). De obicei, această remodelare a arterelor uterine este absentă sau incompletă, în special în forma severă de preeclampsie. Rezistența ridicată în arterele uterine restrânse determină fluxul de sânge turbulent în spațiul interilos al placentei provocând stres oxidativ și leziuni mecanice arborilor vilosi placentari. Deteriorarea rezultată crește vărsarea placentară a microparticulelor și a mediatorilor inflamatori, rezultând activarea și disfuncția endotelială generalizată (8, 9). Aceste evenimente secvențiale în interfața materno-fetală duc la hipertensiune maternă și la alte simptome descrise mai sus. (10, 11). Sindromul HELLP se caracterizează prin hemoliză, enzime hepatice crescute și trombocite scăzute. De multe ori necesită observare intensivă a nivelului de terapie intensivă și terapie simptomatică. Patogeneza sindromului este încă în umbră. Sindromul HELLP împărtășește trăsături comune cu microangiopatiile trombotice (TMA), cum ar fi purpura trombotică trombocitopenică (TTP) și sindromul hemolitic uremic (HUS). TMA sunt prezente în diverse grupuri de boli cu caracteristici comune ale hemolizei microangiopatice, trombocitopeniei și leziunilor organelor rezultate din microtrombi. În TTP, un defect genetic sau, ca în marea majoritate a cazurilor, a dobândit autoanticorpi împotriva dezintegrinei și metaloproteinazei cu trombospondină de tip 1 motiv 13 (ADAMTS13), enzima care scindează factorul von Willebrand activat (vWF), cauzează formarea unor neobișnuit de mari activat multimeri vWF pe celulele endoteliale ducând la trombi plachetari în vase mici și hemoliză. HUS tipic este cauzat de infecția bacteriană care produce toxina Shiga (în special Escherichia coli), în timp ce HUS atipic (aHUS) se referă la tipul de TMA, în care stau deficiențele genetice ale regulatorilor căii alternative a sistemului complementului, care, în prezența a unui declanșator poate provoca boala clinică (12, 13). Tratamentul aprobat de FDA pentru aHUS este perfuzia de antagonist al complementului C5 eculizumab, care previne formarea complexului de atac de membrană (MAC) (Figura 1). Clinic HELLP are aceleași simptome ca TMA clasice: hemoliză, trombocitopenie și tulburări de organ observate în ficat. În funcție de clasificarea TMA utilizată, sindromul HELLP este de obicei clasificat ca parte a TMA secundare sau dobândite (Tabelul 1).
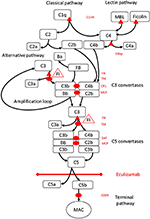
Figura 1. Eculizumab inhibă calea terminală de activare a complementului. Activarea complementului poate fi inițiată prin trei căi de activare, care toate duc la formarea convertazelor C5 care au capacitatea de a activa calea terminală care duce la formarea MAC pe suprafața țintă. Această ilustrație schematică a sistemului complementului arată cei mai relevanți activatori (cu font negru) și inhibitori (cu roșu). Activatorii pot fi legați de membrană (oval) sau solubili (triunghi). Calea alternativă se activează spontan pe toate suprafețele care nu permit inhibarea factorului regulator solubil H (FH). FH acționează ca cofactor pentru inactivarea C3b la iC3b de factorul I (FI). Trombomodulina (TM) îmbunătățește activitatea cofactorului FH. Factorul B scindat (FB) împreună cu activatorul C3b formează calea alternativă convertază, care are capacitatea de a cliva C3 în C3b creând o buclă de amplificare a activării căii alternative.Calea clasică de activare a complementului poate fi inițiată, de exemplu, prin legarea complexelor imune la C1q, în timp ce calea lectinei este activată prin lectina care leagă manozele (MBL) sau legarea de ficoline la, de exemplu, modelele de carbohidrați de pe microbi. Activarea căii lectinei are ca rezultat serin proteazele 1 și 2 asociate cu manoză (MASP-1 și MASP-2, neprezentate) care scindează componentele complementului C4 și C2 pentru a forma calea clasică convertază C4bC2b. Inhibitorul C1 (C1inh) și C4bp sunt regulatorii solubili ai căii clasice, în timp ce proteina cofactor membranară (MCP) și receptorul complementului 1 (CR1) sunt regulatori legați de membrană ai căilor timpurii ale complementului. Formarea convertazelor C5 inițiază calea terminală de activare a complementului și scindarea C5 în absența factorilor de accelerare a descompunerii (DAF) și MCP a regulatorilor de suprafață. Asamblarea MAC este reglată de regulatorul de suprafață CD59 (protectin). Scindarea C3 în căile timpurii și C5 în calea terminală eliberează anafilatoxine C3a și C5a și are ca rezultat inflamații. Eculizumab este un anticorp recombinant umanizat împotriva proteinei complementului C5, care inhibă scindarea C5 de către convertazele C5 reglând astfel efectele protrombotice și proinflamatorii ale activării complementului. Pacientul descris în acest raport de caz a fost testat pentru mutații genetice în gene care codifică factorul H (CFH), FHR5 și MCP, CFI, CFB, THBD și ADAMTS13 (ADAMTS13), un regulator al căii vWF a cascadei de coagulare (nu afișate). Rezultatele testării genetice au fost negative.

Tabelul 1. Criteriile de diagnostic HELLP și aHUS.
În acest studiu de caz, raportăm un pacient cu o TMA complicată indusă de sarcină și cu un curs de tratament de succes.
Prezentarea cazului
Primigravida în vârstă de douăzeci și nouă de ani a fost trimisă la vârsta gestațională de 34 + 2 ani la spitalul universitar din Helsinki ambulatoriu cu dureri de stomac superioare. Inițial, tensiunea arterială a fost modest crescută (133/91 mmHg) și joja urinară pozitivă pentru proteine. Durerea de stomac superioară raportată inițial s-a îmbunătățit treptat. La ecografie, fătul a avut un profil biofizic normal (BPP), estimarea greutății a fost la curba de creștere -2 SD. Cardiotocografia (CTG) a fost normală. Hemoglobina din sânge (Hb) a fost de 115 g / L, trombocitele de 158 E9 / L (interval normal 150-360 E9 / L), alanina aminotransferază (ALT) a fost normală (23 U / L). Joja urinară a fost pozitivă pentru proteine (+2), iar proteinuria calculată a fost de 1,6 g / 24 ore. S-a luat decizia de a iniția tratamentul cu cortizon pentru a facilita maturizarea pulmonară a bebelușului. Pacientul a fost externat cu un plan de a reveni a doua zi pentru controlul de control și a doua doză de cortizon. După cum era programat, ea a venit pentru control în săptămâna gestațională 34 + 4. Presiunea arterială a fost de 147/87 mmHg, ALT 23, trombocite 177, CTG și BPP al fătului în ultrasunete a fost normal. A fost externată și a fost programat un alt control. În după-amiaza aceleiași zile, durerea superioară a stomacului a revenit și s-a agravat constant spre seară. S-a întors la spital la ora 2.20 dimineața. Se confrunta cu dureri de stomac strânse, neliniște și vărsase de două ori și simțea tremurături. Tensiunea arterială a fost în mod clar crescută la 170/94 mmHg, joja de proteină din urină a fost puternic pozitivă, ALT a fost crescută la 159, Hb 122 și trombocitele 172. A fost internată în secția prenatală. La 4 dimineața avea dureri de cap. S-a început medicația antihipertensivă (Labetalol 100 mg de trei ori). Excreția de proteine din urină a atins vârful noaptea fiind de 13 g / 24 ore. Ulterior, a început să vomite, a avut dureri de stomac superioare, dureri de cap, iar monitorizarea CTG a arătat decelerări. Pacientul a fost transferat la ora 7.11 dimineața în secția de naștere și, deoarece colul uterin a fost dilatat cu trei centimetri, membranele fetale au fost rupte artificial pentru inducerea travaliului. În același timp, testele de laborator au fost finalizate cu Hb 122, trombocite 172. Cu toate acestea, lactatul dehidrogenază (LD) a fost în mod clar crescut la 1231 U / L în acest moment. În CTG, decelerările au continuat și, pe măsură ce bradicardia a continuat, s-a efectuat o operație cezariană de urgență. Copilul de sex masculin (1960 g, -2 SD) s-a născut la 7,25 a.m., cu o valoare a pH-ului arterei ombilicale de 7,05, BE -6,80, Apgar 1/6/8. Pierderea de sânge în operație a fost de 400 ml.
La 9 dimineața după operația cezariană, trombocitele mamei erau scăzute la 49, cu Hb de 102. Până în după-amiaza, ALT a crescut la 1800, LD 3570 , nivelul creatininei serice a fost de 153 (μmol / L), în timp ce trombocitele au scăzut la 33. Au existat perturbări ale coagulării indicate de nivelul scăzut de fibrinogen (1,1 g / L, valori de referință 2-4 g / L) și nivelul ridicat de D -dimer de fibrină (30,2 mg / L, < 0,5 mg / L). A existat o oarecare sângerare de la plaga prin operație cezariană, în care au fost plasate suturi suplimentare.În acest moment, au fost administrate opt unități de trombocite. Nivelul de potasiu a crescut de la 4,7 la 5,6 (mmol / L). Hemoliza a fost clar observată. Testul Coombs a fost negativ. Excreția de urină a fost de numai 10 ml / h. Testul de laborator a arătat în mod clar o boală severă cu semne de afectare atât a rinichilor, cât și a ficatului. În plus, a existat tulburări în sistemul de coagulare, prezentând coagulare semnificativă și fibrinoliză marcată simultan. Infuzia de sulfat de magneziu a fost începută din cauza hiperreflexiei, care este considerată un semn predictiv al convulsiilor, o complicație severă a preeclampsiei. S-a început administrarea intravenoasă de dexametazonă 10 mg, iar pacientul a fost transferat în unitatea de terapie intensivă (UCI).
Mai mult, au fost emise teste de laborator în scopuri diagnostice diferențiale ale altor urgențe medicale (Tabelul 2). Activitatea ADAMTS13 a fost normală 62% (40-130%), ceea ce exclude TTP. Complementele serice C3 (0,52 g / L, 0,71-1,41 g / L) și C4 (0,07 g / L, 0,12-0,34 g / L) au fost scăzute. Nivelul complexului terminal solubil al complementului (C5b-9, 971 ng / mL, < 366 ng / mL) a fost crescut în prima zi postpartum. Anticorpii antifosfolipidici nu au fost detectați, serologia infecției referitoare la hepatita B și C, iar HIV a fost negativă. Din proba de scaun, agenții patogeni care cauzează HUS tipic au fost negativi.

Tabelul 2. Cronologia diagnosticului și tratamentului bolii.
Pacientul a fost tratat cu tratament de schimb plasmatic în prima și a doua zi postpartum și a fost hemodializată de trei ori pe parcursul tratamentului (zilele 2, 4 și 6 postpartum).
În a treia zi postpartum, pacientul a fost stabil și a fost transferat înapoi în camera de recuperare a spitalului pentru femei au fost observate și terapia simptomatică a fost continuată. Hipertensiunea a fost tratată cu Amlodipină 10 mg de două ori pe zi și Labetalol 200 mg de trei ori pe zi. În a patra zi postpartum, trombocitele au continuat să scadă și pacientul a fost diagnosticat cu HUS. Adesea diagnosticul diferențial cu sindrom HELLP și aHUS constă în recuperarea spontană a pacienților cu HELLP, de obicei în a treia zi postpartum. Tratamentul cu eculizumab a fost început (900 mg IV). ent a primit o vaccinare pneumococică și a început antibioticul profilactic (penicilină). Pacienta a primit împreună patru doze săptămânale de eculizumab (900 mg) și a început să-și revină rapid. Nu a mai fost nevoie de hemodializă ulterioară după a treia hemodializă în a șasea zi postpartum (Figura 2). Funcția rinichilor a fost corectată treptat, numărul de trombocite crescut și hemoliza rezolvată. La patru săptămâni după naștere, nivelurile plasmatice de C3 și C4 au fost normalizate.
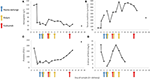
Figura 2. Valori de laborator selectate observate în stadiile incipiente ale bolii și momentul schimbului de plasmă, al hemodializei și al administrării eculizumabului. În panoul (A) este reprezentată dezvoltarea măsurătorilor hemoglobinei din sânge, în panoul (B) nivelul seric de creatinină, în panoul (C) numărul de trombocite și în panoul (D) dimerul valorilor fibrinei pe parcursul celor 17 zile perioada de urmărire.
În testarea genetică, nu au fost identificate polimorfisme genice cunoscute. Ea a fost testată pentru mutații ale regulatorilor complementului Factor H (CFH), proteinei legate de factorul H 5 (FHR5) și proteine co-factorice de membrană (MCP), complementului factorului inactivator al căii alternative I (CFI), factorului activator alternativ al căii B (CFB) ), și următoarele componente ale cascadei de coagulare: ADAMTS13, trombomodulină (THBD) și o enzimă intracelulară, diacilglicerol kinaza E (DGKE), ale cărei mutații sunt cauzele cunoscute ale aHUS (14). Mai mult, nici anticorpii împotriva factorului H nu au fost detectați. Nu a fost detectată nicio deficiență C4.
Ca rezumat, pacientul nostru a avut preeclampsie severă și a îndeplinit criteriile de diagnostic pentru sindromul HELLP. Deși testarea genetică pentru aHUS a rămas negativă, evoluția clinică a bolii (în special, leziuni renale acute severe) și răspunsul la tratament (în special, eculizumab) au sugerat că pacientul nostru a avut un SHUH indus de sarcină.
Discuție
Primigravida descrisă mai sus a fost diagnosticată cu preeclampsie severă, sindrom HELLP și aHUS indus de sarcină. Nu au fost descoperite mutații genetice cunoscute, care ar putea predispune la un SHU. Diagnosticul diferențial între tipurile de TMA, TTP, HUS / aHUS și TMA secundare, cum ar fi sindromul HELLP, este important. Mai ales TTP trebuie identificat devreme, deoarece boala este tratată cu schimb rapid zilnic de plasmă până la remisie (15). doar până la 40-60% din cazurile de SHU, lăsând posibilitatea unor cazuri false negative. Prin urmare, un rezultat negativ al testului pentru mutații nu exclude un aHUS adevărat (16).Rar a fost indus un SHUS după sarcină și după naștere. În aceste cazuri, în următorii trei ani ~ 50% au dezvoltat boli renale cronice (CKD), unele chiar boală renală în stadiu final (ESKD). Când s-au observat mutații genetice, până la 85% pot dezvolta CKD sau ESKD (17).
Se acceptă în general că în tulburările hipertensive ale sarcinii, inflamația placentară are ca rezultat disfuncție endotelială. Dacă integritatea endoteliului este perturbată, rezultă activarea complementului și coagularea (18). De asemenea, sa presupus că endoteliul matern perturbat contribuie la morbiditatea maternă a vieții ulterioare, asociată cu preeclampsie severă și alte tulburări de sarcină hipertensivă (2, 19). S-a demonstrat că endoteliul deteriorat funcționează anormal chiar și la ani după ce simptomele diagnostice inițiale scad (20-23).
La până la 46% dintre pacienții HELLP, mutațiile genetice au fost descrise în regulatorii căii alternative a sistemului complementului (24, 25). În stadiile incipiente ale sarcinii, când placenta se dezvoltă, activarea sistemului complementului se observă la niveluri crescute de Bb în ser la pacienții care au dezvoltat ulterior preeclampsie (26). Activarea sistemului complementar a fost observată în preeclampsie severă și sindromul HELLP, iar niveluri ridicate de complex terminal (C5b-9) au fost detectate în urină la pacienții cu preeclampsie severă. La pacienții cu sindrom HELLP, activarea crescută a sistemului complementului a fost demonstrată prin testul funcțional și, în plus, prin deficiențele de expresie în CD55 și CD59, ducând la o scădere a reglării și activarea exacerbată a sistemului complementului (27-29).
Există multe asemănări împărtășite între sindromul HELLP și aHUS. În ambele condiții, tulburarea endoteliului este implicată în mod clar urmată de complement și activarea coagulării. În preeclampsie severă și sindrom HELLP, eculizumab administrat la primele semne ale bolii severe și TMA ar fi benefic pentru protecția rinichilor și a endoteliului matern (30). Păstrarea integrității endoteliale poate proteja potențial pacientul de riscurile pe termen lung pentru sănătate, cum ar fi bolile cardiovasculare. De obicei, în TMA legate de sarcină, constatările clinice ale hemolizei și trombocitopeniei se rezolvă în aproximativ 3 zile. Dacă activitatea bolii durează mai mult, diagnosticul diferențial trebuie continuat și abia atunci se ia în considerare tratamentul alternativ (de exemplu, eculizumab). Introducerea mai timpurie a tratamentului cu eculizumab ar aduce beneficii femeilor prin prevenirea afectării rinichilor și minimizarea turbulențelor din endoteliu și a inflamației sistemice. Eculizumab, administrat suficient de devreme și doar una sau două doze, ar putea fi suficient pentru a opri turbulența și pentru a opri cascada evenimentelor (31). Pe de o parte, eculizumab este un medicament foarte scump, dar pe de altă parte, costul tratamentului de terapie intensivă, schimbul de plasmă, hemodializa, posibilul transplant de rinichi, ca să nu mai vorbim de consecințele emoționale pentru mame și familii rămân inestimabile.
Ca o concluzie, pacientul nostru a fost grav bolnav, suferind hemoliză, tulburări ale coagulării, leziuni hepatice și insuficiență renală care au necesitat internarea în UCI și hemodializă. Este posibil ca eculizumabul, dacă este inițiat mai devreme, la primele semne ale sindromului HELLP, să fi fost benefic în cursul ulterior al bolii, reducând potențial leziunile renale și prevenind astfel necesitatea hemodializei și ulterior a BCR. Prin urmare, în această eră a medicinei imunologice moderne, am putea face mai multe pentru mame și familii decât să așteptăm și să sperăm la cele mai bune?
Declarație etică
Revizuirea etică și aprobarea nu au fost necesare pentru studiul participanților umani în conformitate cu legislația locală și cerințele instituționale. Pacienții / participanții și-au acordat consimțământul scris în scris pentru a participa la acest studiu.
Contribuțiile autorului
AL și JH-E au dezvoltat ideea manuscrisului și au scris manuscrisul. JH-E și MH au fost implicați în îngrijirea diagnostică și terapeutică a pacientului. Toți autorii au examinat și editat manuscrisul și au aprobat versiunea sa finală pentru publicare.
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretat ca un potențial conflict de interese.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Rezultate adverse ale sarcinii și viitoare boli cardiovasculare materne. Clin Cardiol. (2018) 41: 239-46. doi: 10.1002 / clc.22887
PubMed Abstract | Text integral CrossRef | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” sindromele obstetricale mari „sunt asociate cu tulburări ale placentării profunde. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed Abstract | Text integral CrossRef | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Amorsare inflamatorie sistemică în sarcină normală și preeclampsie: rolul microparticulelor sincitotrofoblaste circulante. J Immunol. (2007) 178: 5949-56. doi: 10.4049 / jimmunol.178.9.5949
PubMed Abstract | Text integral CrossRef | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Actualizarea veziculelor extracelulare derivate din sinciotrofoblast în sarcină normală și preeclampsie. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | Text integral CrossRef | Google Scholar
10. Weinstein L. Sindromul de hemoliză, enzimele hepatice crescute și trombocitele scăzute număr: o consecință severă a hipertensiunii arteriale în timpul sarcinii. Sunt J Obstet Gynecol. (1982) 142: 159-67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | Text integral CrossRef | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Diferențierea dintre sindromul HELLP sever și microangiopatie trombotică, purpură trombocitopenică trombotică și alți imitatori. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68-72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | Text integral CrossRef | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Afectarea funcției endoteliale la femeile cu antecedente de preeclampsie: un indicator al riscului cardiovascular. Am J Physiol Hear Circ Physiol. (2004) 286: 1-3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | Text integral CrossRef | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Personal AC. Funcția endotelială și biomarkerii circulanți sunt perturbați la femei și copii după preeclampsie. Hipertensiune. (2011) 58: 63-9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | Text integral CrossRef | Google Scholar
23. Stanhewicz AE. Disfuncție vasculară reziduală la femeile cu antecedente de preeclampsie. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | Text integral CrossRef | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S și colab. Mutațiile germinale în calea alternativă a complementului predispun la sindromul HELLP. Perspective JCI. (2018) 3: 0-13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | Text integral CrossRef | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, un nou tratament potențial pentru leziuni renale acute asociate cu preeclampsie / sindrom HELLP. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | Text integral CrossRef | Google Scholar