Geologie fizică
Marea majoritate a mineralelor care alcătuiesc rocile scoarței terestre sunt minerale de silicat. Acestea includ minerale precum cuarț, feldspat, mică, amfibol, piroxen, olivină și o mare varietate de minerale argiloase. Blocul de construcție al tuturor acestor minerale este tetraedrul de silice, o combinație de patru atomi de oxigen și un atom de siliciu. Acestea sunt aranjate astfel încât planurile trase prin atomii de oxigen formează un tetraedru (Figura 2.6). Deoarece ionul siliciu are o sarcină de +4 și fiecare dintre cei patru ioni de oxigen are o sarcină de –2, tetraedrul de silice are o sarcină netă de –4.
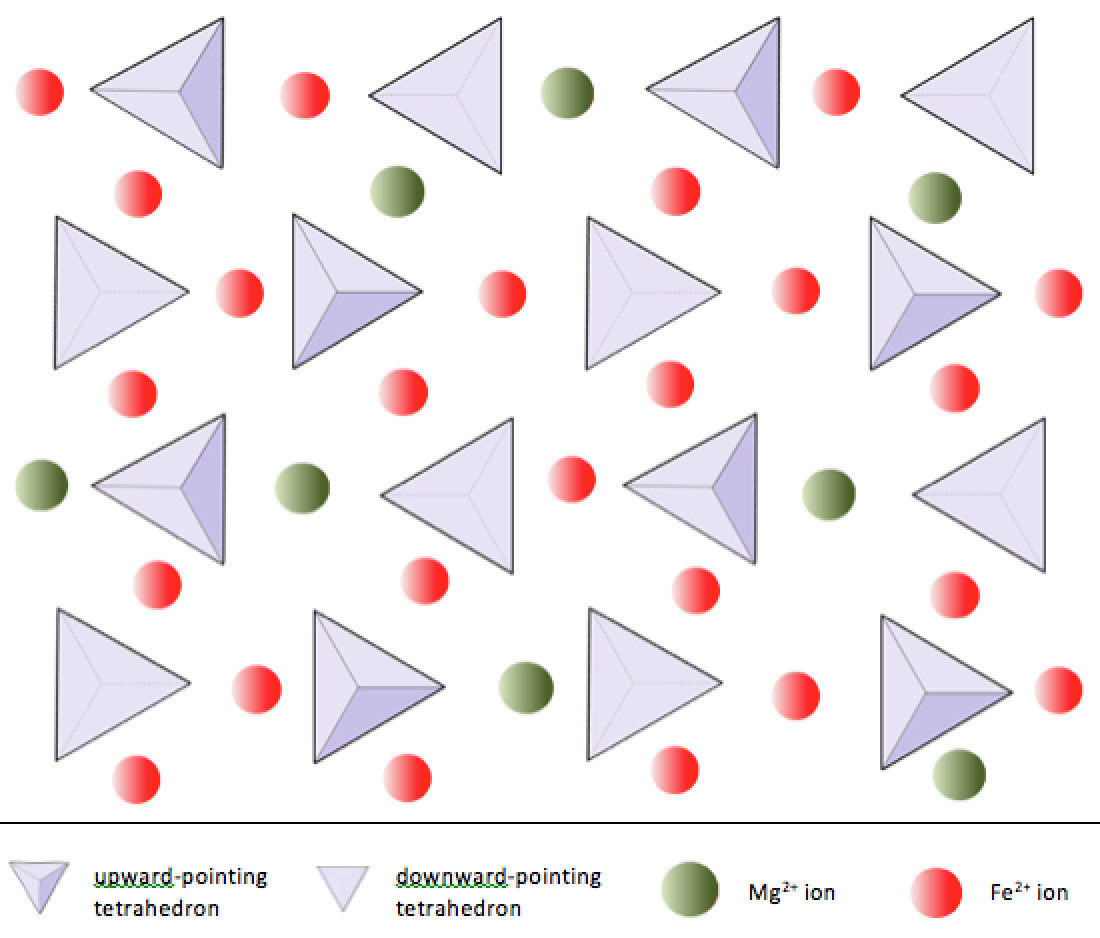
În mineralele silicat, aceste tetraedre sunt aranjate și legate între ele într-o varietate de moduri, de la unități unice la cadre complexe (Figura 2.9). Cea mai simplă structură de silicat, cea a olivinei minerale, este compusă din tetraedre izolate legate de ioni de fier și / sau magneziu. În olivină, sarcina –4 a fiecărui tetraedru de silice este echilibrată de doi cationi divalenți (adică +2) de fier sau magneziu. Olivina poate fi fie Mg2SiO4, fie Fe2SiO4, fie o combinație a celor două (Mg, Fe) 2SiO4. Cationii bivalenți de magneziu și fier au o rază destul de apropiată (0,73 față de 0,62 angstromi). Datorită acestei similitudini de mărime și pentru că sunt ambii cationi divalenți (ambii au o sarcină de +2), fierul și magneziul se pot substitui ușor reciproc în olivină și în multe alte minerale.
| Configurare tetraedru | Exemple de minerale | |
|---|---|---|
 |
Izolat (nesosilicați) | Olivină, granat, zircon, cianit |
 |
Perechi (sorosilicați) | Epidot, zoisit |
 |
Inele (ciclosilicați) | Turmalină |
 |
Lanțuri simple (inosilicați) | Piroxeni, wollastonite |
 |
Lanțuri duble (inosilicați) | Amfiboli |
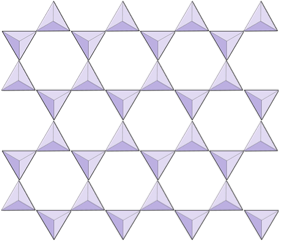 |
Foi (filosilicați) | Mica, minerale argiloase, serpentină, clorit |
| 3-dimensional structură | Cadru (tectosilicați) | Feldspati, cuarț, zeolit |
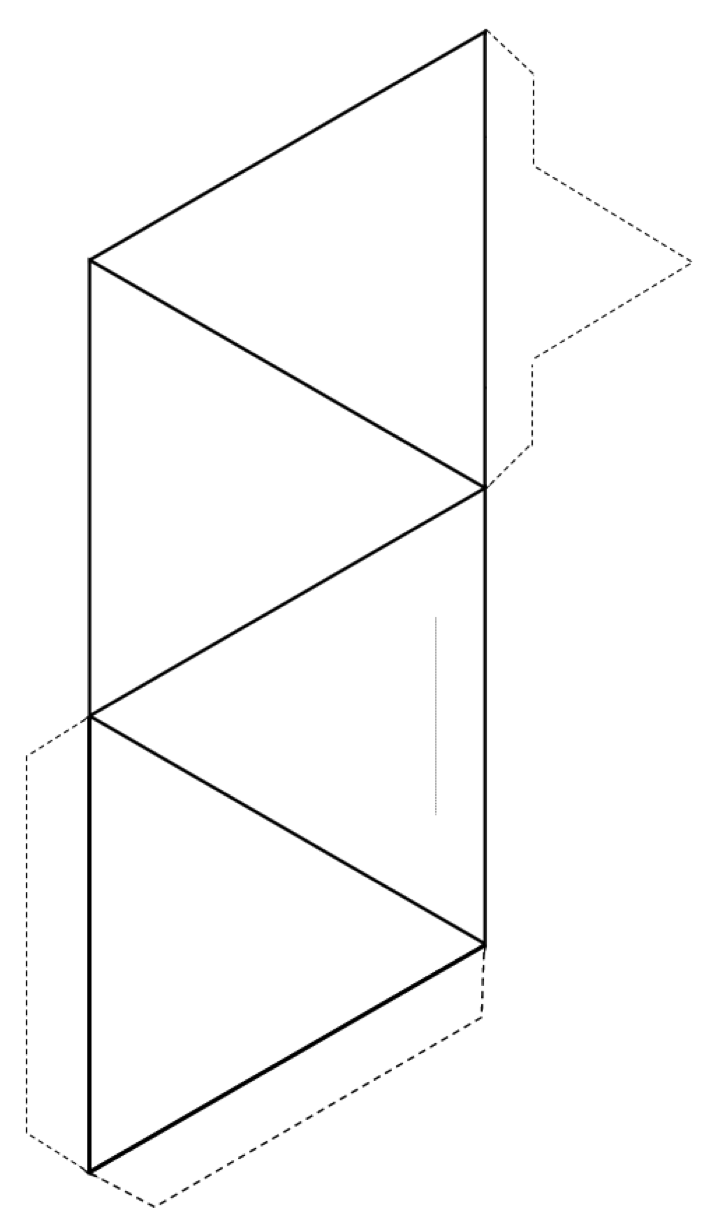
Exercițiul 2.3 Faceți un tetraedru
Tăiați în jurul exteriorului formei (linii solide și linii punctate), apoi îndoiți de-a lungul liniilor solide pentru a forma un tetraedru.
Dacă aveți lipici sau bandă, fixați file către tetraedru pentru a-l ține împreună. Dacă nu aveți lipici sau bandă, faceți o felie de-a lungul liniei gri subțiri și introduceți fila ascuțită în fantă.
Dacă faceți acest lucru într-o clasă, încercați să vă alăturați tetraedrul cu alții în perechi, inele, lanțuri simple și duble, foi și chiar cadre tridimensionale.
În olivină, spre deosebire de majoritatea celorlalte minerale silicatice, tetraedrul de silice nu este legat de fiecare alte. Acestea sunt, totuși, legate de fier și / sau magneziu așa cum se arată în Figura 2.10.
După cum sa menționat deja, +2 ioni de fier și magneziu au dimensiuni similare (deși nu sunt la fel). Acest lucru le permite să se substituie reciproc în unele minerale silicatice. De fapt, ionii obișnuiți din mineralele silicat au o gamă largă de dimensiuni, așa cum se arată în Figura 2.11. Toți ionii prezentați sunt cationi, cu excepția oxigenului. Rețineți că fierul poate exista atât ca ion +2 (dacă pierde doi electroni în timpul ionizării), fie ca ion +3 (dacă pierde trei). Fe2 + este cunoscut sub numele de fier feros. Fe3 + este cunoscut sub numele de fier feric. Razele ionice sunt esențiale pentru compoziția mineralelor silicatice, așa că ne vom referi din nou la această diagramă.

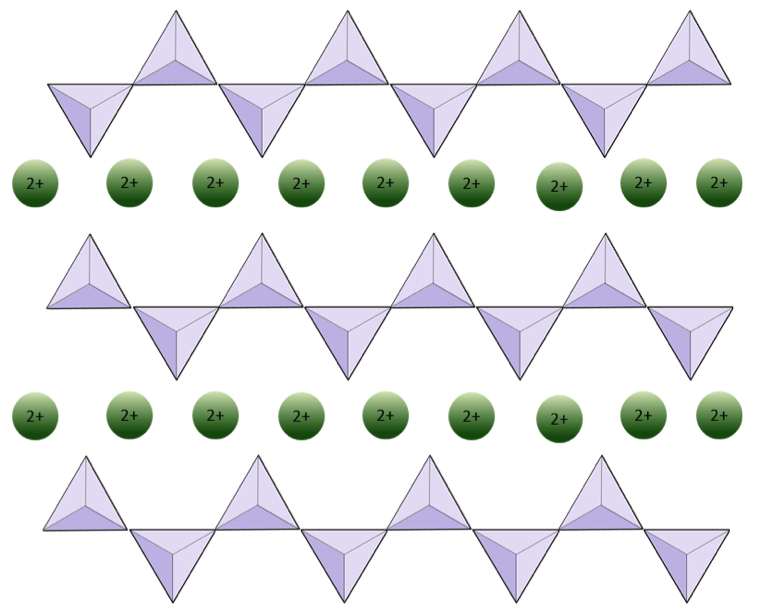
Structura lanțului unic piroxenul silicat este prezentat în figurile 2.12 și 2.13. În piroxen, tetraedrele de silice sunt legate între ele într-un singur lanț, unde un ion de oxigen din fiecare tetraedru este împărțit cu tetraedrul adiacent, prin urmare există mai puțini oxigeni în structură.Rezultatul este că raportul oxigen-siliciu este mai mic decât în olivină (3: 1 în loc de 4: 1), iar sarcina netă per atom de siliciu este mai mică (–2 în loc de –4), deoarece sunt necesari mai puțini cationi pentru a echilibra acea taxă. Compozițiile piroxene sunt de tip MgSiO3, FeSiO3 și CaSiO3, sau o combinație a acestora. Piroxenul poate fi scris și ca (Mg, Fe, Ca) SiO3, unde elementele din paranteze pot fi prezente în orice proporție. Cu alte cuvinte, piroxenul are un cation pentru fiecare tetraedru de silice (de exemplu, MgSiO3) în timp ce olivina are doi (de exemplu, Mg2SiO4). Deoarece fiecare ion de siliciu este +4 și fiecare ion de oxigen este –2, cei trei oxigeni (–6) și cel de siliciu (+4) dau o sarcină netă de –2 pentru lanțul unic de tetraedru de silice. În piroxen, un cation bivalent (2+) per tetraedru echilibrează acea încărcare -2. În olivină, este nevoie de doi cationi divalenți pentru a echilibra sarcina –4 a unui tetraedru izolat.
Structura piroxenului este mai „permisivă” decât cea a olivinei – ceea ce înseamnă că cationii cu o gamă mai largă de raze ionice de aceea piroxenii pot avea cationi de fier (raza 0,63 Å) sau magneziu (raza 0,72 Å) sau calciu (raza 1,00 Å).
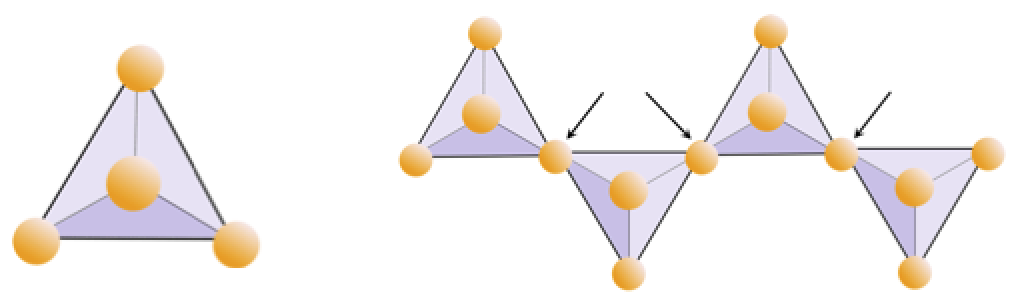
Exercițiul 2.4 Privarea de oxigen
Diagrama de mai jos reprezintă un singur lanț într-un mineral silicat. Numărați numărul de tetraedre față de numărul de ioni de oxigen (sfere galbene). Fiecare tetraedru are un ion de siliciu, deci acest lucru ar trebui să dea raportul dintre Si și O în silicații cu un singur lanț (de exemplu, piroxen).
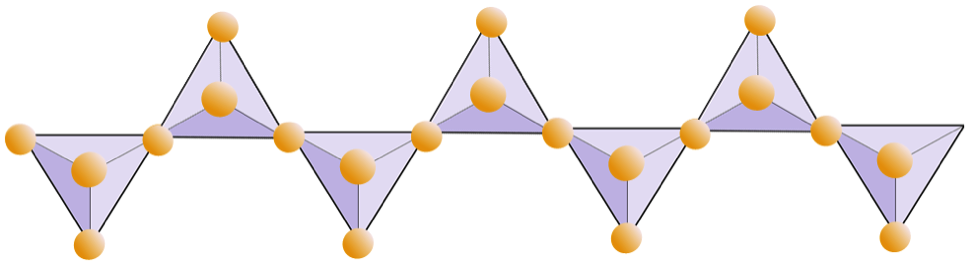
Diagrama de mai jos reprezintă un lanț dublu într-un mineral silicat. Din nou, numărați numărul de tetraedre față de numărul de ioni de oxigen. Acest lucru ar trebui să vă ofere raportul dintre Si și O în silicați cu lanț dublu (de exemplu, amfibol).
În structurile amfibolice, tetraedrele de silice sunt legate într-un lanț dublu care are un raport oxigen-siliciu mai mic decât cel al piroxenului și, prin urmare, sunt necesari și mai puțini cationi pentru a echilibra sarcina. Amfibolul este chiar mai permisiv decât piroxenul și compozițiile sale pot fi foarte complexe. Hornblenda, de exemplu, poate include sodiu, potasiu, calciu, magneziu, fier, aluminiu, siliciu, oxigen, fluor și ionul hidroxil (OH-).
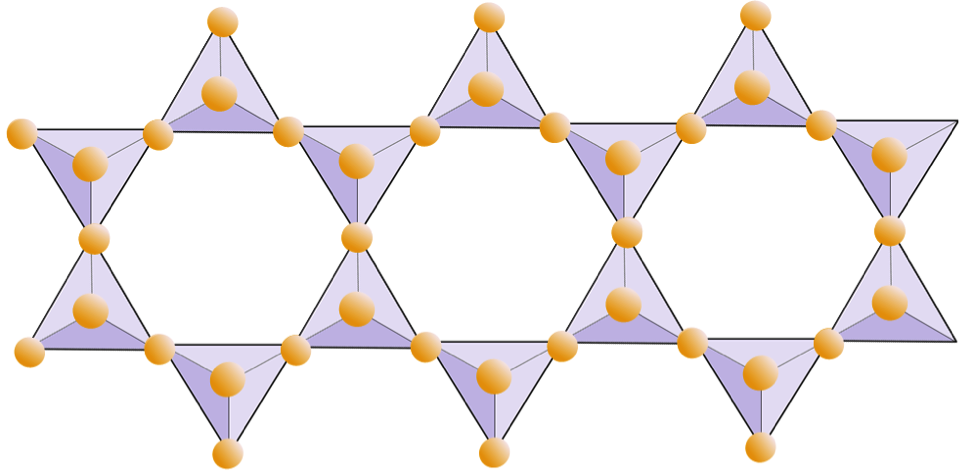
În structurile mica, tetraedrele de silice sunt dispuse în foi continue, unde fiecare tetraedru împarte trei anioni de oxigen cu tetraedrul adiacent. Există și mai multe partajări de oxigeni între tetraedrele adiacente și, prin urmare, sunt necesari mai puțini cationi de echilibrare a sarcinii pentru mineralele din silicat de foi. Legătura între foi este relativ slabă, iar acest lucru explică clivajul unidirecțional bine dezvoltat (Figura 2.14). Mica biotitică poate conține fier și / sau magneziu, ceea ce îl face un mineral de silicat feromagnesian (cum ar fi olivina, piroxenul și amfibolul). Cloritul este un alt mineral similar care include în mod obișnuit magneziu. În mica moscovită, singurii cationi prezenți sunt aluminiu și potasiu; prin urmare este un mineral silicat non-feromagnesian.

În afară de muscovit, biotit și clorit, există multe alte silicați de foi (sau filosilicați), care există de obicei ca fragmente de dimensiuni de lut (adică mai puțin de 0,004 mm). Acestea includ mineralele argiloase caolinite, ilite și smectite și, deși sunt dificil de studiat datorită dimensiunilor foarte mici, acestea sunt componente extrem de importante ale rocilor și în special ale solurilor.
mineralele au, de asemenea, apă în structura lor.
Siliciul tetraedru este legat în cadre tridimensionale atât în feldspati, cât și în cuarț. Acestea sunt minerale neferomagnetice – nu conțin fier sau magneziu.În plus față de tetraedrele de silice, feldspatii includ cationii aluminiu, potasiu, sodiu și calciu în diferite combinații. Cuarțul conține doar tetraedri de siliciu.
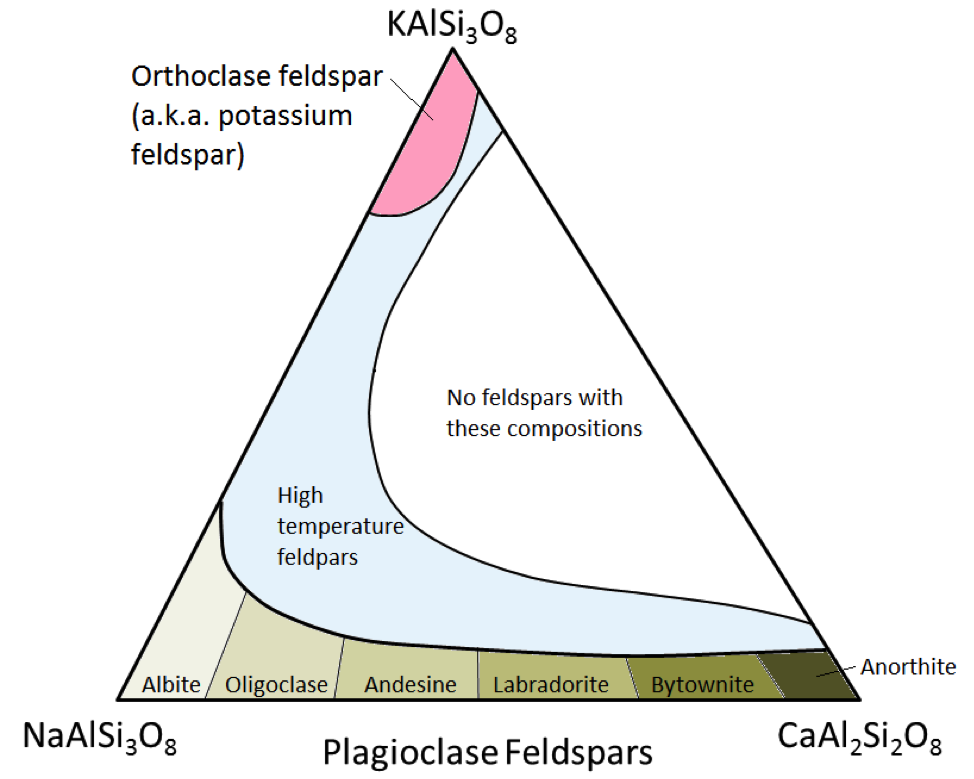
Cele trei minerale principale ale feldspatului sunt feldspatul de potasiu (aka K-feldspat sau K-spar) și două tipuri de feldspat plagioclazic: albitul (numai sodiu) și anortitul (numai calciu) . Așa cum este cazul fierului și magneziului în olivină, există o gamă continuă de compoziții (serie de soluții solide) între albită și anortită în plagioclază. Acest lucru se datorează faptului că ionii de calciu și sodiu au dimensiuni aproape identice (1,00 Å versus 0,99 Å). Orice compoziții intermediare între CaAl2Si3O8 și NaAlSi3O8 pot exista (Figura 2.15). Acest lucru este puțin surprinzător, deoarece, deși sunt foarte asemănătoare ca dimensiune, ionii de calciu și sodiu nu au aceeași sarcină (Ca2 + versus Na +). Această problemă este explicată prin substituirea corespunzătoare a lui Al3 + cu Si4 +. Prin urmare, albitul este NaAlSi3O8 (un Al și trei Si) în timp ce anortitul este CaAl2Si2O8 (doi Al și doi Si), iar feldspatii plagioclazici cu compoziție intermediară au proporții intermediare de Al și Si. Aceasta se numește „substituție cuplată”.
Feldspatii de plagioclază cu compoziție intermediară sunt oligoclaza (10% până la 30% Ca), andezina (30% până la 50% Ca), labradoritul (50% până la 70%) % Ca) și bytownite (70% până la 90% Ca). K-feldspatul (KAlSi3O8) are o structură ușor diferită de cea a plagioclazei, datorită dimensiunii mai mari a ionului de potasiu (1,37 Å) și datorită acestei dimensiuni mari , potasiul și sodiul nu se substituie ușor unul cu celălalt, cu excepția temperaturilor ridicate. Este posibil ca acești feldspati cu temperatură ridicată să se găsească numai în rocile vulcanice, deoarece rocile invazive intrusive se răcesc suficient de lent până la temperaturi scăzute pentru ca feldspatii să se transforme într-unul din forme cu temperatură mai mică.
În cuarț (SiO2), tetraedrele de silice sunt legate într-un cadru tridimensional „perfect”. Fiecare tetraedru este legat de alte patru tetraedre (cu un oxigen împărțit la fiecare colț al fiecărui tetraedru) și, ca rezultat, raportul dintre siliciu și oxigen este de 1: 2. Deoarece un cation de siliciu are o sarcină +4 și cei doi anioni de oxigen au fiecare o sarcină –2, sarcina este echilibrată. Nu este nevoie de aluminiu sau de oricare dintre ceilalți cationi, cum ar fi sodiu sau potasiu. Duritatea și lipsa decolteului în cuarț rezultă din legăturile puternice covalente / ionice caracteristice tetraedrului de silice.
Exercițiul 2.5 Silicați feromagnezi?
Mineralele de silicat sunt clasificate ca fiind feromagneziene sau neferomagnetice, în funcție de faptul că au sau nu fier (Fe) și / sau magneziu (Mg) în formula lor. O serie de minerale și formulele lor sunt enumerate mai jos. Pentru fiecare, indicați dacă este sau nu un silicat feromagnesian.
| Mineral | Formula | Silicat feromagnesian? |
|---|---|---|
| olivină | (Mg, Fe) 2SiO4 | |
| pirită | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| piroxen | MgSiO3 | |
| hematit | Fe2O3 | |
| orthoclase | KAlSi3O8 | |
| cuarț | SiO2 |
| Mineral | Formula * | Silicat feromagnesian? |
|---|---|---|
| amfibol | Fe7Si8O22 (OH) 2 | |
| muscovit | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetit | Fe3O4 | |
| biotit | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomită | (Ca, Mg) CO3 | |
| granat | Fe2Al2Si3O12 | |
| serpentină | Mg3Si2O5 (OH) 4 |
* Unele dintre formule, în special cele mai complicate, au fost simplificate.
- Un angstrom este unitatea utilizată în mod obișnuit pentru expresia atomului -dimensiuni la scară. Un angstrom este de 10-10 m sau 0,0000000001 m. Simbolul pentru un angstrom este Å. ↵