Molecula de ciclohexan
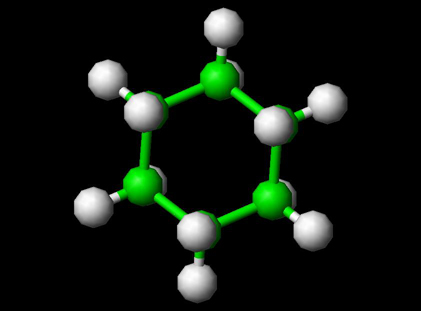
Ciclohexanul este un cicloalcan cu formula moleculară C6H12. Ciclohexanul este utilizat ca solvent nepolar pentru industria chimică și, de asemenea, ca materie primă pentru producția industrială de acid adipic și caprolactam, ambele fiind intermediare utilizate în producția de nailon. La scară industrială, ciclohexanul este produs prin reacția benzenului cu hidrogenul. Datorită proprietăților sale chimice și conformaționale unice, ciclohexanul este, de asemenea, utilizat în laboratoare în analize și ca standard.
Moleculă ciclohexan folosind Jsmol vezi – Pentru structuri 3D
Structura ciclohexanului Molecula
Inelul cu 6 vârfuri nu se conformează formei unui hexagon perfect. Conformația unui hexagon plan 2D plan are o deformare unghiulară considerabilă datorită faptului că legăturile sale nu sunt de 109,5 grade; tulpina de torsiune ar fi, de asemenea, considerabilă datorită tuturor legăturilor eclipsate. Prin urmare, pentru a reduce tensiunea de torsiune, ciclohexanul adoptă o structură tridimensională cunoscută sub numele de conformația scaunului. Noua conformație pune carbonii la un unghi de 109,5 °. Jumătate din hidrogeni se află în planul inelului (ecuatorial), în timp ce cealaltă jumătate este perpendiculară pe plan (axial). Această conformație permite cea mai stabilă structură a ciclohexanului. Există o altă conformație a ciclohexanului, cunoscută sub numele de conformație de barcă, dar se convertește în formația de scaun ușor mai stabilă. Dacă ciclohexanul este mono-substituit cu un substituent mare, atunci substituentul va fi cel mai probabil găsit atașat într-o poziție ecuatorială, deoarece aceasta este conformația puțin mai stabilă.
toți cicloalcanii, ca rezultat, ciclohexanul a fost considerat 0 în tensiunea inelară totală, o combinație de unghi unghiular și tensiune torsională. Acest lucru face, de asemenea, ciclohexanul cel mai stabil dintre cicloalcani și, prin urmare, va produce cea mai mică cantitate de căldură atunci când este arsă, comparativ cu ceilalți cicloalcani.
O moleculă de ciclohexan în configurația scaunului. Atomii de hidrogen în poziții axiale sunt afișați în roșu, în timp ce cei în poziții ecuatoriale sunt în albastru.
Reacțiile cu ciclohexanul
Ciclohexanul pur în sine este destul de nereactiv, fiind un nepolar, hidrocarbură hidrofobă. Poate reacționa cu acizi foarte puternici, cum ar fi sistemul superacid HF + SbF5, care va provoca protonații forțate și „crăparea hidrocarburilor”. Cu toate acestea, ciclohexanii substituiți pot fi reactivi într-o varietate de condiții, dintre care mulți sunt importanți pentru chimia organică. Ciclohexanul este extrem de inflamabil.
Derivați de ciclohexan
Aranjamentul specific al grupărilor funcționale în derivații ciclohexanului și, într-adevăr, în majoritatea moleculelor de cicloalcan, este extrem de important în reacțiile chimice, în special în reacțiile care implică nucleofili. Substituenții de pe inel trebuie să se afle în formația axială pentru a reacționa cu alte molecule. De exemplu, reacția bromociclohexanului și a unui nucleofil comun, un anion hidroxid, ar avea ca rezultat ciclohexen. în formația axială, opunându-se unui alt atom H axial să reacționeze. Presupunând că bromociclohexanul se află în formația adecvată pentru a reacționa, reacția E2 va începe ca atare:
- Legătura de perechi de electroni dintre C-Br se deplasează la Br, formând Br∠‘și stabilindu-l lipsit de ciclohexan
- Nucleofilul (-OH) dă o pereche de electroni H axial adiacent, stabilind H liber și legându-se de acesta pentru a crea H2O
- Legătura perechii de electroni între adiacentă H axial se deplasează către legătura dintre cele două CC făcându-l C = C
Notă: Toate cele trei etape se întâmplă simultan, caracteristice tuturor reacțiilor E2.
Reacția de mai sus va genera în principal reacții E2 și, ca rezultat, produsul va fi în mare parte (~ 70%) ciclohexen. Cu toate acestea, procentul variază în funcție de condiții și, în general, concurează două reacții diferite (E2 și Sn2). În reacția de mai sus, o reacție Sn2 ar substitui bromul cu o grupare hidroxil (OH-), dar din nou, Br trebuie să fie în axial pentru a reacționa. Odată ce substituția SN2 este completă, grupul OH nou substituit ar reveni rapid la poziția ecuatorială mai stabilă (~ 1 milisecundă). Utilizări Comercial, cea mai mare parte a ciclohexanului produs este transformat în amestec de ciclohexanonă-ciclohexanol prin catalizator. oxidare. Uleiul de KA este apoi folosit ca materie primă pentru acidul adipic și caprolactamă. Practic, dacă conținutul de ciclohexanol al uleiului KA este mai mare decât ciclohexanona, este mai probabil (economic) să fie transformat în acid adipic, iar în caz invers, producția de caprolactamă este mai probabilă. Un astfel de raport în uleiul KA poate fi controlat prin selectarea catalizatorilor de oxidare corespunzători. O parte din ciclohexan este utilizată ca solvent organic.
Ciclohexanul în cercetare
Deși se știe deja multe despre această hidrocarbură ciclică, încă se fac cercetări asupra amestecurilor de ciclohexan și benzen și a ciclohexanului în fază solidă pentru a determina randamentele de hidrogen ale amestecului atunci când sunt iradiate la 195 ° C.
Istorie
Spre deosebire de compuși precum benzenul, ciclohexanul nu poate fi obținut cu ușurință din resurse naturale, cum ar fi cărbunele. Spre sfârșitul secolului al XIX-lea cercetătorii chimici timpurii au trebuit să depindă de sinteza organică. Le-a trebuit 30 de ani să concretizeze detaliile. În 1867, Marcelin Berthelot a redus benzenul cu acid hidroiodic la temperaturi ridicate. El a identificat incorect produsul de reacție ca n-hexan nu numai datorită potrivirii convenabile în punctul de fierbere (69 ° C), ci și pentru că nu credea că benzenul este o moleculă ciclică (cum ar fi contemporanul său August Kekule), ci mai degrabă un fel de asociere de acetilenă. În 1870, unul dintre scepticii săi, Adolf von Baeyer, a repetat reacția și a pronunțat același produs de reacție hexahidrobenzen, iar în 1890 Vladimir Markovnikov a crezut că este capabil să distileze același compus din petrolul din Caucaz numind amestecul său hexanaphtene
În 1894 Baeyer ciclohexan sintetizat începând cu o condensare Dieckmann a acidului pimelic urmată de reduceri multiple. iar în același an E. Haworth și W.H. Perkin Jr. (1860 – 1929) a făcut același lucru într-o reacție Wurtz a 1,6-dibromohexanului. În mod surprinzător, ciclohexanii lor au fiert mai mult cu 10 ° C decât hexahidrobenzenul sau hexanaftenul, dar această enigmă a fost rezolvată în 1895 de Markovnikov, NM Kishner și Nikolay. Zelinsky când au diagnosticat din nou hexahidrobenzen și hexanaften ca metilciclopentan, rezultatul unei reacții neașteptate de rearanjare.