Fakta om Francium Element (Svenska)
Det kemiska grundämnet francium klassas som en alkalimetall. Det upptäcktes 1939 av Marguerite Perey.

Datazon
| Klassificering: | Francium är en alkalimetall |
| Färg: | silvergrå-metallisk (antas) |
| Atomic vikt: | (223), inga stabila isotoper |
| Tillstånd: | solida |
| Smältpunkt: | 27 oC, 300 K |
| Kokpunkt: | 677 oC, 950 K |
| Elektroner: | 87 |
| Protoner: | 87 |
| Neutroner i de vanligaste isotoperna: | 136 |
| Elektronskal: | 2, 8,18,32,18,8,1 |
| Elektronkonfiguration: | 7s1 |
| Densitet @ 20oC: | 1,873 g / cm3 |
Visa mer, inklusive: Värmer, Energier, Oxidation,
Reaktioner, föreningar, radier, konduktiviteter
| Atomvolym: | 71,07 cm3 / mol |
| Struktur: | tros vara bcc: kroppscentrerad kubisk |
| Hårdhet: | – |
| Specifik värmekapacitet | – |
| Fusionsvärme | 2 kJ mol-1 |
| Förstörningsvärme | 73 kJ mol-1 |
| Förångningsvärme | 64 kJ mol-1 |
| första joniseringsenergi | 384 kJ mol-1 |
| andra joniseringsenergi | – |
| tredje joniseringsenergi | – |
| Elektronaffinitet | – |
| Lägsta oxidationsnummer | 0 |
| Min. gemensamt oxidationsnummer. | 0 |
| Maximalt oxidationsnummer | 1 |
| Max. vanlig oxidation nr. | 1 |
| Elektronegativitet (Pauling-skala) | 0,7 |
| Polariserbarhet volym | 48,7 Å3 |
| Reaktion med luft | – |
| Reaktion med 15 M HNO3 | – |
| Reaktion med 6 M HCl | kraftig, ⇒ H2, FrCl |
| Reaktion med 6 M NaOH | kraftig, ⇒ H2, FrOH |
| Oxid (er) | – |
| Hydrid (er) | – |
| Klorid (er) | – |
| Atomradie | – |
| Jonisk radie (1+ jon) | 194 pm |
| Jonisk radie (2+ jon) | – |
| Jonisk radie (3+ jon) | – |
| Jonisk radie (1- jon) | – |
| Jonisk radie (2- jon) | – |
| Jonisk radie (3- jon) | – |
| Värmeledningsförmåga | 3,61 W m-1 K-1 |
| Elektrisk ledningsförmåga | – |
| Frys / smältpunkt: | 27 oC, 300 K |

Detta uranmalmprov innehåller cirka 100 000 atomer francium-223 (3,3 x 10-20 g). Francium är radioaktivt; mindre än 30 g av det finns på jorden vid varje given tidpunkt. Bild Ref. (1)
Upptäckt av Francium
Francium upptäcktes av Marguerite Perey 1939 när hon undersökte det radioaktiva förfallet av actinium-227.
Upptäckten ägde rum vid Curie Institute i Paris. Elementet har fått sitt namn från landet där det upptäcktes – Frankrike.
Upptäckten började 1935, när Perey var 26 år gammal, läste ett forskningsdokument som hävdade att amerikanska forskare hade upptäckt att betapartiklar släpptes ut av aktinium som hade en högre mängd energi än normalt.
Perey var nyfiken på denna upptäckt, och redan som expert på aktiniumrelaterat arbete bestämde hon sig för att utföra sina egna experiment på aktinium. Hon producerade ett ultrarent aktiniumprov och studerade dess strålning. Perey upptäckte att cirka 1% av actiniums radioaktivitet orsakades av att den släppte ut alfapartiklar, inte beta-partiklar. sin egen kärna. Dotterkärnan som bildades var ett tidigare oupptäckt element som hon valde att kalla francium för att hedra sitt hemland Frankrike.
227Ac → 223Fr + 4He
Med 87 protoner tillhörde det nya elementet i Grupp 1 i det periodiska systemet, som sammanfogar de andra fem alkalimetallerna: litium, natrium, kalium, rubidium och cesium.
Upptäckten av francium fullbordade mänsklighetens upptäckter av naturligt förekommande element.
Alla element som upptäcktes sedan dess har upptäckts när elementet har producerats i laboratoriet.

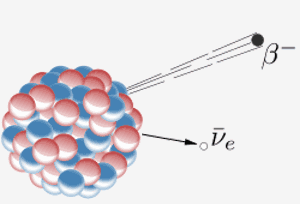
En kärna avger en beta-partikel ( en elektron) och en antineutrino. Resultatet av detta är att en neutron i kärnan förvandlas till en proton. När element 87 i det periodiska systemet (francium) gör detta betyder det extra protonet att det blir element 88 (radium).
Utseende och egenskaper
Skadliga effekter:
Francium är mycket radioaktivt.
Egenskaper:
Francium är en tung, instabil, radioaktiv metall med en maximal halveringstid på endast 22 minuter. Den har en låg smältpunkt (27 oC, 81 oF) och om tillräckligt av den kunde ackumuleras skulle den vara flytande i ett varmt rum.
Francium är det näst sällsynta elementet i jordskorpan, bredvid astatin. Mindre än trettio gram francium finns på jorden vid varje given tidpunkt.
Francium är minst elektronegativt av alla element, därför bör det vara den mest kemiskt reaktiva alkalimetallen. Tyvärr är den inte tillgänglig i tillräckliga mängder för att visa att den reagerar med vatten – den tillverkas i små mängder i partikelacceleratorer. I teorin skulle dess reaktion med vatten vara mer våldsam än cesium och mycket mer våldsam än natrium.
Francium har nyligen studerats vid Stony Brook University, New York. Forskare där fångade upp till tio tusen francatomer åt gången med hjälp av laserstrålar i ett magnetfält för att mäta deras egenskaper.
Användning av Francium
Kommersiellt finns det inga användningsområden för francium på grund av dess sällsynthet och instabilitet. Den används endast för forskningsändamål.
Francium Decay
Franciums isotoper, med massantal från 200 till 232, genomgår oftast alfa- eller beta-förfall.
Här är bara några exempel på franciums förfallsvägar:
Francium-223 är elementets längsta levande isotop. Den har en halveringstid på 22 minuter. Det kan avge en alfa-partikel (en heliumkärna) för att bilda astatin-219 eller en beta-partikel för att bilda radium-223. (En beta-partikel är en elektron som emitteras från en kärna när en neutron omvandlas till en proton.)
Francium-221 har en halveringstid på 5 minuter. Det kan avge en alfa-partikel för att bilda astatin-217 eller en beta-partikel för att bli radium-221.
Francium-216 har en halveringstid på 0,7 mikrosekunder. Den kan avge en alfapartikel för att bilda astatin-212 eller en positron för att bilda radon-216.
Francium-212 har en halveringstid på 19 minuter. Den kan avge en alfapartikel för att bilda astatin-208 eller fånga en orbitalelektron för att bilda radon-212. (2) (Under orbitalelektronupptagning fångar kärnan en av atommens egna elektroner och avger en neutrino.)
Överflöd och isotoper
Överflöd av jordskorpan: ~ 0 delar per miljon , ~ 0 delar per miljon
Överflöd av solsystem: ~ 0 viktdelar per miljard, ~ 0 delar per miljard mol
Kostnad, ren: $ per 100 g
Kostnad, bulk: $ per 100 g
Källa: Francium förekommer naturligt till följd av alfa-radioaktivt sönderfall av aktinium.
Isotoper: Francium har 33 isotoper vars halveringstid är kända, med massnummer 200 till 232. Inga är stabila. 223Fr har den längsta halveringstiden på 21,8 minuter.

- Foto av Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, nummer 6.
Citerar den här sidan
För att länka online, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
eller
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
För att citera den här sidan i ett akademiskt dokument, använd följande MLA-kompatibla citat:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.