Frontiers in Cellularand Infection Microbiology (Svenska)
Inledning
Staphylococcus aureus är en viktig mänsklig patogen isolerad från sjukhuspatienter världen över, vilket orsakar både sjukhusinfektioner och samhällsförvärvade infektioner ( Lowy, 1998). Denna patogen är det etiologiska medlet för flera olika systemiska infektioner, som påverkar hud och mjukvävnad, samt muskuloskeletala systemet och cirkulationssystemet (Lowy, 1998; Changchien et al., 2016). Det rapporterades att S. aureus kan överleva i humana monocyt-härledda makrofager (Kubica et al., 2008). Virulensen hos S. aureus är nära associerad med en mängd utsöndrade enzymer och toxiner som produceras av bakterierna (Otto, 2014). Hemolysin, leukocidin (Panton – Valentine leukocidin, PVL) och toxiskt chocksyndrom toxin-1 (TSST-1), vilket underlättar för att skada röda blodkroppar, skada fagocytisk funktion hos leukocyter och inducera toxiskt chocksyndrom, är kritiska för patogena processer av S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube och Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Nya studier har visat att hemolysin också deltar i bildandet av S. aureus biofilm (den Reijer et al., 2016). Den ökande förekomsten av multiresistenta S. aureus-stammar inom sjukhus- och samhällsmiljöer ökar ytterligare farorna med S. aureus och utgör en allvarlig utmaning för klinisk terapi (Voss och Doebbeling, 1995; Evangelista Sde och de Oliveira, 2015).
Nyligen har ett antal stammar som tillhör en klass av S. aureus med en ofullständig hemolytisk fenotyp (SIHP) hittats på vårt sjukhus. Hemolys orsakad av dessa SIHP-stammar skiljer sig signifikant från den kompletta hemolytiska ringen (β-hemolytisk fenotyp) som produceras i andra S. aureus-stammar. Dessa SIHP-stammar har emellertid ännu inte identifierats och karakteriserats helt. För att utforska de mikrobiologiska egenskaperna hos dessa SIHP-stammar samlade vi 60 SIHP-stammar och studerade dem med hjälp av flera kriterier inklusive hemolytisk fenotyp, uttryck av hemolysingenen, läkemedelsresistensfunktioner och virulens. Denna studie visar att SIHP är meticillinresistenta stammar som starkt uttrycker β-hemolysin och har en hög virulenspotential.
Material och metoder
Bakteriestammar
Sextio SIHP stammar isolerades från patienter som lagts in på det andra anslutna sjukhuset vid Soochow University mellan 2013 och 2015. Dubbla prover från varje patient togs för analys. Dessa isolat odlades sedan på Columbia-fårblodagarplattor (CHROMagar Company, Shanghai, Kina) vid 35 ° C i en atmosfär innehållande 5% CO2 (volym / volym). Stammaridentitet som S. aureus bekräftades med Phoenix-100 automatiserade mikrobiologiska system (Becton, Dickinson och Company, USA). Kontroll S. aureus-stammar, med fullständig hemolytisk fenotyp, isolerades från patienter på vårt sjukhus under samma tidsperiod. Här kallades S. aureus med den fullständiga hemolytiska fenotypen SCHP-stammar. S. aureus ATCC25923 referensstam (Shanghai Center for Clinical Laboratory, China) har den fullständiga hemolytiska fenotypen och fungerade också som kontrollstammen. Medicinsk etikkommitté vid det andra anknutna sjukhuset vid Soochow University godkände denna studie och alla isolat samlades in med patientens samtycke i denna studie.
Jämförande analyser av ofullständig hemolytisk fenotyp
S. aureus stammar odlades på kommersiella blodagarplattor från olika företag (CHROMagar, Autobio Diagnostics Co., Ltd., Kina och BioMérieux, Kina) såväl som självberedda fårblodagarplattor med Columbia blodagarpulver (OXIDE, UK). Bakterierna odlades vid 35 ° C i en atmosfär innehållande 5% CO2 (volym / volym) under 24 timmar och genomgick sedan seriell passage. Det hemolytiska fenomenet observerades sedan. Kliniskt isolerade stammar med fullständig hemolytisk fenotyp och ATCC25923-referensstammen observerades också som en kontroll för jämförande analyser. PCR (qPCR)
Total RNA-extraktion från SIHP och ATCC25923-referensstammen genomfördes som tidigare beskrivits (Qin et al., 2014). Ursprungligen lyserades cellerna med användning av lysostaphin, lysozym och proteinas K. RNA extraherades sedan och renades med användning av RNeasy Mini Kit (Qiagen) enligt tillverkarens rekommenderade protokoll. RNA-kvalitet och koncentration utvärderades med användning av NanoDrop1000. RNA omvändes sedan -transriberades till cDNA med användning av en omvänd transkriptionssats (Thermo Fisher Scientific Inc., USA) enligt tillverkarens instruktioner.Kortfattat utfördes qPCR enligt följande: fördenaturering vid 94 ° C under 3 minuter, denaturering vid 94 ° C i 30 s, glödgning vid 52 ° C i 30 s, förlängning vid 72 ° C i 40 s, totalt 45 cykler . Varje prov hade tre tekniska och tre biologiska upprepningar. Transkriptionsprofilen för var och en av de fyra hemolysingenerna och 16-talets rRNA-gen bestämdes med användning av 2-ΔΔCt-metoden. Transkriptionsnivån bestämdes i förhållande till uttrycket av 16s rRNA-genen. Sekvenserna för fyra hemolysingener (hla, hlb, hlgC och hld) hämtades från GenBank-databasen. Primer 5.0-programvaran användes för att designa primers (tabell 1) och dessa primers syntetiserades av Sangon Biotech Co., Ltd. (Shanghai, Kina).
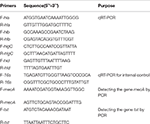
Tabell 1. Primers som används i denna studie.
SPSS 17.0 användes för dataanalys. Mätdata presenteras som x̄ ± s. T-test för två oberoende prover användes för att jämföra det relativa uttrycket för var och en av de fyra hemolysingenerna. Statistisk signifikans definierades som p < 0,05.
Detektion av a-hemolysin (Hla) -uttryck med Western Blot
Koncentrationen av SIHP och referensstammen S. aureus ATCC25923 justerades till 5,0 McFarland med användning av en grumlingsmätare. Totalt protein extraherades sedan från varje prov, justerades till samma koncentration och genomgick elektrofores på en SDS-PAGE-gel. Proteinerna överfördes sedan till ett nitrocellulosamembran och membranet blockerades med 5% skummjölk under 1 timme. Getantestylokock α-hemolysin polyklonala antikroppar (Abcam) tillsattes i en slutlig koncentration av 2 μg / ml. Reaktionsblandningen inkuberades sedan vid 4 ° C över natten. Efter att membranet hade tvättats tillsattes 1: 1000 utspädda HRP-märkta kanin-anti-get-IgG-antikroppar och inkuberades vid 37 ° C under 2 timmar. Slutligen tillsattes kemiluminescerande substrat för färgutveckling. Uttrycket av a-hemolysin observerades slutligen under avbildaren.
Antimikrobiell susceptibilitetstestning av SIHP
Metoden för utspädning av mikrotiterbuljong användes för att utföra screening för antimikrobiell känslighet. Förfarandet utfördes enligt den operativa handboken för det automatiserade mikrobiologiska systemet Phoenix-100. Resultaten från denna screening tolkades med M100-S24-kriterier som infördes av Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). Meticillinresistent S. aureus (MRSA) -status bestämdes med MIC (minsta hämmande koncentration) av två antibiotika. För SIHP-stammar var ≥4 μg / ml MIC för oxallicin och ≥8 μg / mL var MIC för cefoxitin.
Detektion av mecA- och tst-gener
Alla 60 SIHP stammar testades med avseende på läkemedelsresistensgenen mecA och virulensgenen tst. Kokande extraktion av genomiskt DNA utfördes efter cellulär lysis med användning av lysostaphin. MecA- och tst-generna amplifierades sedan från genomiskt DNA med användning av DreamGreen Taq-satsen. PCR-förhållandena var som följer: fördenaturering vid 94 ° C under 3 minuter, denaturering vid 94 ° C i 30 s, glödgning vid 50 ° C i 30 s, förlängning vid 72 ° C under 1 min. PCR-produkter sekvenserades och analyserades av BLAST för att validera för att vara de förväntade produkterna. Sekvenserna av läkemedelsresistensgen mecA och virulensgen tst av S. aureus hämtades från GenBank-databasen. Primer 5.0-programvaran användes för att designa primers (tabell 1) och dessa primers syntetiserades av Sangon Biotech Co., Ltd. (Shanghai, Kina).
Detektion av överlevnaden av S. aureus SIHP-stammar i Makrofager
För att jämföra överlevnaden av S. aureus SIHP-stammar i makrofager med den för tst-negativa S. aureus SCHP-stammar bibehölls den humana monocytcellinjen THP-1 i RPMI-1640 innehållande 10% (v / v) FBS vid 37 ° C i en atmosfär innehållande 5% (volym / volym) CO2. För makrofaginfektion såddes THP-1-celler med 5 × 105 celler per brunn i vävnadsodlingsskålar med 24 brunnar och inducerades att differentiera med 10-7 M phorbol 12-myristat 13-acetat (PMA) under 48 timmar. Cirka 3 × 108 kolonibildande enheter (CFU) av logaritmisk fas (OD600 0,5-0,6) bakterier pelleterades genom centrifugering, tvättades två gånger med PBS och återsuspenderades i 1 ml RPMI-1640. Därefter tillsattes bakterier till cellmonoskiktet vid en MOI av 20: 1 och centrifugerades under 5 minuter vid 1000 rpm. Infekterade celler inkuberades under 20 minuter vid 37 ° C, tvättades sedan tre gånger med förvärmd PBS (pH 7,4) och inkuberades under ytterligare 1 timme i medium innehållande 100 μg / ml gentamicin för att döda extracellulära bakterier. Celler tvättades och lyserades för att kvantifiera den intracellulära bakterien som tid nollprov (T0). Ytterligare celler samlades in efter 12 eller 24 timmars inkubation i närvaro av färskt kompletterat vävnadsodlingsmedium innehållande 12 ug / ml gentamicin.Tillväxten av bakterier i THP-1-celler bestämdes genom att dividera antalet intracellulära bakterier vid 12 timmar eller 24 timmar med antalet vid tidpunkten 0 (T12 / T0 eller T24 / T0). Experimentet upprepades oberoende tre gånger.
Detektion av cytokinsekretion av makrofager infekterade av S. aureus SIHP-stammar
Kultursupernatanterna av THP-1-makrofager infekterade i 12 timmar av bakterier samlade in. Cytokinnivåerna mättes med FACSCalibur flödescytometri (BD) med användning av en CBA Human Thl / Th2 Cytokine Kit II (BD) enligt tillverkarens instruktioner.
Multilokuseringssekvenstyp och analys
Resultat
Hemolytisk fenotyp av SIHP-stammar på fåraggarblodplattor
Som visas i figurerna 1A, B observerades den fullständiga hemolytiska ringen (β-hemolytisk fenotyp) i kontroll S aureus-stammar efter odling av stammar på blodagarplattor under 24 timmar. Emellertid visades olika hemolytiska fenotyper (kallas ofullständig hemolytisk fenotyp här) i SIHP-stammar. Dessutom kunde den ofullständiga hemolytiska fenotypen observeras i SIHP-stammarna som växte i olika miljö förhållanden inklusive mikroaerofila, aeroba och anaeroba förhållanden (figur 1C – E). Dessutom bibehölls fortfarande denna ofullständiga hemolytiska fenotyp efter 10 seriella passager (Figur 1F).
Relativ mRNA-uttrycksnivåer av fyra hemolysingener
Som visas i figur 2 uppvisade expressionsnivåerna för de fyra hemolysingenerna hla, hlb, hlgC och hld i SCHP-stammar inga statistiskt signifikanta skillnader (p > 0,05) jämfört med den för kontrollstammar ATCC25923. Uttrycksnivåerna av hla, hlgC och hld i SIHP-stammar undertrycktes emellertid signifikant med 50-, 16,7- och 8,3 gånger (p < 0,05) jämfört med den för kontrollstammar ATCC25923 och SCHP-stammar, medan uttrycket av hlb i SIHP-stammar ökade signifikant 7,7 gånger jämfört med kontrollerna (p < 0,05).
Detektion av α-hemolysin med Western Blot
α-hemolysin kodat av gen hla är ett porbildande toxin som utsöndras av S. aureus och dess molekylvikt är 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). Western blot-analys visade att uttrycket av α-hemolysin i SIHP-stammar var 40 gånger lägre än för SCHP- och kontrollstammarna, vilket överensstämmer med qRT-PCR-data (Figur 3).

Figur 3. Western blot av a-hemolysin i S. aureus. ATCC29213: kontroll S. aureus med den fullständiga hemolytiska fenotypen; SCHP: S. aureus med den fullständiga hemolytiska fenotypen isolerad från kliniska prover under samma period; SIHP: S. aureus med en ofullständig hemolytisk fenotyp.
Läkemedelsresistens för SIHP
Testad läkemedelskänslighet med användning av mikrotiterbuljongutspädningar visade att MIC-värdena för oxacillin och cefoxitin alla var > 2 och > 8 μg / ml i 60 SIHP-fläckar . Enligt CLSI M100-S24-riktlinjerna klassificeras alla 60 SIHP-stammar som MRSA-stammar. PCR detekterade också mecA-genen i alla 60 stammar.
Testning för tst-genet
Tst-genen är en viktig virulensfaktor i S. aureus. PCR visade att alla 50 SIHP-stammar bar tst-gener.
Överlevnadsförmågan hos S. aureus SIHP-stammar i makrofager är större än den hos tst Negative S. aureus
Vi jämförde de intracellulära överlevnadsförmågorna för SIHP-stammar och den första negativa SCHP-stammen i makrofager. Genom att räkna antalet bakterier som utvunnits från plattorna fann vi att intracellulär överlevnadsförmåga för SIHP-stammen var mycket högre än för den tst-negativa S. aureus-stammen efter infekterade THP-1 härledda makrofager 12 eller 24 timmar (figur 4). Inledningsvis spekulerade vi i att SIHP-stammar har en potentiell hög virulens, och det föreslogs att SIHP skulle ägnas mer uppmärksamhet på sjukhus.
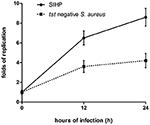
Figur 4. Överlevnad av SIHP-stammar och tst negativ S. aureus i THP-1 härledda makrofager. Efter att makrofagerna infekterats av bakterier i 12 och 24 timmar lyserades makrofagerna och de intracellulära överlevande bakterierna ströks ut på LB-agar. Replikationsveckarna för intracellulära överlevande bakterier beräknades enligt antalet kolonier på ovanstående LB-agarplatta.
Sekretionsskillnaderna av cytokiner och kemokiner från makrofager infekterade av S. aureus SIHP-stammar och tst negativa S. aureus
För att jämföra utsöndringsskillnaderna mellan cytokiner och kemokiner i THP-1 härledda makrofager infekterade av SIHP-stam och tst negativa S.aureus-stam, detekterade vi proinflammatoriska cytokiner genom flödescytometri i kultursupernatanten av makrofager infekterade av SIHP-stammar och tst negativ S. aureus-stam. Resultaten visade signifikant högre induktion av IL-2, IL-6 och IL-17A i SIHP-stammar, men inte av tst-negativa S. aureus, vilket tyder på att SIHP-stammar inducerar cytokin / kemokinsvar i makrofagerna (Figur 5). De andra cytokinerna IL-4, IL-10, INF-y och TNF utsöndrade av makrofager var inga uppenbara skillnader mellan SIHP-stammar och tst-negativa S. aureus-påverkade grupper.
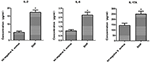
Figur 5. Detektion av cytokiner och kemokiner utsöndrade av makrofager infekterade med S. aureus. * P < 0,05.
Multilokussekvensskrivning
Vi bestämde multilokusgenotypen för 60 SIHP-isolat som samlats in från patienter som lagts in på vårt sjukhus mellan 2013 och 2014. Det sju-locus-schema som rekommenderas i S. aureus MLST-databasen tillämpades. MLST-analys visade att alla SIHP-stammar klassificerades i ST5-klon.
Diskussion
Hemolysin är en av de viktigaste virulensfaktorerna för S. aureus (Wiseman, 1975). De kombinerade effekterna av var och en av de fyra typerna av hemolysin resulterar i förstörelse av röda blodkroppsmembranet, vilket leder till bildandet av den fullständiga transparenta hemolytiska ringen på blodagarplattor. Under senare år hittades SIHP i de kliniska proverna från det andra anslutna sjukhuset vid Soochow University. I denna studie försökte vi identifiera dessa stammar och studera deras egenskaper i mikrobiologi. Inledningsvis använde vi olika kommersiella eller självberedda fårblodagarplattor för att isolera, inkubera och passera stammarna i serie. Vi visade att det finns vissa stammar som uppvisar och upprätthåller en ofullständig hemolytisk fenotyp även efter långvarig underodling. Således kan möjligheten att denna fenotyp induceras av icke-bakteriella faktorer uteslutas. Våra studier antyder att SIHP kan vara en delmängd av unika S. aureus-stammar.
Tidigare studier antydde att kaninröda blodkroppar är mycket känsliga för α-hemolysin (Hildebrand et al., 1991). Berube et al. rapporterade att effekten av α-hemolysin på lys av röda blodkroppar är koncentrationsberoende (Berube och Bubeck Wardenburg, 2013). γ-hemolysin kan skada de röda blodkropparna hos människor och djur (Kaneko och Kamio, 2004). Medan δ-hemolysin skadar röda blodkroppar, endast vid höga koncentrationer, bildar det en trans-membranpor som lyserar cellmembranet (Verdon et al., 2009). I denna studie visade vi att uttrycket av fyra hemolysiner av SIHP-stammar och SCHP-stammar har signifikant olika transkriptionsuttrycksprofiler. Uttrycket av α-, γ-, δ-hemolysin i SIHP-stammarna, som kan skada de röda blodkropparna direkt, är mycket lägre än för SCHP-stammarna, medan β-hemolysin har mycket högre uttrycksnivåer jämfört med SCHP-stammarna. Dessutom validerades proteinuttrycksnivån för a-hemolysin ytterligare med western blot. Det rapporterades att β-hemolysin övervägande ökar känsligheten hos röda blodkroppar för andra toxiner istället för att lysera cellerna direkt, såvida inte cellerna odlas vid lägre temperaturer (Vandenesch et al., 2012). I den här studien upptäcktes det höga uttrycket av β-hemolysin i SIHP-stammar, men den fullständiga hemolytiska ringen observerades aldrig i SIHP-stammarna även när de inkuberades vid 4 ° C. Dessa resultat antyder att den observerade ofullständiga fenotypen av SIHP-stammar sannolikt är effekterna av alla fyra hemolysinerna som uttrycks på ett annat sätt jämfört med SCHP-stammarna. Tidigare studier har visat att den kombinerade effekten av selektiva tryck som härrör från antibiotika inklusive ciprofloxacin och trimetoprim samt värdens immunsvar kan leda till ökat uttryck av a-hemolysin under kronisk patogenes, vilket är mycket viktigt för koloniseringen av S aureus i slemhinnor, särskilt i luftvägsinfektioner (Goerke et al., 2006; Huseby et al., 2010). I den här studien fick alla patienter infekterade med SIHP långvarig behandling av bredspektrumantibiotika, oavsett om detta selektiva tryck inducerade överuttryck av läkemedelsresistenta gener och störde uttrycket av hemolysingenerna förblir en möjlighet som behöver ytterligare undersökning.
För att utforska de mikrobiologiska egenskaperna hos SIHP utförde vi antimikrobiella känslighetstester och valde virulensgenen tst som är associerad med S. aureus patogenicitet. Vi fann att alla 60 SIHP-stammar kunde klassificeras som MRSA-stammar och bar mecA-genen. Resultaten av antimikrobiella känslighetstest visade att även efter 10 passager, av dessa 60 SIHP-stammar, har MIC-värdena för linezolid och teikoplanin av endast tre SIHP-stammar förändrats lite.Dessa förändringar av MIC-värden påverkade emellertid inte bedömningen av resultaten av antimikrobiell känslighet. Virulensgenen tst kodar för toxiskt shock-syndrom-toxin (TSST-1) (Kreiswirth, 1989). Som ett superantigen förbättrar TSST-1 chock- och immunsuppressionssvar som induceras av endotoxiner (Kulhankova et al., 2014). PCR-testning visade att alla 60 SIHP-stammar hade tst-genen vilket tyder på ökad virulens. Nyligen visade många rapporter att S. aureus kunde överleva i humana monocyt-härledda makrofager och dessa S. aureus-stammar är mer virulenta (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi och Bishayi, 2016). Därför jämförde vi de intracellulära överlevnadsförmågorna för SIHP-stammar och SCHP-stammar som är tst negativa S. aureus i makrofager, och fann att intracellulär överlevnadsförmåga för SIHP-stammen var mycket högre än för tst-negativa S. aureus-stammen. Dessutom visade patientdataanalys att effekten av antiinfektionsbehandling hos de flesta av de patienter som var infekterade med SIHP-stammar var sämre än för de liknande patienter som var infekterade med SCHP-stammar (data ej visade). Vår studie ger preliminära experimentella bevis för spekulationen om att SIHP-stammar har en potentiell hög virulens.
Under infektionsprocessen hos invasiv S. aureus initierar patogenassocierade molekyler det medfödda immunsystemet som leder till aktivering och rekrytering av neutrofiler och makrofager och produktion av proinflammatoriska cytokiner, särskilt TNF-α, IL-1β och IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). Det rapporterades att utsöndringen av inflammatoriska cytokiner IL-6 ökade med ökande koncentrationer av S. aureus (Chen et al., 2016). Dessutom är superantigenic S. aureus särskilt effektiva för att stimulera IL-17-produktion (Islander et al., 2010). I denna studie visade SIHP-stammar signifikant högre induktion av IL-2, IL-6 och IL-17A av makrofager jämfört med tst-negativa SCHP-stammar, vilket tyder på att SIHP-stammar kunde inducera mer utsöndring av cytokiner mot makrofagers dödande effekt. Dessutom visade MLST-analys att alla SIHP-stammar klassificerades i ST5-klon. Dessutom grupperades dessa SIHP-stammar i spa-typen t2460 (data visas inte).
Sammantaget kan SIHP vara en ny delmängd av MRSA med potentiell hög virulens, och mer uppmärksamhet bör ägnas åt kontroll och behandling av dessa stammar på sjukhus.
Författarens bidrag
Uttalande om intressekonflikter
Författarna förklarar att forskningen genomfördes i avsaknad av kommersiell eller ekonomiska relationer som kan tolkas som en potentiell intressekonflikt.
Bekräftelser
Denna studie stöddes av National Natural Science Foundation of China (81572032, 81401636), Natural Science Foundation for Colleges and Universities in Jiangsu Province (16KJB320006), and the Science and Technology Program of Suzhou (SYSD2014094, SYS201551, SS201638).
Clinical and Laboratory Standardinstitutet (2014). M100-S24 Prestandastandarder för antimikrobiell känslighetstestning; Tjugofyra fjärde informationstillägget. Wayne, PA: CLSI.
Nandi, A. och Bishayi, B. (2016). Intracellulärt överlevd Staphylococcus aureus efter fagocytos är mer virulenta när det gäller att inducera cytotoxicitet i färsk murin peritoneal makrofager med TLR-2 som ett möjligt mål. Microb. Pathog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef Fulltext | Google Scholar
Wiseman, G. M. (1975). Hemolysinerna av Staphylococcus aureus. Bakteriol. Rev 39, 317–344.
PubMed Abstract | Google Scholar