Fysisk geologi (Svenska)
De allra flesta mineraler som utgör jordskorpans stenar är silikatmineraler. Dessa inkluderar mineraler som kvarts, fältspat, glimmer, amfibol, pyroxen, olivin och ett stort antal lermineraler. Byggstenen för alla dessa mineraler är kiseldioxidtetraeder, en kombination av fyra syreatomer och en kiselatom. Dessa är ordnade så att plan som dras genom syreatomerna bildar en tetraeder (figur 2.6). Eftersom kiseljonen har en laddning på +4 och var och en av de fyra syrejonerna har en laddning på –2, har kiseldioxidtetraedern en nettoladdning på –4.
I silikatmineraler är dessa tetraeder ordnade och kopplas ihop på olika sätt, från enskilda enheter till komplexa ramar (Figur 2.9). Den enklaste silikatstrukturen, mineralolivin, består av isolerade tetraeder bundna till järn- och / eller magnesiumjoner. I olivin balanseras -4-laddningen för varje kiseldioxidtetraeder med två tvåvärda (dvs +2) järn- eller magnesiumkatjoner. Olivin kan vara antingen Mg2SiO4 eller Fe2SiO4, eller någon kombination av de två (Mg, Fe) 2SiO4. De tvåvärda katjonerna av magnesium och järn är ganska nära i radie (0,73 kontra 0,62 ångström). På grund av denna storlekslikhet, och eftersom de båda är tvåvärda katjoner (båda har en laddning på +2), kan järn och magnesium lätt ersätta varandra i olivin och i många andra mineraler.
| Konfiguration av tetraeder | Exempel på mineraler | |
|---|---|---|
 |
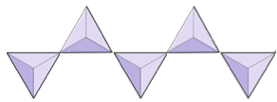
Isolerad (nesosilikater) | Olivin, granat, zirkon, kyanit |
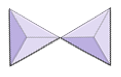 |
Par (sorosilikater) | Epidote, zoisite |
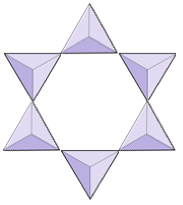 |
Ringar (cyklosilikater) | Turmalin |
 |
Enstaka kedjor (inosilikater) | Pyroxener, wollastonit |
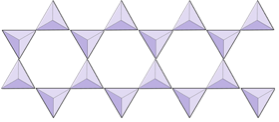 |
Dubbla kedjor (osilikater) | Amfiboler |
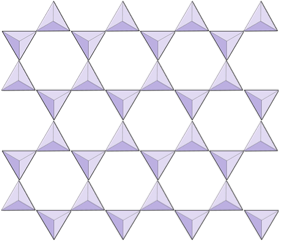 |
Ark (phyllosilicates) | Micas, lermineraler, serpentin, klorit |
| 3-dimensionell struktur | Framework (tektosilikater) | Fältspat, kvarts, zeolit |
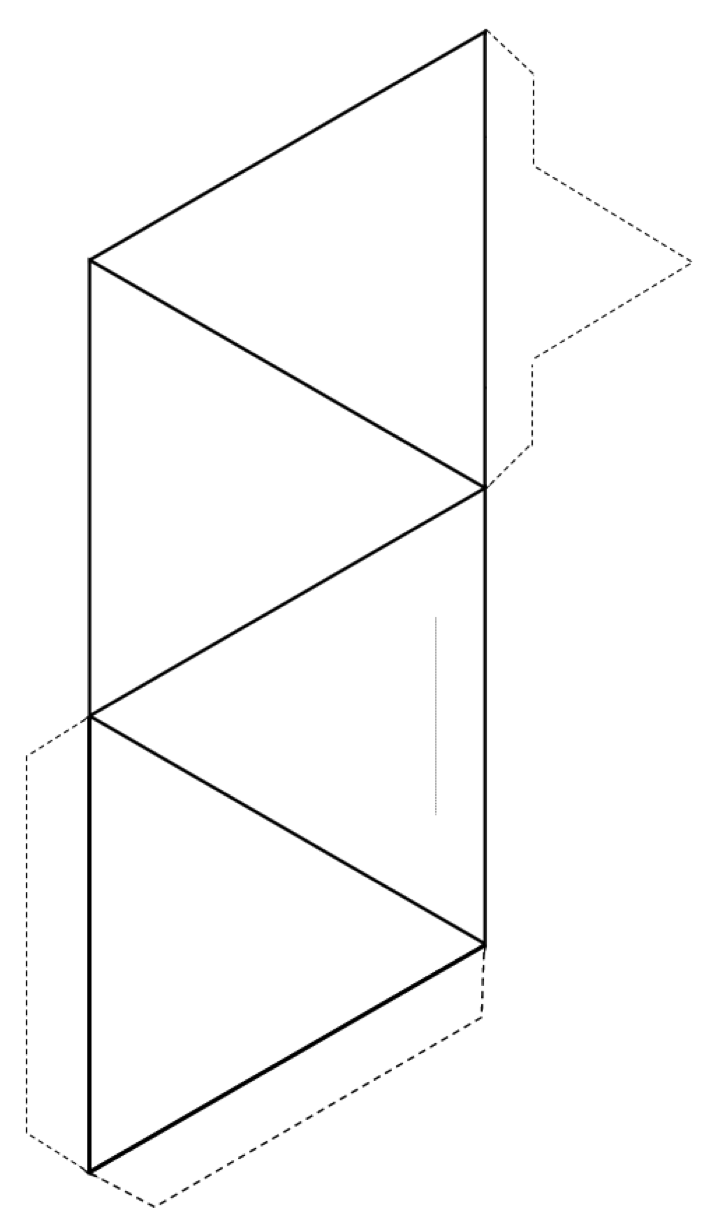
Övning 2.3 Skapa en tetraeder
Klipp ut på utsidan av formen (heldragna linjer och streckade linjer) och vik sedan längs de heldragna linjerna för att bilda en tetraeder.
Om du har lim eller tejp, säkra flikar till tetraedern för att hålla ihop den. Om du inte har lim eller tejp, gör en skiva längs den tunna grå linjen och för in den spetsiga fliken i slitsen.
Om du gör det i ett klassrum kan du försöka ansluta din tetraeder med andra till par, ringar, enkla och dubbla kedjor, ark och till och med tredimensionella ramar.
I olivin, till skillnad från de flesta andra silikatmineraler, är kiseldioxid tetraeder inte bundna till var och en Övrig. De är dock bundna till järnet och / eller magnesiumet som visas i figur 2.10.
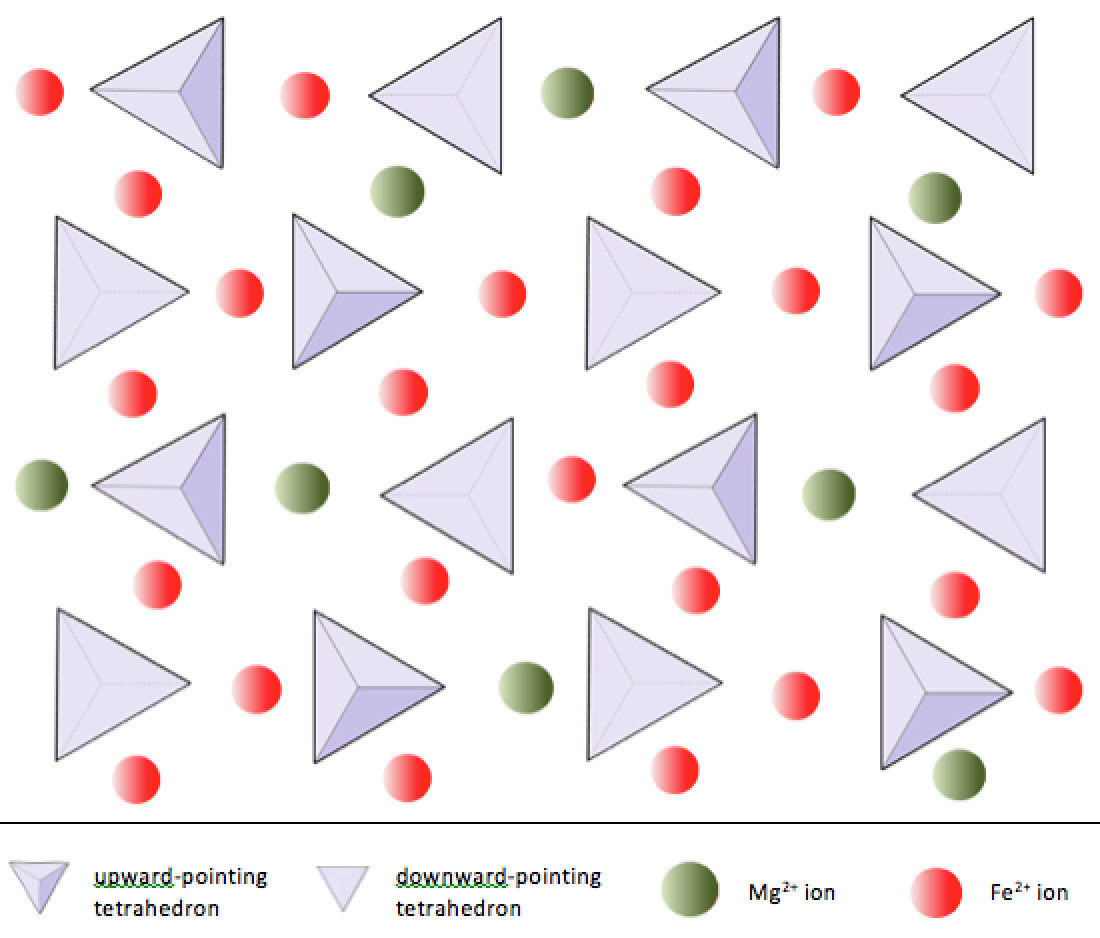
Som redan nämnts, +2-jonerna av järn och magnesium har samma storlek (men inte helt samma). Detta gör att de kan ersätta varandra i vissa silikatmineraler. Faktum är att de vanliga jonerna i silikatmineraler har ett stort antal storlekar, vilket visas i figur 2.11. Alla de visade jonerna är katjoner, utom syre. Observera att järn kan finnas som både en +2-jon (om den förlorar två elektroner under joniseringen) eller en +3-jon (om den förlorar tre). Fe2 + är känt som järn. Fe3 + är känt som järnjärn. Joniska radier är kritiska för kompositionen av silikatmineraler, så vi hänvisar till detta diagram igen.

Enkelkedjans struktur silikatpyroxen visas i figurerna 2.12 och 2.13. I pyroxen är kiseldioxidtetraeder länkade i varandra i en enda kedja, där en syrejon från varje tetraeder delas med intilliggande tetraeder, varför det finns färre oxygener i strukturen.Resultatet är att syre-till-kisel-förhållandet är lägre än i olivin (3: 1 istället för 4: 1), och nettoladdningen per kiselatom är mindre (–2 istället för –4), eftersom färre katjoner är nödvändiga för att balansera avgiften. Pyroxenkompositioner är av typen MgSiO3, FeSiO3 och CaSiO3, eller någon kombination av dessa. Pyroxen kan också skrivas som (Mg, Fe, Ca) SiO3, där elementen i parenteserna kan finnas i vilken proportion som helst. Med andra ord har pyroxen en katjon för varje kiseldioxidtetraeder (t.ex. MgSiO3) medan olivin har två (t.ex. Mg2SiO4). Eftersom varje kiseljon är +4 och varje syrejon är –2, ger de tre oxygenerna (–6) och den ena kiseln (+4) en nettoladdning på –2 för den enda kedjan av kiseldioxidtetraeder. I pyroxen balanserar den tvåvärda katjonen (2+) per tetraeder den -2 laddningen. I olivin krävs två divalenta katjoner för att balansera –4-laddningen för en isolerad tetraeder.
Strukturen hos pyroxen är mer ”tillåtande” än den för olivin – vilket innebär att katjoner med ett större spektrum av joniska radier kan passa in i det. Därför kan pyroxener ha järn (radie 0,63 Å) eller magnesium (radie 0,72 Å) eller kalcium (radie 1,00 Å) katjoner.
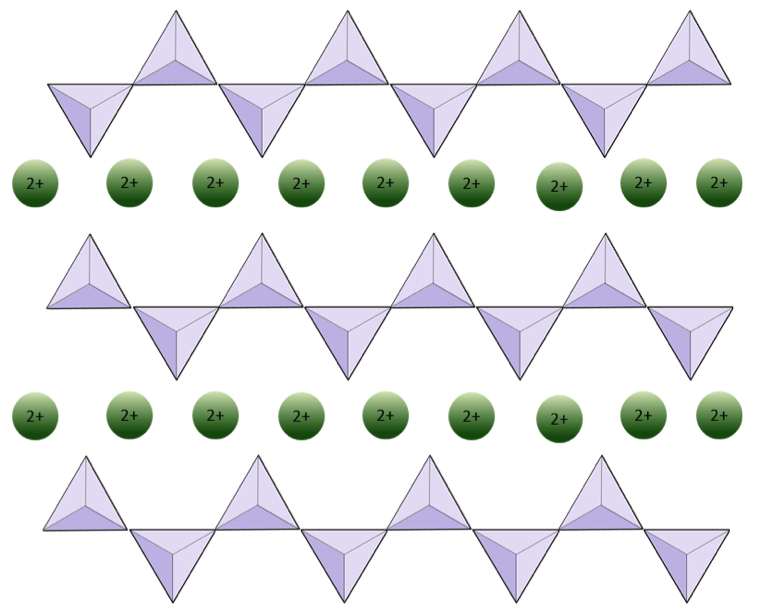
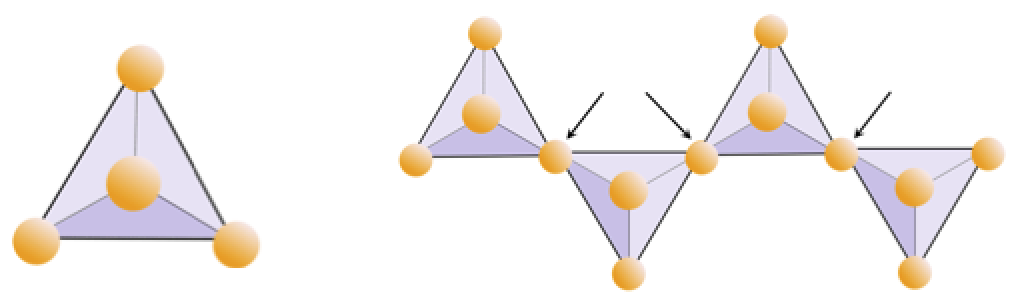
Övning 2.4 Syreberövning
Diagrammet nedan representerar en enda kedja i ett silikatmineral. Räkna antalet tetraedrar mot antalet syrejoner (gula sfärer). Varje tetraeder har en kiseljon, så detta bör ge förhållandet Si till O i enkelkedjade silikater (t.ex. pyroxen).
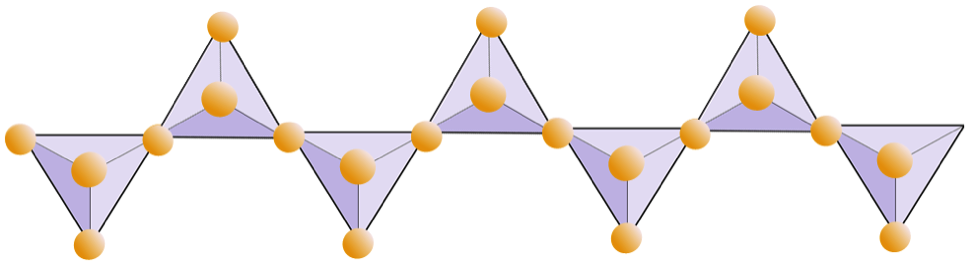
Diagrammet nedan representerar en dubbel kedja i ett silikatmineral. Återigen, räkna antalet tetraeder mot antalet syrejoner. Detta borde ge dig förhållandet Si till O i dubbelkedjade silikater (t.ex. amfibol).
I amfibolstrukturer är kiseldioxid tetraedrarna bundna i en dubbel kedja som har ett syre-till-kiselförhållande som är lägre än pyroxen, och det är därför fortfarande färre katjoner som är nödvändiga för att balansera laddningen. Amfibol är ännu mer tillåtet än pyroxen och dess kompositioner kan vara mycket komplexa. Hornblende kan till exempel innefatta natrium, kalium, kalcium, magnesium, järn, aluminium, kisel, syre, fluor och hydroxyljonen (OH–).
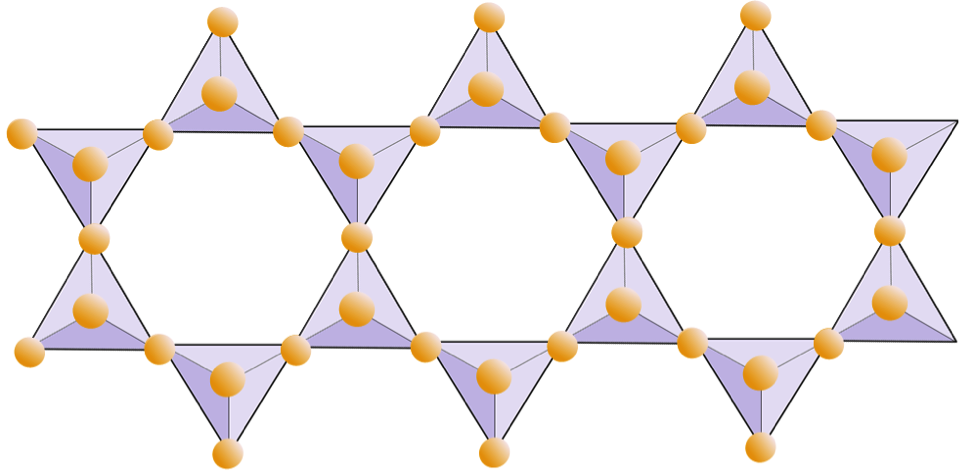
I glimmerstrukturer är kiseldioxid tetraeder är ordnade i kontinuerliga ark, där varje tetraeder delar tre syre-anjoner med intilliggande tetraeder. Det finns ännu mer delning av oxygener mellan intilliggande tetraedrar och därför behövs färre laddningsbalanserande katjoner för plåtsilikatmineraler. Limningen mellan lakan är relativt svag, och detta står för den välutvecklade enriktade klyvningen (figur 2.14). Biotitglimmer kan innehålla järn och / eller magnesium och det gör det till ett ferromagnesiskt silikatmineral (som olivin, pyroxen och amfibol). Klorit är ett annat liknande mineral som vanligtvis innehåller magnesium. I muskovitglimmer är de enda katjoner som är närvarande aluminium och kalium; därför är det ett icke-ferromagnesiskt silikatmineral.

Allt arksilikat mineraler har också vatten i sin struktur.
Silica tetrahedra är bundna i tredimensionella ramar i både fältspar och kvarts. Dessa är icke-ferromagnesiska mineraler – de innehåller inte järn eller magnesium.Förutom kiseldioxidtetraeder inkluderar fältspatjoner katjonerna aluminium, kalium, natrium och kalcium i olika kombinationer. Kvarts innehåller endast kiseldioxidtetraeder.
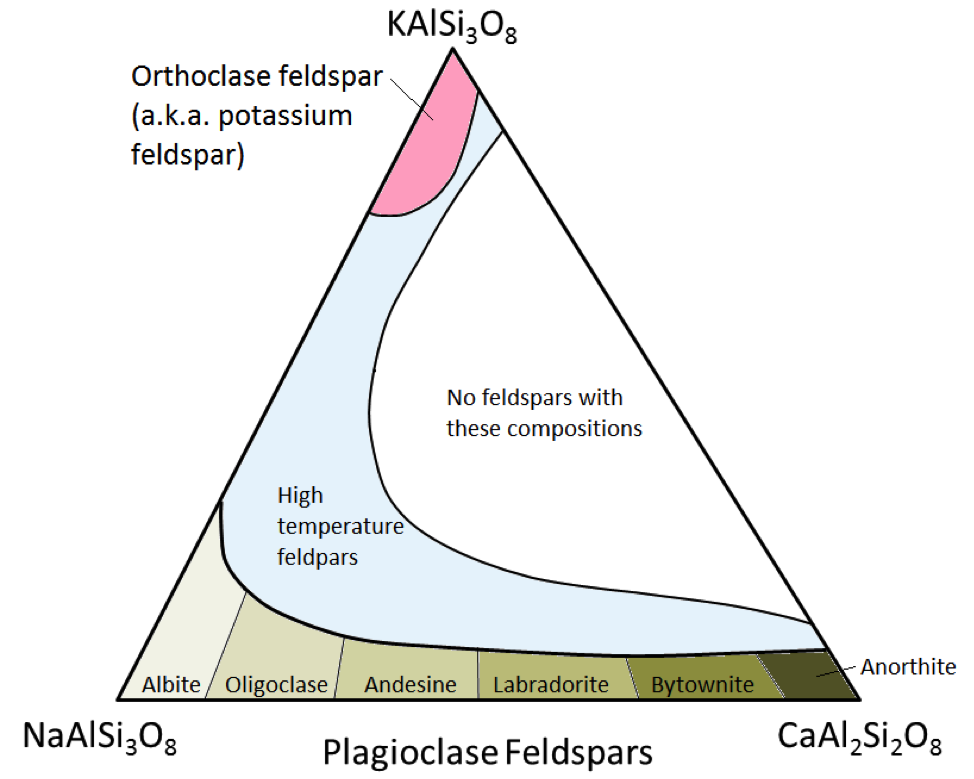
De tre huvudsakliga fältspatmineralerna är kaliumfältspat, (aka K-fältspat eller K-spar) och två typer av fältspat i plagioklas: albit (endast natrium) och anortit (endast kalcium) . Såsom är fallet med järn och magnesium i olivin, finns det ett kontinuerligt sortiment av kompositioner (fast lösningsserie) mellan albit och anortit i plagioklas. Detta beror på att kalcium- och natriumjonerna är nästan identiska i storlek (1,00 Å mot 0,99 Å). Alla mellanliggande kompositioner mellan CaAl2Si3O8 och NaAlSi3O8 kan existera (figur 2.15). Detta är lite överraskande eftersom, även om de är väldigt lika i storlek, har kalcium- och natriumjoner inte samma laddning (Ca2 + kontra Na +). Detta problem redovisas genom motsvarande substitution av Al3 + mot Si4 +. Därför är albit NaAlSi3O8 (en Al och tre Si) medan anortit är CaAl2Si2O8 (två Al och två Si), och plagioklas-fältspat med mellanliggande komposition har mellanliggande proportioner av Al och Si. Detta kallas en ”kopplad-substitution.”
Mellan-kompositionen plagioklas fältspat är oligoklas (10% till 30% Ca), andesin (30% till 50% Ca), labradorit (50% till 70 % Ca) och bytownit (70% till 90% Ca). K-fältspat (KAlSi3O8) har en något annorlunda struktur än plagioklas på grund av den större storleken på kaliumjonen (1,37 Å) och på grund av denna stora storlek , kalium och natrium ersätter inte lätt varandra, utom vid höga temperaturer. Dessa högtemperaturfältstycken finns sannolikt bara i vulkaniska bergarter eftersom påträngande magtiga bergarter svalnar tillräckligt långsamt till låga temperaturer för att fältspatarna kan förändras till en av de former med lägre temperatur.
I kvarts (SiO2) är kiseldioxidtetraederna bundna i ett ”perfekt” tredimensionellt ramverk. Varje tetraeder är bunden till fyra andra tetraeder (med ett syre som delas i varje hörn av varje tetraeder), och som ett resultat är förhållandet mellan kisel och syre 1: 2. Eftersom den ena kiselkatjonen har en +4 laddning och de två syreanjonerna har vardera en -2 laddning, är laddningen balanserad. Det finns inget behov av aluminium eller någon av de andra katjoner som natrium eller kalium. Hårdheten och bristen på klyvning i kvarts är resultatet av de starka kovalenta / joniska bindningarna som är karakteristiska för kiseldioxidtetraedern.
Övning 2.5 Ferromagnesiska silikater?
Silikatmineraler klassificeras som antingen ferromagnesiska eller icke-ferromagnesiska beroende på om de har järn (Fe) och / eller magnesium (Mg) i sin formel. Ett antal mineraler och deras formler listas nedan. Ange om det är ett ferromagnesiskt silikat för varje enskilt.
| Mineral | Formel | Ferromagnesiskt silikat? |
|---|---|---|
| olivin | (Mg, Fe) 2SiO4 | |
| pyrite | FeS2 | |
| plagioklas | CaAl2Si2O8 | |
| pyroxen | MgSiO3 | |
| hematit | Fe2O3 | |
| ortoklas | KAlSi3O8 | |
| kvarts | SiO2 |
| Mineral | Formel * | Ferromagnesiskt silikat? |
|---|---|---|
| amfibol | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetit | Fe3O4 | |
| biotit | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomit | (Ca, Mg) CO3 | |
| granat | Fe2Al2Si3O12 | |
| serpentin | Mg3Si2O5 (OH) 4 |
* Några av formlerna, särskilt de mer komplicerade, har förenklats.
- En ångström är den enhet som vanligtvis används för uttryck av atomisk -skala dimensioner. En ångström är 10–10 m eller 0.0000000001 m. Symbolen för en ångström är Å. ↵