Gränser inom fysiologi
Inledning
Arteriella baroreceptorer fungerar som frontlinjesensorer för att upptäcka blodtrycksförändringar i blodflödet. Förändringar i blodtrycket stimulerar de mekanokänsliga nervändarna som är lokaliserade i artärväggarna. Den mekaniska kraften överförs till elektriska signaler vid nervterminalerna, vilket resulterar i tryckberoende handlingspotential avfyrar i baroreceptorneuroner. Nervsignalerna sprider sig sedan till det kardiovaskulära kontrollcentret i hjärnstammen för baroreflex reglering av blodtrycket (Levy MN, 2007). Dessutom har supra-medullära strukturer, inklusive midbrain cuneiform nucleus och ventral medial prefrontal cortex, också en hämmande roll vid baroreflexreglering (Verberne et al., 1997).
Det finns två arteriella baroreceptorer, nämligen aorta-baroreceptorerna och carotisbaroreceptorerna, belägna i adventitia-skiktet i aortabågen respektive halspulsådern. Aorta baroreceptorer upptäcker blodtryck i aorta. Cellkropparna (soma) i aorta baroreceptorerna är belägna vid nodos ganglion (NG) (figur 1). Nervsignalerna från aorta baroreceptor nervterminaler överförs till nodos ganglion genom en sensorisk nerv som heter aortadepressornerv (ADN) (figur 1). Carotid baroreceptorer upptäcker blodtrycket i halspulsådern, som tillför blod till hjärnan. Nervterminalerna hos halspulsåderreceptorerna är belägna bilateralt vid halspulsårens förgreningar, nära den inre halspulsådern. Nervsignalerna från halspulsåderreceptorerna färdas längs carotisinusnerven (CSN) till deras soma lokaliserad i petrosal ganglion (PG). Petrosal ganglion sticker ut utanför jugular foramen (Figur 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly and Rigual, 2000; Weijnen et al., 2000) . Eftersom aorta-baroreceptorer känner blodtryck i aorta, som tillför blod till hela systemcirkulationen, förväntas dessa baroreceptorer spela en viktig funktionell roll för att upprätthålla det totala systemiska blodtrycket. Å andra sidan upptäcker halspulsåderreceptorer blodtrycket som levereras till hjärnan. Dessa baroreceptorer kan vara viktigare för upprätthållandet av ett stabilt cerebralt blodtryck och cerebralt blodflöde.
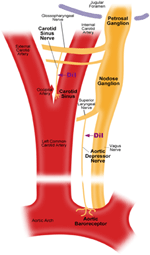
Figur 1. Schematisk bild av aorta- och halspulsådercentraler och nerver. Diagram som illustrerar de anatomiska positionerna för aorta- och halspulverbareceptorer nervterminaler, deras nervfibrer och somata-regioner. Aorta baroreceptorterminaler finns i aortabågen. Dess afferenta nervfiber är aortadepressornerv. Somaen är i nodos ganglion (NG). Carotis baroreceptor är placerad i den inre halspulsådern bredvid halspulsförgreningen. Dess afferenta nerv är carotis sinus nerv. Soma finns i petrosal ganglion (PG).
Det finns motstridiga rapporter om vilka baroreceptorer, aorta baroreceptorer eller halspulsa baroreceptorer, är mer känsliga för blodtrycksförändring. Vissa forskare rapporterade att karotidreceptorerna är känsligare för tryck (Donald och Edis, 1971; Fadel et al., 2003), medan andra tror att aorta-baroreceptorer är känsligare för tryck (Glick och Covell, 1968; Pickering et al., 2008), och ännu andra har inte rapporterat någon skillnad i tryckkänsligheten mellan dessa två baroreceptorer (Hainswor et al., 1970; James och Daly, 1970). Emellertid använde nästan alla dessa tidigare studier endast baroreflexresponserna (såsom hjärtfrekvens och njursympatisk nervaktivitet) som slutpunkter för baroreceptors känslighetsanalys. Det finns fortfarande ingen studie som direkt registrerar och jämför tryckkänsligheten hos aorta- och halspulverneuroner i sig.
Här har vi använt en höghastighetstryckklämma för att ändra det hydrostatiska trycket inuti baroreceptorneuronerna och uppmätta motsvarande elektrofysiologiska svar hos dessa nervceller genom fastklämning av helcellsplåster. Vi använde också en enaxlig sträckkammare för att sträcka baroreceptorneuronerna och mätte motsvarande förändringar i cytosolisk Ca2 + i dessa neuroner. Dessutom mätte vi för djurstudier in vivo de tryckinducerade potentiella avfyrningarna i aortadepressorn och carotisinusnerven, vilka är sensoriska nerver för aorta- och carotidbaroreseptorer.
Material och metoder
Djur
Alla djurförsök genomfördes under tillstånd av en licens utfärdad av regeringen i Hong Kong SAR och godkännande från Animal Experimentation Ethics Committee, Chinese University of Hong Kong.Sprague-Dawley-hanråttor (S / D) (180–200 g) tillhandahölls av Laboratory Animal Services Center vid det kinesiska universitetet i Hong Kong.
Primärkultur
S / D råttor bedövades med pentobarbitalnatrium (100 mg / kg). Det vänstra livmoderhalsområdet exponerades genom snitt i mittlinjen under steriliserat tillstånd. Som visas i figur 1 exponerades aortadepressornerven eller halshinnanerven och 2-3 mm av nerven lossades försiktigt från omgivande vävnader genom trubbig dissektion. Fluorescerande lipofilt spårämne 1,1-dioktadecyl-3,3,3 ’, 3’-tetrametylindokarbocyanin (DiI) -kristaller (Invitrogen) applicerades runt nerven och täcktes med Kwik-Sil (World Precision Instruments, USA). Snittet syddes efteråt. Råttorna fick återhämta sig i 5-7 dagar för att låta DiI-färgämnet diffunderas retrograd längs aortadepressornerven eller carotis sinusnerven till somata som ligger i nodos ganglion respektive petrosal ganglion.
Nodos eller petrosal ganglion neuroner isolerades från DiI-märkta råttor och skars i bitar i iskall EBSS. De utsattes för spjälkning under 1 timme vid 37 ° C med trypsin (1 mg / ml) och kollagenas IA (1 mg / ml). Enstaka neuroner dispergerades genom försiktig triturering med Glass Pasteur-pipett, följt av centrifugering. Neuronerna återsuspenderades och odlades i DMEM / F-12-media kompletterat med 5% FBS, 1% antibiotikum-antimykotisk och 7S NGF (100 ng / ml). Cytosin arabinofuranosid (Ara-C; 10 uM) inkluderades i odlingsmediet för att hämma tillväxten av delande celler. Neuronerna odlades i minst 3 dagar före experiment. För inspelning av åtgärdspotential isolerades neuronerna nyligen och inkuberades i F12 minst 30 minuter före experiment. För alla experiment inkuberades cellerna på glasskivor förbelagda med 0,1 mg / ml poly-L-lysin, med undantag för cellsträckningsförsöken i vilka silikonkamrarna förbelades med 2% gelatin.
Patch Clamp
Registrering av hela cellströmklämmor uppnåddes med en EPC7 patch-clamp-förstärkare (HEKA, Tyskland). Patchpipetter med motstånd 3–5 MΩ fylldes med pipettlösning (i mM): 130 K-glukonat, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 av KOH. Celler badades i den konstgjorda cerebro-spinalvätskan (ACSF) (i mM): 120 NaCl, 2 KCl, 1,2 MgSO4. 7H20, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glukos, ekvilibrerades med karbogen (95% O2 och 5 % CO2). I nuvarande klämregistrering hölls cellerna vid sin vilande membranpotential. Ett höghastighetstrycksklämsystem (HSPC-1, ALA Scientific Instruments, USA) användes för att ge positivt tryck till cellen genom mikropipett. Inspelningar samplades vid 50 kHz och filtrerades vid 5 kHz. Data analyserades med PulseFit (HEKA). Alla experiment utfördes vid rumstemperatur.
Calcium Imaging
Cytosolisk Ca2 + -mätning utfördes såsom beskrivs någon annanstans (Wong et al., 2010). Kortfattat laddades cellerna med 5 uM Fluo-4 / AM under 40 minuter. Cytosolisk Ca2 + -mätning utfördes med HEPES-buffrad lösning (i mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glukos, pH 7,4 med NaOH. Cytosolisk Ca2 + -förändring som svar på enaxlig sträckning utfördes med STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Cellerna stimulerades med 10, 20 eller 30% av enkelriktad sträckning under 1 sek. Cytosoliskt Ca2 + -svar mättes vid rumstemperatur. Fluo-4-fluorescensen registrerades och analyserades av FV1000-laserskanningskonfokalt bildsystem. Förändring av cytosolisk Ca2 + -fluorescensrespons uttrycktes som ett förhållande (Fx / F0) av realtidsfluorescens, där Fx är realtidsfluo-4 / AM-signalen och F0 är baslinjefluo-4 / AM-signalen före sträckning. / p>
Registrering av nervaktivitet
Råttor bedövades med 100 mg / kg pentobarbitalnatrium. Cervikalområdet exponerades av mittlinjesnitt. Den högra halspulsådern isolerades och kanylerades av en kateter som var ansluten till tryckgivaren (ML221, ADInstruments, USA) för blodtrycksregistrering. Den vänstra lårbenen kanylerades för fenylefrin och SNP-injektion. Den vänstra aortadepressornerven eller carotis sinusnerven var ansluten till en bipolär silverelektrod följt av och en förstärkare (Model 1700 Differential AC Amplifier, A-M Systems Inc., USA). Både blodtrycket och nervaktiviteten registrerades kontinuerligt i diagram 5.0 (AD-instrument). Nervaktiviteten förstärktes 10 000 gånger och filtrerades vid bandpass på 100–5000 Hz. Värden på medelartärtryck, hjärtfrekvens och spikfrekvens som svar på fenylefrin analyserades med programvara Chart 5.0. Förändring i spikfrekvens (spikfrekvens efter fenylefrin – spikfrekvens före fenylefrin) som svar på maximal blodtrycksförändring (genomsnittligt arteriellt blodtryck efter fenylefrin – medelvärde arteriellt blodtryck före fenylefrin) vid fenylefrininjektion beräknades (Lau et al., 2016) .
Statistisk analys
Representativa spår ritades som tidskursspår. Data från alla experiment sammanfattades i stapeldiagram som uttrycktes i medelvärde ± sem för enskilda experiment. Studentens t-test användes för statistisk analys. Parvis t-test användes där så är lämpligt.
Resultat
Egenskaper hos aortadepressorneuroner och karotisinusneuroner
Dil applicerades på antingen aortadepressornerven eller halshinnanerven. Därför inkluderade Dil-märkta neuroner i nodosganglion baroreceptorneuronerna som innerverade aortabågen och de kemoreceptorneuroner som innerverade aortakroppen. Å andra sidan, Dil-märkta neuroner i petrosal ganglion inkluderade baroreceptorneuronerna som innerverar halshinnan och kemoreceptorneuronerna som innerverar halshinnan. Vi undersökte först grundläggande egenskaper hos dessa Dil-märkta neuroner. DiI-märkta neuroner i nodos och petrosal ganglion odlades separat och utsattes för en depolariserande elektrisk ström som visas i figur 2. Två typer av svar registrerades, den ena svarade med en enda åtgärdspotential och den andra med kontinuerliga åtgärdspotentialer efter den depolariserande strömmen (figur 2) (Belmonte och Gallego, 1983). Dessa neuroner utsattes därefter för ett hydrostatiskt tryckprotokoll för att testa deras känslighet för förändringar i hydrostatiskt tryck. En positiv hydrostatisk tryckramp applicerades intracellulärt genom en glasmikropipett med högtrycksspänningssystemet (HSPC-1, ALA Scientific Instruments, USA) tills åtgärdspotentialer framkallades. Resultaten visade att 45% av aorta-baroreceptorneuroner avfyrade kontinuerliga aktionspotentialer som svar på den depolariserande elektriska strömmen (tabell 1A). Bland dem svarade 91% (41% / 45%) också på den hydrostatiska tryckförändringen och visade tryckberoende åtgärdspotentialer (tabell 1A). De återstående 55% av aorta-baroreceptorneuroner avfyrade endast en enda åtgärdspotential som svar på den depolariserande strömmen (tabell 1A), och bland dem kunde 40% (22% / 55%) svara på tryckförändringen (tabell 1A). För karotidbaroreceptorneuronerna gav 45% av cellerna kontinuerliga aktionspotentialer när de stimulerades av den depolariserande strömmen (tabell IB). Bland dem var 82% (37% / 45%) också känsliga för tryckförändringen (tabell IB). Dessutom kan 24% (13% / 55%) reagera på tryckförändringen (tabell 1B) bland de karotiska baroreceptorneuronerna som bara avfyrade en enda åtgärdspotential som svar på den depolariserande strömmen. / div>
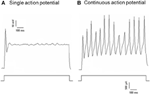
Figur 2. Åtgärdspotentialinspelning från odlad aortadepressor och carotis sinusneuroner. Visas är spåren av åtgärdspotentialer som registrerades från två representativa aortadepressorer / carotis sinusneuroner vid en depolariserande ström. (A) En representativ nervcell som bara avfyrar en enda åtgärdspotential vid den aktuella stimuleringen; (B) En representativ neuroner som avfyrar endast kontinuerliga åtgärdspotentialer vid den aktuella stimuleringen. Nedre panel: protokoll för aktuell injektion. Skalstapel, horisontell, 100 ms, vertikal, 10 mV (övre spår) och 500 pA (nedre spår). n = 27 och n = 38 för aortadepressor respektive carotis sinusneuroner.

Tabell 1. Egenskaper hos aortadepressor och carotis sinusneuroner.
Oavsett om de avfyrade enstaka åtgärdspotentialer eller kontinuerliga åtgärdspotentialer, visade sig 63% av Dil-märkta aorta-baroreceptorneuroner vara känsliga för tryckförändringen, medan endast 50% av Dil-märkta halspulsåderceller är nervkänsliga tryckförändring (tabell 1).
Stretch Sensitivity of Aortic and Carotid Baroreceptor Neurons
Trycktröskeln för åtgärdspotentialutsläpp analyserades. Såsom visas i figur 3 hade aorta-baroreceptorneuroner en lägre trycktröskel (24 ± 4 mmHg) än den hos carotis-baroreceptorneuronerna (39 ± 4 mmHg).

Figur 3. Känsligheter hos aorta- och halspulsådercellerneuroner för hydrostatiskt tryck. (A, B) Övre panel, representativa tidsförloppsspår som illustrerar de tryckberoende åtgärdspotentialerna i aorta (A) och halspulsåder (B) baroreceptorneuroner. Tryckrampen (nedre panelen) applicerades på insidan av cellerna genom en mikropipett med användning av ett höghastighetstrycksklämsystem (HSPC). Skalstång horisontell, 1 s, vertikal, 20 mV och 20 mmHg. (C) Sammanfattning som visar tröskelvärdet som initierar åtgärdspotentialen avfyrar i aorta och halspulsåderceller neuroner. n = 13 för aorta baroreceptor neuroner och n = 15 för carotis baroreceptor neuroner. *** p < 0,01, av Studentens t-test.
Stretchinducerad Ca2 + -respons i Baroreceptor Neuroner
Odlade aortadepressorer eller carotis sinusneuroner utsattes för 10, 20 eller 30% av uniaxial stretch av STREX Cell Stretching System, försöker efterlikna blodkärlet som sträcker sig under blodtryck. Resultaten visade att en uniaxiell sträckning på 20% inducerade en markant ökning av cytosolisk Ca2 + -fluorescens i aorta-baroreceptorneuroner men inte i carotis-baroreceptorneuroner (figur 4A-C). Dessutom ökade storleken av Ca2 + -fluorescens som svar på 30% enaxlig sträckning mycket högre i aorta-baroreceptorneuroner än i carotis-baroreceptorneuroner (figur 4A-C).
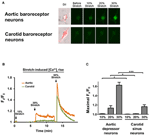
Figur 4. Känsligheter hos aortadepressor och carotis-sinusneuroner för enaxlig sträckning. Celler laddades med Ca2 + -känsligt fluorescerande färgämne Fluo-4 / AM. Visade är representativa bilder (A) och tidsförloppsspår (B) av relativ cytosolisk Ca2 + -steg som svar på enaxlig sträcka på 10, 20 och 30% av celllängden i aortadepressor och carotis sinusneuroner. (C) Sammanfattning av maximal cytosolisk Ca2 + ökning som svar på olika grad av stretch. Förändring i cytosolisk Ca2 + uttrycktes som Fx / F0, där Fx är att fluo-4 / AM-signal i realtid och F0 är baslinjen fluo-4 / AM-signal före sträckning. Medelvärde ± sem (n = 5). * p < 0,05, *** p < 0,01 jämfört med motsvarande kontroll, genom parvis t-test.
Baroreceptor nervaktivitet in vivo
Nervaktiviteten hos de två baroreceptorerna undersöktes in vivo. Fenylefrin injicerades intravenöst. Förändringarna i blodtrycket vid applicering av fenylefrin visas i den övre panelen i figurerna 5A, B. Därefter förändringar i baroreceptor nervaktivitet visas i den nedre panelen (figurerna 5A, B). Den tryckinducerade nervaktiviteten var mycket högre i aortadepressornerven än i sinusnerven (figur 5A, B). Förändringen i spikfrekvens per mmHg-ökning sammanfattas i figur 5C. Resultatet indikerade att aorta-baroreceptorerna är känsligare för hydrostatiskt tryck än carotis-baroreceptorerna in vivo.
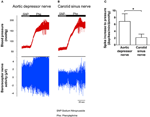
Figur 5. Baroreceptor nervaktivitet i råtta in vivo. (A, B) Representativa spår som visar förändringen i aortadepressornerv (A) och karotis sinus nerv (B) aktivitet vid blodtryckshöjning. I båda (A, B) var den övre panelen förändringen i blodtrycket före och efter Phe-appliceringen, vilket indikeras av de horisontella staplarna. Nedre panelen var motsvarande förändring i nervaktivitet. (C) Sammanfattade data som visar förändringen i nervaktivitet per blodtrycksändringsenhet. Medelvärde ± sem (n = 8). * p < 0,05 jämfört med kontrollen i aorta baroreceptorer, genom parvis t-test.
Uttryck av TRP-kanaler
Flera TRP-kanaler har rapporterats vara mekanokänsliga, inklusive TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O ”Neil och Heller, 2005; Christensen och Corey, 2007; Pedersen och Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Här undersökte vi den möjliga rollen för dessa mekanosensitiva TRP-kanaler i förhållande till aorta och karotisbaroreceptorkänslighet. mRNA-uttrycken för dessa kanaler i nodos och petrosal ganglion jämfördes. Det visade sig att uttrycken av TRPV4 och TRPC6 var högre i nodosganglion jämfört med petrosal ganglion (Figur 6). Det är möjligt att den högre uttryck av mekanosensitiva kanaler i nodos ganglion kan bidra till högre känslighet.
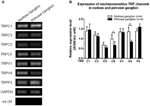
Figur 6. Uttryck av mekanisk känsliga TRP-kanaler i nodos och petrosal ganglion. (A) Representativa gelbilder som jämför mRNA-uttrycksnivån för mekanokänsliga TRP-kanaler, (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) mellan nodos och petrosala ganglionneuroner. Semikvantitativ RT-PCR-analys användes för att jämföra mRNA-expressionsnivåerna för flera TRP-kanaler i förhållande till GAPDH-mRNA-uttryck. Resultaten av 9 experiment sammanfattades i (B). Värdena var i genomsnitt ± sem. * p < 0,05, genom parvis t-test.
Diskussion
I föreliggande studie jämfördes de mekanokänsliga egenskaperna hos aorta- och halspulverbareceptorer. Helcells patchklämstudier visade att en högre andel aortadepressorneuroner var stretchkänsliga jämfört med sinusnervcellerna. Vidare befanns trycktröskeln som kunde initiera åtgärdspotentialförbränningar vara lägre i aorta-baroreceptorneuronerna än i carotis-baroreceptorneuronerna. Uniaxial stretchinducerad cytosolisk Ca2 + -stegning jämfördes också mellan aortadepressorn och sinotcellerna.Storleken på den cytosoliska Ca2 + -ökningen som svar på den uniaxiella sträckan var mycket högre i aorta-baroreceptorneuroner än i carotis-baroreceptorneuroner. Aorta-baroreceptorneuroner visade också en lägre tröskel för cytosoliska Ca2 + -svar på enaxlig sträckning. I en annan serie experiment fann vi att tryckinducerad ökning av potentiella avfyrningar var högre i aortadepressornerv än i sinusnerven. Sammantaget ger våra data starka bevis för att aorta-baroreceptorerna är mer känsliga för blodtryck än carotis-baroreceptorer.
Tidigare har man gjort stora ansträngningar för att förstå skillnaden i känslighet mellan de två baroreceptorerna. Resultaten är dock kontroversiella. Några rapporter drog slutsatsen att aorta-baroreceptorerna är mer känsliga för tryckförändringar (Glick och Covell, 1968; Fan et al., 1996; Pickering et al., 2008), medan andra uppgav att carotis-baroreceptorerna är känsligare för tryckförändringar (Donald och Edis, 1971; Fadel et al., 2003). Emellertid involverade nästan alla dessa tidigare studier mycket komplicerade kirurgiska ingrepp och använde i slutändan baroreflex-svar, såsom hjärtfrekvens och njursympatisk effekt, som slutpunkter för baroreceptors känslighetsanalys. Komplicerade kirurgiska ingrepp är benägna att införa experimentella fel, vilket kan leda till kontroversiella slutsatser. Dessutom är djurartberoende variation i baroreceptorkänslighet också möjlig. Dessutom påverkas baroreflexresponsen inte bara av baroreceptorkänsligheten, utan också av flera andra faktorer inklusive nervledning, centralmedling, blodkärls kontraktilitet och hjärtfunktion. Därför är bevisen från tidigare studier indirekt och knappast idealiska. Fram till i dag saknas det direkta studier som jämför tryckkänsligheten hos aorta jämfört med halspulsåderceller. I denna studie studerades mekanosensitiviteten direkt i baroreceptorneuroner. Uppgifterna tyder starkt på att aorta-baroreceptorerna är känsligare för tryck än carotis-baroreceptorerna. Denna information kan ha viktig fysiologisk relevans vid blodtrycksreglering.
Det är oklart vilka mekanismer som ligger till grund för skillnaden i tryckkänslighet mellan aorta- och halspulsåre-receptorer. Vi jämförde uttrycksnivån för flera mekanokänsliga TRP-kanaler (figur 6) (O ”Neil och Heller, 2005; Christensen och Corey, 2007; Pedersen och Nilius, 2007; Patel et al., 2010). Våra resultat visade att aorta-baroreceptorneuroner har ett högre uttryck av flera mekanokänsliga TRP-kanaler inklusive TRPV4 och TRPC6. Det är möjligt att högre expression av TRPV4 och / eller TRPC6 kan bidra till högtryckskänsligheten hos aorta baroreceptorer. Ytterligare studier behövs för att verifiera rollen för dessa jonkanaler.
Det rapporterades tidigare att nodos ganglion och petrosal ganglion innehåller två olika typer av nervceller (Belmonte och Gallego, 1983). En av dem ger kontinuerliga handlingspotentialer vid elektrisk stimulering, medan den andra bara ger en enda åtgärd potential vid stimulering. Författarna tilldelade de förstnämnda som de tryckkänsliga nervcellerna och tilldelade de senare som kemokänsliga nervceller. Våra resultat tyder på att det kanske inte är appropria te för att tilldela de tryckkänsliga neuronerna och de tryckkänsliga nervcellerna bara baserat på om de avfyrar en enstaka åtgärdspotential eller kontinuerliga åtgärdspotentialer som svar på den depolariserande strömmen. Faktum är att en stor andel celler som avfyrar en enstaka åtgärdspotential som svar på elektrisk stimulering också är känsliga för tryck, och därmed tillhör de tryckavkännande baroreceptorneuroner (figur 2 och tabell 1).
Sammanfattningsvis ger den aktuella studien bevis för att aorta-baroreceptorerna är känsligare för tryck än carotis-baroreceptorerna och lägger till ny information för att förstå den grundläggande fysiologin.
Författarens bidrag
EL och XY utforma experimenten och utarbeta manuskriptet. EL, CL och YY utför experimenten. XY, YH, AM och LJ reviderade manuskriptet. Alla författare godkände den slutliga versionen av manuskriptet.
Finansiering
Detta arbete stöddes av bidrag från Hong Kong Research Grant Committee CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 och RGC-NSFC Joint Grant N_CUHK439 / 13.
Uttalande av intressekonflikt
Författarna förklarar att forskningen genomfördes i avsaknad av några kommersiella eller ekonomiska relationer som kan tolkas som en potentiell intressekonflikt.
James, JEA och Daly, MDB (1970). Jämförelse av reflex vasomotoriska reaktioner för separat och kombinerad stimulering av carotis sinus och aortabågens baroreceptorer genom pulserande och icke-pulserande tryck hos hund. J. Physiol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
PubMed Abstract | CrossRef Fulltext | Google Scholar
Levy MN, P. A. (2007). Kardiovaskulär fysiologi. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. och Luciano, D. S. (1998). Human Physiology: the Mechanism of Body Function. Boston, MA: WCB McGraw-Hill.