Gränser inom immunologi
Inledning
Preeklampsi är en graviditetsspecifik sjukdom som drabbar 3–5% av alla graviditeter (1, 2). Det manifesterar sig med nyligen uppkomna högt blodtryck efter 20 veckors graviditet och proteinuri. Moderkakan är central i sjukdomens patogenes genom att ansluta modern till fostret (3). Moder-fostrets gränssnitt är den zon där genetiskt annorlunda vävnad av fostrets ursprung möter moderns cirkulation, endotel och immunsystem. Ofta kallad teorinsjukdom, är en allmänt accepterad insikt att preeklampsi påverkar moderns endotel som orsakar störningar i endotelns funktion, vilket leder till högt blodtryck och proteinuri (2). I sin svåra form kan preeklampsi leda till fostertillväxthämning, prematuritet, och för modern kan det orsaka organsvikt i njurar och lever samt eklampsi. Vidare kan preeklampsi få långvariga kardiovaskulära konsekvenser för modern och det nyfödda (4). Utvecklingen av moderkakan anses vara otillräcklig specifikt i processen för moderns spiralartärtransformation, där trofoblastcellerna invaderar modersidan till decidua och omvandlar artärerna till ledningar med låg resistens, och ersätter också maternal endotel (5-7). Vanligtvis är denna ombyggnad av livmoderartärerna frånvarande eller ofullständig, särskilt i svår form av preeklampsi. Hög motståndskraft i de trånga livmoderartärerna orsakar turbulent blodflöde in i placentas mellanrum och orsakar oxidativ stress och mekanisk skada på moderkakorna i moderkakan. Resulterande skada ökar placentautsläppet av mikropartiklar och inflammatoriska mediatorer vilket resulterar i generaliserad endotelaktivering och dysfunktion (8, 9). Dessa sekventiella händelser i moder-fetalt gränssnitt leder till moderns hypertoni och andra symtom som beskrivits ovan.
HELLP-syndromet karakteriserades först 1982 av Weinstein som ett separat syndrom, som ofta representerar tillsammans med preeklampsi men ses också ensamt (10, 11). HELLP-syndrom kännetecknas av hemolys, förhöjda leverenzymer och låga blodplättar. Det kräver ofta observation av intensivvård och symtomatisk terapi. Syndromets patogenes ligger fortfarande i skuggan. HELLP-syndrom delar gemensamma drag med trombotiska mikroangiopatier (TMA) såsom trombotisk trombocytopen purpura (TTP) och hemolytiskt uremiskt syndrom (HUS). TMA finns i olika grupper av sjukdomar med vanliga egenskaper hos mikroangiopatisk hemolys, trombocytopeni och organskador till följd av mikrotrombi. I TTP, en genetisk defekt hos, eller som i de flesta fall, förvärvade autoantikroppar mot ett sönderfall och metalloproteinas med trombospondin typ 1-motiv 13 (ADAMTS13), enzymet som klyver aktiverat von Willebrand-faktor (vWF), orsakar bildning av ovanligt stort aktiverade vWF-multimerer på endotelceller som leder till trombocytplomber i små kärl och hemolys. Typisk HUS orsakas av Shiga-toxinproducerande bakteriell infektion (särskilt Escherichia coli) medan atypisk HUS (aHUS) avser den typ av TMA, i vilken genetiska brister i regulatorerna för den alternativa vägen för komplementssystem ligger till grund, som i närvaro av en utlösare kan orsaka den kliniska sjukdomen (12, 13). FDA-godkänd behandling för aHUS är infusion av komplement C5-antagonist eculizumab, vilket förhindrar bildandet av membranattackkomplexet (MAC) (figur 1). Kliniskt delar HELLP samma symtom som klassiska TMA: hemolys, trombocytopeni och organsjukdom i lever. Beroende på vilken TMA-klassificering som används klassificeras vanligtvis HELLP-syndrom som en del av sekundära eller förvärvade TMA (tabell 1).
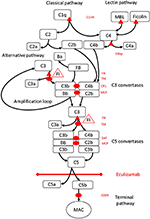
Figur 1. Eculizumab hämmar terminalvägen för komplementaktivering. Komplementaktivering kan initieras via tre aktiveringsvägar, som alla leder till bildandet av C5-konvertaser som har kapacitet att aktivera terminalvägen som leder till bildandet av MAC på målytan. Denna schematiska illustration av komplementsystemet visar dess mest relevanta aktivatorer (med svart teckensnitt) och hämmare (i rött). Aktivatorerna kan vara membranbundna (ovala) eller lösliga (triangel). Den alternativa vägen aktiveras spontant på alla ytor som inte tillåter hämning av den lösliga regulatorfaktorn H (FH). FH fungerar som kofaktor för inaktivering av C3b till iC3b av faktor I (FI). Trombomodulin (TM) förbättrar FH-kofaktoraktivitet. Klyvd faktor B (FB) tillsammans med aktivatorn C3b bildar den alternativa vägkonvertasen, som har kapacitet att klyva C3 i C3b, vilket skapar en förstärkningsslinga för alternativ vägaktivering.Klassisk väg för komplementaktivering kan initieras genom exempelvis bindning av immunkomplex till C1q, medan lektinvägen aktiveras av mannosbindande lektin (MBL) eller fikoliner som binder till exempelvis mönster av kolhydrater på mikrober. Aktivering av lektinvägen resulterar i mannosassocierade serinproteaser 1 och 2 (MASP-1 och MASP-2, ej avbildade), som klyver komplementkomponenterna C4 och C2 för att bilda den klassiska vägen konvertas C4bC2b. C1-hämmare (C1inh) och C4bp är de lösliga regulatorerna för den klassiska vägen, medan membrankofaktorprotein (MCP) och komplementreceptor 1 (CR1) är membranbundna regulatorer av tidiga komplementvägar. Bildandet av C5-konvertaser initierar den terminala vägen för komplementaktivering och klyvning av C5 i frånvaro av ytbundna regulatorer sönderfaller accelerationsfaktor (DAF) och MCP. Montering av MAC regleras av den ytbundna regulatorn CD59 (protectin). Klyvning av C3 i de tidiga vägarna och C5 i terminalvägen frigör anafylatoxiner C3a och C5a och resulterar i inflammation. Eculizumab är en humaniserad rekombinant antikropp mot komplementproteinet C5, som hämmar klyvning av C5 genom C5-konvertaserna och reglerar därmed de protrombotiska och proinflammatoriska effekterna av komplementaktivering. Patienten som beskrivs i denna fallrapport testades med avseende på genetiska mutationer i gener som kodar för faktor H (CFH), FHR5 och MCP, CFI, CFB, THBD och ADAMTS13 (ADAMTS13), en regulator för vWF-vägen för koagulationskaskad (inte visad). Resultaten av den genetiska testningen var negativa.

Tabell 1. HELLP- och aHUS-diagnostiska kriterier.
I den här fallstudien rapporterar vi en patient med en komplicerad graviditetsinducerad TMA och ett framgångsrikt behandlingsförlopp.
Fallpresentation
Tjugonio år gammal primigravida hänvisades vid graviditetsåldern 34 + 2 till Helsingfors universitetssjukhus poliklinik med övre magont. Ursprungligen var hennes blodtryck blygsamt förhöjt (133/91 mmHg) och urinmätsticka positivt för protein. Den initialt rapporterade smärta i övre delen av magen förbättrades gradvis. I ultraljudsundersökningen hade fostret normal biofysisk profil (BPP), viktuppskattningen var vid −2 SD-tillväxtkurvan. Kardiotokografi (CTG) var normal. Blodhemoglobin (Hb) var 115 g / L, trombocyter 158 E9 / L (normalt intervall 150-360 E9 / L), alaninaminotransferas (ALT) var normalt (23 U / L). Urinmätstickan var positiv för protein (+2) och beräknad proteinuria var 1,6 g / 24 timmar. Ett beslut togs att inleda kortisonbehandling för att underlätta barnets mognad. Patienten släpptes med en plan att återvända nästa dag för kontrollkontroll och andra dosen kortison. Som planerat kom hon för kontroll vid graviditetsvecka 34 + 4. Blodtrycket var 147/87 mmHg, ALT 23, trombocyter 177, CTG och BPP hos fostret i ultraljudsundersökningen var normalt. Hon blev urladdad och en ny kontroll var planerad. På eftermiddagen samma dag återkom smärta i övre delen av magen och förvärrades stadigt mot kvällen. Hon återvände till sjukhuset klockan 02.20. Hon upplevde stram övre magont, rastlöshet, och hon hade kräkats två gånger och kände tremor. Blodtrycket höjdes tydligt vid 170/94 mmHg, urinproteinmätstickan var starkt positiv, ALT höjdes vid 159, Hb 122 och trombocyter 172. Hon togs in på prenatalavdelningen. Klockan fyra upplevde hon huvudvärk. Antihypertensiv medicin startades (Labetalol 100 mg tre gånger). Urinproteinutsöndringen toppade på natten 13 g / 24 timmar. Därefter började hon kräkas, hade smärta i övre delen av magen, huvudvärk och CTG-övervakningen visade retardationer. Patienten överfördes klockan 7.11 till förlossningsavdelningen och eftersom livmoderhalsen utvidgades tre centimeter bröts fostermembranen artificiellt för induktion av arbete. Samtidigt slutfördes laboratorietesterna med Hb 122, blodplättar 172. Laktatdehydrogenas (LD) höjdes dock klart vid 1231 U / L vid denna tidpunkt. I CTG fortsatte retardationerna och när bradykardi fortsatte utfördes ett akut kejsarsnitt. Manligt spädbarn (1960 g, -2 SD) föddes kl 7,25 med navelartärens pH-värde 7,05, BE -6,80, Apgar 1/6/8. Blodförlust vid operationen var 400 ml.
Klockan 9 efter kejsarsnittet var moderns blodplättar låga vid 49, med Hb på 102. Vid eftermiddagen hade ALT stigit till 1800, LD 3570 var serumkreatininnivån 153 (μmol / L), medan trombocyter minskade till 33. Det var störningar i koagulationen indikerad av låg fibrinogennivå (1,1 g / L, referensvärden 2–4 g / L) och hög nivå av -dimer av fibrin (30,2 mg / L, < 0,5 mg / L). Det uppstod en viss blödning från det kejsarsnitt, i vilket ytterligare suturer placerades.Vid denna tidpunkt administrerades åtta enheter blodplättar. Kaliumnivån steg från 4,7 till 5,6 (mmol / L). Hemolys observerades tydligt. Coombs-testet var negativt. Urinutsöndringen var endast 10 ml / h. Laboratorietestet visade tydligt en allvarlig sjukdom med tecken på skador på både njurarna och levern. Dessutom var det störningar i koagulationssystemet som presenterade signifikant koagulation och markerad fibrinolys samtidigt. Magnesiumsulfatinfusion startades på grund av hyperreflexi, vilket anses vara ett förutsägbart tecken på kramper, en allvarlig komplikation av preeklampsi. Intravenös dexametason 10 mg startades och patienten överfördes till intensivvårdsavdelningen.
Vidare utfärdades laboratorietester för differentiella diagnostiska ändamål för andra medicinska nödsituationer (tabell 2). Aktiviteten för ADAMTS13 var normal 62% (40-130%), vilket exkluderar TTP. Serumkomplement C3 (0,52 g / L, 0,71-1,41 g / L) och C4 (0,07 g / L, 0,12-0,34 g / L) var låga. Nivån av det lösliga terminala komplexet av komplementet (C5b-9, 971 ng / ml, < 366 ng / ml) höjdes den första dagen efter förlossningen. Antifosfolipidantikroppar detekterades inte, infektionsserologin avseende hepatit B och C och HIV var negativ. Från avföringsprovet testades patogenerna som orsakade typiska HUS-negativa.

Tabell 2. Tidslinje för sjukdomsdiagnostik och behandling.
Patienten behandlades med plasmaväxlingsbehandling första och andra dagen efter förlossningen och hemodialyserades totalt tre gånger under hennes behandling (dag 2, 4 och 6 postpartum).
Den tredje postpartumdagen var patienten stabil och överfördes tillbaka till kvinnors sjukhusåterhämtningsrum observerades och symtomatisk terapi fortsatte. Hypertension behandlades med Amlodipin 10 mg två gånger om dagen och Labetalol 200 mg tre gånger om dagen. På den fjärde dagen efter förlossningen fortsatte blodplättarna att minska och patienten diagnostiserades med aHUS. Ofta var den differentiella diagnosen med HELLP-syndrom och aHUS ligger i spontan återhämtning av HELLP-patienter vanligtvis tredje dagen efter förlossningen. Behandling med eculizumab startades (900 mg IV). ent fick en pneumokockvaccination och profylaktiskt antibiotikum (penicillin) startades. Patienten fick tillsammans fyra doser eculizumab (900 mg) varje vecka och hon började snabbt återhämta sig. Hon krävde inte ytterligare hemodialys efter sin tredje hemodialys den sjätte dagen efter förlossningen (figur 2). Njurfunktionen korrigerades gradvis, antalet blodplättar förhöjt och hemolysen löstes. Fyra veckor efter förlossningen normaliserades plasmanivåerna av C3 och C4.
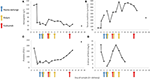
Figur 2. Valda laboratorievärden observerade under de tidiga stadierna av sjukdomen och tidpunkten för plasmaväxling, hemodialys och administrering av eculizumab. I panel (A) representeras utvecklingen av blodhemoglobinmätningar, i panel (B) serumkreatininnivån, i panel (C) antalet blodplättar, och i panel (D) D-dimer av fibrinvärden under 17 dagar uppföljningsperiod.
Vid genetisk testning identifierades inga kända genpolymorfier. Hon testades med avseende på mutationer i komplementregulatorer Faktor H (CFH), Faktor H-relaterat protein 5 (FHR5) och membranko-faktorprotein (MCP), komplement till alternativ väginaktivatorfaktor I (CFI), alternativ vägaktivatorfaktor B (CFB) ) och följande komponenter i koaguleringskaskaden: ADAMTS13, trombomodulin (THBD) och ett intracellulärt enzym, diacylglycerolkinas E (DGKE), vars mutationer är en känd orsak till aHUS (14). Dessutom upptäcktes inte antikroppar mot faktor H heller. Ingen C4-brist upptäcktes.
Som en sammanfattning hade vår patient svår preeklampsi och uppfyllde diagnostiska kriterier för HELLP-syndrom. Även om genetisk testning för aHUS förblev negativ, föreslog det kliniska förloppet av sjukdomen (särskilt allvarlig akut njurskada) och svar på behandlingen (särskilt eculizumab) att vår patient hade aHUS som orsakats av graviditet.
Diskussion
Primigravida som beskrivits ovan diagnostiserades med svår preeklampsi, HELLP-syndrom och graviditetsinducerad aHUS. Inga kända genmutationer som kunde predisponera för aHUS upptäcktes. Differentialdiagnos mellan typer av TMA, TTP, HUS / aHUS och sekundära TMA som HELLP-syndrom är viktigt. Särskilt TTP måste identifieras tidigt, eftersom sjukdomen behandlas med snabbt dagligt plasmautbyte fram till remission (15).
För närvarande kan laboratorieanalysmetoder för testning av genetiska mutationer som potentiellt orsakar aHUS visa mutationer i endast upp till 40–60% av aHUS-fallen, vilket ger möjlighet till falska negativa fall. Därför utesluter ett negativt testresultat för mutationer inte en sann aHUS (16).Sällan har aHUS inducerats efter graviditet och förlossning. I dessa fall utvecklade ~ 50% de följande tre åren kronisk njursjukdom (CKD), vissa till och med slutstegssjukdomar (ESKD). När genetiska mutationer observerades kan upp till 85% utveckla CKD eller ESKD (17).
Det är allmänt accepterat att placentinflammation vid hypertensiva graviditetsstörningar resulterar i endotel dysfunktion. Om endotelns integritet störs resulterar detta i aktivering av komplement och koagulation (18). Stört endotel i mödrarna har också antagits för att bidra till den morbiditet som senare är förknippad med svår preeklampsi och andra hypertoniska graviditetsstörningar (2, 19). Skadat endotel har visat sig fungera onormalt även år efter att de initiala diagnostiska symtomen avtar (20–23).
Hos upp till 46% av HELLP-patienter har genmutationer beskrivits i regulatorerna för den alternativa vägen. komplementsystemet (24, 25). I de tidiga stadierna av graviditeten, när moderkakan utvecklas, ses aktivering av komplementsystemet i förhöjda nivåer av Bb i serum hos patienter som senare utvecklade preeklampsi (26). Aktivering av komplementsystemet har observerats vid svår preeklampsi och HELLP-syndrom, och förhöjda nivåer av terminala komplex (C5b-9) har detekterats i urinen hos patienter med svår preeklampsi. Hos patienter med HELLP-syndrom visades ökad aktivering av komplementsystemet med funktionstest och dessutom av uttrycksbrister i CD55 och CD59, vilket ledde till minskad reglering och förvärrad aktivering av komplementsystemet (27–29).
Det finns många likheter som delas mellan HELLP-syndrom och aHUS. Under båda förhållandena är endotelstörningar tydligt involverade följt av komplement och koagulationsaktivering. Vid svår preeklampsi och HELLP-syndrom skulle eculizumab ges vid de tidiga tecknen på svår sjukdom och TMA vara fördelaktigt för skyddet av njurarna och modert endotel (30). Att bevara endotelintegriteten kan potentiellt skydda patienten från långvariga hälsorisker såsom hjärt-kärlsjukdomar. Vanligtvis, i graviditetsrelaterade TMA, kliniska fynd av hemolys och trombocytopeni lösa i ~ 3 dagar. Om sjukdomsaktiviteten varar längre ska differentiell diagnostik fortsätta och först då övervägs alternativ behandling (t.ex. eculizumab). Att introducera eculizumab-behandling tidigare skulle gynna kvinnor genom att förhindra njurskador och minimera turbulensen i endotel och systemisk inflammation. Eculizumab, ges tillräckligt tidigt och så få som en eller två doser, kan möjligen vara tillräckligt för att stoppa turbulensen och vara tillräckligt för att stoppa kaskaden av händelser (31). Å ena sidan är eculizumab ett mycket dyrt läkemedel, men å andra sidan är kostnaden för intensivvård, plasmautbyte, hemodialys, eventuell njurtransplantation, för att inte tala om de känslomässiga konsekvenserna för mödrarna och familjerna fortfarande ovärderliga.
Som en slutsats var vår patient allvarligt sjuk och upplevde hemolys, störningar i koagulationen, leverskador och njursvikt som behövde ingång till ICU och hemodialys. Det är möjligt att eculizumab, om det initierades tidigare, vid de första tecknen på HELLP-syndrom, kan ha varit fördelaktigt under den senare sjukdomsförloppet, potentiellt mildrande njurskada och därmed förhindrat behov av hemodialys och senare CKD. I denna tid av modern immunologisk medicin, kunde vi därför göra mer för mödrarna och familjerna än bara vänta och hoppas på det bästa?
Etikuttalande
Etisk granskning och godkännande var inte krävs för studien av mänskliga deltagare i enlighet med lokal lagstiftning och institutionella krav. Patienterna / deltagarna gav sitt skriftliga informerade samtycke till att delta i denna studie.
Författarens bidrag
AL och JH-E utvecklade idén till manuskriptet och skrev manuskriptet. JH-E och MH var involverade i patientens diagnostiska och terapeutiska vård. Alla författare granskade och redigerade manuskriptet och godkände dess slutliga version för publicering.
Intressekonflikt
Författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller ekonomiska relationer som kan tolkas som en potentiell intressekonflikt.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Negativa graviditetsresultat och framtida hjärt-kärlsjukdom. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed Abstract | CrossRef Fulltext | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” stora obstetriska syndrom ”är associerade med störningar i djup placentio. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed Abstract | CrossRef Fulltext | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Systemisk inflammatorisk priming vid normal graviditet och preeklampsi: rollen av cirkulerande syncytiotrofoblastmikropartiklar. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
PubMed Abstract | CrossRef Fulltext | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Uppdatering av syncytiotrofoblast-härledda extracellulära vesiklar vid normal graviditet och preeklampsi. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | CrossRef Fulltext | Google Scholar
10. Weinstein L. Syndrom av hemolys, förhöjda leverenzymer och lågt blodplättar räkning: en allvarlig konsekvens av högt blodtryck under graviditeten. Am J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | CrossRef Fulltext | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Skillnad mellan svår HELLP-syndrom och trombotisk mikroangiopati, trombotisk trombocytopen purpura och andra imitatorer. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | CrossRef Fulltext | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Nedsatt endotelfunktion hos kvinnor med preeklampsi i anamnesen: en indikator på kardiovaskulär risk. Am J Physiol Hör Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | CrossRef Fulltext | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Personal AC. Endotelfunktion och cirkulerande biomarkörer störs hos kvinnor och barn efter preeklampsi. Högt blodtryck. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | CrossRef Fulltext | Google Scholar
23. Stanhewicz AE. Återstående vaskulär dysfunktion hos kvinnor med preeklampsi i anamnesen. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | CrossRef Fulltext | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I Eloundou S, et al. Germline-mutationer i den alternativa vägen för komplement predisponerar för HELLP-syndrom. JCI insikt. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | CrossRef Fulltext | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, en ny potentiell behandling för akut njurskada associerad med preeklampsi / HELLP-syndrom. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | CrossRef Fulltext | Google Scholar