Kadmiumelementfakta (Svenska)
Det kemiska grundämnet kadmium klassas som en övergångsmetall. Det upptäcktes 1817 av Friedrich Stromeyer.

Datazon
| Klassificering: | Kadmium är en övergångsmetall |
| Färg: | blåvitt |
| Atomvikt: | 112.41 |
| Tillstånd: | solid |
| Smältpunkt: | 321,1 oC, 594,3 K |
| Kokpunkt: | 765 oC, 1038 K |
| Elektroner: | 48 |
| Protoner: | 48 |
| Neutroner i mest förekommande isotop: | 66 |
| Elektronskal: | 2,8,18,18,2 |
| Elektronkonfiguration: | 4d10 5s2 |
| Densitet @ 20oC: | 8,65 g / cm3 |
Visa mer, inklusive: Värmer, Energier, Oxidation, Reaktioner,
Föreningar, Radier, Konduktiviteter
| Atomvolym: | 13,1 cm3 / mol |
| Struktur: | hcp: sexkantig nära packad |
| Hårdhet: | 2.0 mohs |
| Specifik värmekapacitet | 0,23 J g-1 K-1 |
| Fusionsvärme | 6.192 kJ mol-1 |
| Förstörningsvärme | 112 kJ mol-1 |
| Förångningsvärme | 99,87 kJ mol-1 |
| första joniseringsenergi | 867,7 kJ mol-1 |
| 2: a joniseringsenergin | 1631,4 kJ mol-1 |
| 3: e joniseringsenergin | 3616,2 kJ mol-1 |
| Elektronaffinitet | – |
| Minsta oxidationsnummer | 0 |
| Min. gemensamt oxidationsnummer. | 0 |
| Maximalt oxidationsnummer | 2 |
| Max. vanlig oxidation nr. | 2 |
| Elektronegativitet (Pauling Scale) | 1,69 |
| Polariserbarhet volym | 7.2 Å3 |
| Reaktion med luft | mild, w / ht ⇒ CdO |
| Reaktion med 15 M HNO3 | mild ⇒ Cd (NO3) 2, NOx |
| Reaktion med 6 M HCl | mild, ⇒ H2, CdCl2 |
| Reaktion med 6 M NaOH | ingen |
| Oxid (s) | CdO, CdO2 |
| Hydrid (er) | CdH2 |
| Klorid (er) | CdCl2 |
| Atomradie | 151 pm |
| Jonisk radie (1+ jon) | – |
| Jonisk radie (2+ jon) | 109 pm |
| Jonisk radie (3+ jon) | – |
| Jonisk radie (1- jon) | – |
| Jonisk radie (2- jon) | – |
| Jonisk radie (3-jon) | – |
| The rmal konduktivitet | 96,6 W m-1 K-1 |
| Elektrisk konduktivitet | 14,7 x 106 S m-1 |
| Frys- / smältpunkt: | 321,1 oC, 594,3 K |

En liten boll av kadmiummetall med ett mynt för storleksreferens.

Friedrich Stromeyer, som upptäckte kadmium 1817.
Cadmium’s Periodic Table Neighborhood
| Grupp 11 |
Grupp 12 | Grupp 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 I |
| 6 | 79 Au |
80 Hg |
81 Tl |
Upptäckt av kadmium
Kadmium upptäcktes av den tyska kemisten Friedrich Stromeyer 1817 som en orenhet i zinkoxid. (1)
Stromeyer gjorde sin upptäckt efter en begäran från regeringen att inspektera apoteken i staden Hildesheim, Tyskland.
På den tiden användes zinkoxid, som det fortfarande är, för att behandla hudåkommor. Av någon anledning sålde Hildesheims apotek zinkkarbonat snarare än den vanliga zinkoxiden.
Stromeyer var medveten om att upphettning av zinkkarbonat tills det var glödande skulle omvandla det till oxiden. Han gjorde detta med prover från apoteken. Han fann att det lysande vita karbonatet förvandlades till en oxid som borde ha varit vit, men i själva verket var gul / orange.
Normalt skulle denna färg antyda järn- eller blyföroreningar, men Stromeyer kunde inte hitta några spår av dessa element.
Han besökte fabriken i Salzgitter där apoteken hade köpt zinkkarbonat. Han frågade varför de sålde zinkkarbonat istället för den vanliga oxiden.
Chefen förklarade för honom att deras zinkkarbonat var den förväntade färgen – vit – och att det var lätt att sälja.
När de försökte omvandla karbonatet till oxiden genom upphettning, det blev alltid gult. Eftersom zinkoxid borde vara vit kunde de inte sälja den. De hade analyserat det noggrant för järnföroreningar, men kunde inte hitta någon.
Stromeyer bestämde sig sedan för att han själv skulle analysera denna gula zinkoxid noggrant. Han fann att den gula färgen orsakades av ”närvaron av en märklig metalloxid vars existens hittills inte hade misstänkt.”
Han extraherade denna nya metalloxid från zinkoxiden och reducerade den sedan för att isolera världens första kadmiummetall någonsin. Han liknade dess utseende med platina och mätte densiteten till 8,75 g / cm3 – mycket nära dagens accepterat värde.
Han arbetade vidare och fann att andra zinkföreningar också innehöll hans nya metall. Han analyserade ”ren” zinkmetall och fann att hans nya metall var närvarande även i denna.
Han uppskattade att den nya metallen var närvarande mellan 0,1% och 1% i zink och dess föreningar, varifrån han kunde isolera 3 gram ren kadmiummetall.
Stromeyer föreslog namnet på kadmium efter ”cadmia”, det latinska namnet på calamine. Calamine är ett gammalt namn på en zinkmalm.
Cadmium upptäcktes oberoende av den tyska kemisten Karl Hermann 1818. Hermann hade märkt en oväntad gul färg i zinksulfid Det gula antogs ha arsenikföroreningar, men Hermann insåg att det faktiskt berodde på en tidigare okänd el menade. (2)


Cadmium telluride används för att göra tunnfilms solceller, som kan absorberar mer än 90% av synligt ljus. Bild: NREL
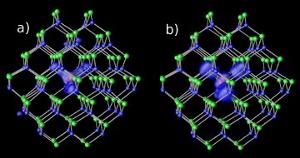
Magnesiumföroreningar i kadmium – selen nanokristaller vid två olika gapnivåer : (a) resonans och (b) hybrid. Bild: NERSC
Utseende och egenskaper
Skadliga effekter:
Kadmium och dess föreningar är mycket giftiga.
Egenskaper:
Kadmium är en mjuk, formbar, duktil, blåvit metall som enkelt kan skäras med en kniv. Det är en utmärkt elektrisk ledare och uppvisar god beständighet mot korrosion och angrepp av kemikalier.
Det liknar i många avseenden zink i sina kemiska egenskaper.
Kadmiumfläckar i luft och är lösligt i syror men inte i alkalier.
Metallen brinner i luft för att bilda brun kadmiumoxid (CdO).
Användning av kadmium
Kadmium används huvudsakligen av i batterier (särskilt uppladdningsbart nickel-kadmium, NiCad, batterier).
Som ett resultat av dess låga friktionskoefficient och dess höga utmattningsbeständighet används kadmium i legeringar för lager. Kadmium används i lågsmältande legeringar och är en komponent i många typer av löd. Det används också vid galvanisering.
Föreningar som innehåller kadmium används i svartvita TV-fosforer och i blå och gröna fosforer för färg-tv-bildrör. Kadmiumsulfid används som ett gult pigment och kadmiumselenid används som ett rött pigment, ofta kallat kadmiumrött.
Kadmium och tellur kan blandas till CdTe tunnfilms solcellsmoduler vars fysiska egenskaper är idealiska för produktion av solceller. De är relativt låga och har ett nästan perfekt bandgap för skörd av solenergi.
Överflöd och isotoper
Överflöd av jordskorpa: 150 viktdelar per miljard, 30 delar per miljard mol
Överflöd av solsystem: 6 viktdelar per miljard, 70 delar per biljon mol
Kostnad, ren: 46 $ per 100 g
Kostnad, bulk: 0,77 $ per 100 g
Källa: Kadmium förekommer oftast i små mängder associerade med zinkmalmer, såsom sfalerit (ZnS). Greenockite (CdS) är det enda kadmiummineralet av någon betydelse. Nästan allt kadmium erhålls som en biprodukt av raffinering av zink, koppar och blymalm.

- Friedrich Stromeyer, Annals of Philosophy, redigerad av Thomas Thomson, Volym XIII, 1819, Robert Baldwin, s.108
- JW Mellor, A Comprehensive Treatise in Inorganic and Theoretical Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
Citerar denna sida
För online-länkning , kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
eller
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
Till citerar den här sidan i ett akademiskt dokument, använd följande MLA-kompatibla citat:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.