Lösningar
ColligativeProperties
Ångtrycksdepression
Fysiska egenskaper kan delas in i två kategorier. Omfattande egenskaper (som massa och volym) beror på provets storlek. Intensiva egenskaper (såsom densitet och koncentration) är ämnets karakteristiska egenskaper; de beror inte på storleken på provet som studeras. Thissection introducerar en tredje kategori som är en delmängd av ett systems intensiva egenskaper. Denna tredje kategori, känd som kolligativ egendom, kan endast tillämpas på lösningar. Bydefinition, en av egenskaperna hos en lösning är en kolligativ egenskap om det bara beror på förhållandet mellan antalet partiklar av löst ämne och lösningsmedel i lösningen, inte lösningens identitet.
Mycket få av de fysikaliska egenskaperna hos en lösning är samverkande egenskaper. Som ett exempel på denna begränsade uppsättning fysiska egenskaper, låt oss överväga vad som händer med lösningsmedlets ångtryck när vi tillsätter en löst substans för att bilda en lösning. Vi definierar Po som ångtrycket i den rena vätskan ![]() lösningsmedlet
lösningsmedlet ![]() och P som ångtryck av lösningsmedlet efter tillsats av ett löst ämne.
och P som ångtryck av lösningsmedlet efter tillsats av ett löst ämne.
Po = ångtryck av den rena vätskan eller lösningsmedlet
P = lösningsmedlets ångtryck vid upplösning
När en vätskas temperatur är under dess kokpunkt Vi kan anta att de enda molekylerna som kan fly från vätskan för att bilda en gas är de som ligger nära ytan på vätskan.
När en löst substans tillsätts till lösningsmedlet upptar några av de lösliga molekylerna utrymmet nära vätskans yta, vilket visas i figuren nedan. När en löst substans löses i lösningsmedel minskar antalet lösningsmedelsmolekyler nära ytan och lösningsmedlets ångtryck minskar.

Detta har ingen effekt på hastigheten med vilken lösningsmedelsmolekyler i gasfasen kondenseras för att bilda en vätska. Men det minskar därmed vid vilken lösningsmedelsmolekylerna i vätskan kan komma ut i gasfasen. Som ett resultat bör ångtrycket hos lösningsmedlet som kommer från en lösning vara mindre än ångtrycket i det rena lösningsmedlet.
| P | < | Po | ||
| ångtryck av lösningsmedel över en lösning |
ångtryck av det rena lösningsmedlet |
Mellan 1887 och 1888 visade Francois-Marie Raoult att ångtrycket i en lösning är lika med molfraktionen av lösningsmedlet gånger ångtrycket för den rena vätskan.
| P | = | Csolvent Po | ||||
| ångtryck av lösningsmedlet ovanför en lösning |
ångtryck i det rena lösningsmedlet |
Denna ekvation, som kallas Raoults lag, är lätt att förstå. När lösningsmedlet är rent och molfraktionen av lösningsmedlet är lika med 1, är P lika med Po. När molfraktionen av lösningsmedlet blir mindre blir ångtrycket av lösningsmedlet som flyr från lösningen också mindre.
Låt oss för tillfället anta att lösningsmedlet är den enda komponenten i lösningen som är tillräckligt flyktig för att ha ett uppmätt ångtryck. Om detta stämmer kommer ångtrycket i lösningen att vara lika med ångtrycket hos lösningsmedlet som kommer ut från lösningen. Raoults lag antyder att skillnaden mellan ångtrycket i det rena lösningsmedlet och lösningen ökar när molfraktionen av lösningsmedlet minskar.
Förändringen i ångtrycket som uppstår när lösningsmedel tillsätts till ett lösningsmedel är därför en kolligativ egenskap. Om det beror på molfraktionen av det lösta ämnet, måste det bero på förhållandet mellan antalet partiklar av lösligt lösningsmedel i lösningen men inte identiteten på det lösta ämnet.
![]()
Kokpunkt Höjd och fryspunktsdepression
Bilden nedan visar konsekvenserna av att lösningen sänker ångtrycket hos ett lösningsmedel. linjekopplingspunkterna B och C i detta fasdiagram innehåller kombinationerna av temperatur och tryck vid vilket det rena lösningsmedlet och dess ånga är i jämvikt. Varje punkt på denna linje beskriver därför ångtrycket hos det rena lösningsmedlet vid den temperaturen. Den streckade linjen i denna figur beskriver egenskapen av en lösning erhållen genom att lösa lösligt i lösningsmedlet.Vid varje given temperatur är ångtrycket hos lösningsmedlet som släpper ut från lösningen mindre än ångtrycket i det rena lösningsmedlet. Den prickade linjen ligger därför under den heldragna linjen.
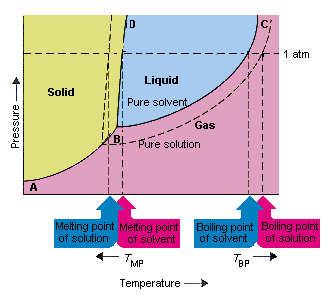
Minskningen i ångtrycket hos lösningsmedlet som uppstår när ett lösningsmedel tillsätts till lösningsmedlet orsakar en ökning av kokpunkten och minskning av lösningens smältpunkt.
Enligt denna figur kan lösningen inte koka vid samma temperatur som det rena lösningsmedlet. Om ångtrycket på lösningsmedlet som kommer ut ur lösningen är mindre än ångtrycket i det rena lösningsmedlet vid en given temperatur, måste lösningen värmas till en högre temperatur innan det kokar. Sänkning av ångtrycket för lösningsmedlet som uppstår när det används för att bilda en lösning därför ökar vätskans kokpunkt.
När fasdiagram infördes definierades trippelpunkten som den enda kombinationen av temperatur och tryck som gasen, vätskan och det fasta ämnet kan existera samtidigt. Figuren ovan visar att lösningens tredubbla punkt uppträder vid en lägre temperatur än det rena lösningsmedlets trippelpunkt. I sig är förändringen i trippelpunkten inte viktig. Men det resulterar i en förändring av temperaturen vid vilken lösningen fryser eller smälter. Att förstå varför måste vi se vård helt vid linjen som skiljer fasta och flytande områden i fasediagrammet. Denna linje är nästan vertikal eftersom smältpunkten för ett ämne inte är särskilt känslig för tryck.
Att tillsätta en löst substans till ett lösningsmedel ändrar inte hur smältpunkten beror på trycket. Linjen som skiljer de fasta och flytande områdena i lösningen är därför parallell med linjen som har samma funktion för det rena lösningsmedlet Denna linje måste emellertid passera genom trippelpunkten för lösningen. Minskningen i trippelpunkten som uppstår när lösligt löstes i ett lösningsmedel minskar därför lösningens smältpunkt.
Bilden ovan visar hur förändring i ångtryck som inträffar när ett löst ämne löser sig i ett lösningsmedel leder till förändringar i smältpunkten och lösningsmedlets kokpunkt också. Eftersom förändringen i ångtryck är en kolligativ egenskap, som endast beror på det relativa antalet lösningsmedel och lösningsmedelspartiklar , förändringarna i kokpunkten och lösningsmedlets smältpunkt är också kolligativa egenskaper.
![]()
ColligativeProperties Beräkningar
Det bästa sättet att komma till demoner att vikten av kolligativa egenskaper är att undersöka konsekvenserna av Raoults lag. Det konstaterades att ångtrycket för lösningsmedlet som flyr från upplösningen är proportionellt mot molfraktionen av lösningsmedlet.
P = CsolventPo
Men ångtrycket i ett lösningsmedel är inte en kolligativ egenskap. Endast förändringen i ångtrycket som inträffar när ett lösningsmedel tillsätts till lösningsmedlet kan inkluderas bland de lösningens kolligativa egenskaper.
Eftersom tryck är en tillståndsfunktion kan förändringen i lösningsmedlets ångtryck som uppstår när ett lösningsmedel tillsätts till lösningsmedlet definieras som skillnaden mellan det rena lösningsmedlets ångtryck och ångtrycket i lösningsmedlet. flyr från lösningen.
P = Po – P
Att ersätta Raoults lag i denna ekvation ger följande resultat.
P = Po – Csolvent Po = (1 – Csolvent) Po
Denna ekvation kan förenklas genom att komma ihåg förhållandet mellan molfraktionen av lösningsmedlet och molfraktionen av lösningsmedlet.
Csolute + Csolvent = 1
Ersätt detta förhållande till ekvationen som definierar Pgives en annan form av Raoults lag.
P = CsolutePo
Denna ekvation påminner oss om att förändringen i ångtrycket hos lösningsmedlet som uppstår när en löst substans tillsätts till lösningsmedlet är proportionell mot molfraktionen av lösningsmedlet. När merlösligt löses i lösningsmedlet minskar lösningsmedlets ångtryck och förändringen i lösningsmedlets ångtryck ökar.
Eftersom förändringar i lösningsmedlets kokpunkt (TBP) som inträffar när en löst substans tillsätts till ett lösningsmedel beror på förändringar i lösningsmedlets ångtryck är storleken på förändringen i kokpunkten också proportionell till moluppbrytningen av det lösta ämnet.
![]() TBP = kbsolute
TBP = kbsolute
I utspädda lösningar är molfraktionen av löst ämne proportionell mot molaliteten hos lösningen, som visas i figuren nedan.

Ekvationen som beskriver storleken på kokpunktens utveckling som uppstår när en löst substans tillsätts till ett lösningsmedel skrivs därför ofta enligt följande.
![]() TBP = kbm
TBP = kbm
Här är ![]() TBPis kokpunktens höjd – förändringen i kokpunkten som uppstår när ett löst ämne löser sig i lösningsmedlet
TBPis kokpunktens höjd – förändringen i kokpunkten som uppstår när ett löst ämne löser sig i lösningsmedlet ![]() och kb är en proportionalitetskonstant som är känd som molalkokpunktens höjningskonstant för lösningsmedlet.
och kb är en proportionalitetskonstant som är känd som molalkokpunktens höjningskonstant för lösningsmedlet.
En liknande ekvation kan skrivas för att beskriva vad som händer med ett lösningsmedels fryspunkt (eller smältpunkt) när en lösningsmedel tillsätts till lösningsmedlet.
![]() TFP = -kfm
TFP = -kfm
I denna ekvation är ![]() TFP fryspunkten depression
TFP fryspunkten depression ![]() förändringen i fryspunkten som inträffar när det lösta ämnet löser sig i lösningsmedlet – och kfis molal fryspunktens depressionskonstant för lösningsmedlet. Ett negativt tecken används i denna ekvation för att indikera att lösningsmedlets fryspunkt minskar när ett löst ämne tillsätts.
förändringen i fryspunkten som inträffar när det lösta ämnet löser sig i lösningsmedlet – och kfis molal fryspunktens depressionskonstant för lösningsmedlet. Ett negativt tecken används i denna ekvation för att indikera att lösningsmedlets fryspunkt minskar när ett löst ämne tillsätts.
Värdena för kf och kbas samt fryspunkter och kokpunkter för ett antal rena lösningsmedel anges i tabellerna nedan.
Fryspunktsdepressionskonstanter
Kokpunktens höjdkonstanter
Övningsuppgift 6:
Beräkna svavelens molekylvikt om 35,5 gram svavel löses upp i 100,0 gram CS2 för att ge en lösning som har en kokpunkt på 49,48 ° C.
Klicka här för att kontrollera ditt svar på Practice Problem 6
Klicka här för att se en lösning på Practice 6
Övning Problem 7:
Bestäm molekylvikten för ättiksyra om en lösning som innehåller 30,0 gram ättiksyra per kilo vatten fryser vid -0,93oC. Stämmer dessa resultat med antagandet att ättiksyra har formeln CH3CO2H?
Klicka här för att kontrollera ditt svar på Practice Problem 7
Klicka här för att se en lösning på Practice Problem
Vad skulle hända i beräkningen i Practice Problem 7 upprepades med en starkare syra, såsom saltsyra?
Övning Uppgift 8:
Förklara varför en 0,100 m lösning av HCl upplöst i bensen har en fryspunktsdepression på 0,512oC, medan en 0,100 m lösning av HCl i vatten har en fryspunktsdepression på 0,352oC.
Klicka här för att kontrollera ditt svar på Practice Problem 8
1884 Jacobus Henricus van ”t Hoff introducerade ytterligare en term till fryspunktens tryck och kokpunktens höjduttryck för att förklara de kolligativa egenskaperna hos lösningar av föreningar som dissocieras när de löser sig i vatten. kf (i) m
Att byta ut experimentvärde för fryspunktdepression av en 0,100 m HCl-lösning i denna ekvation ger ett värde för i-termen 1,89. Om HCl inte dissocierades i vatten skulle jag vara 1. Om det dissocierar helt skulle jag vara 2. Experimentvärdet på 1,89 föreslår minst 95% av HCl-molekylerna dissocierar i denna lösning.
Övning Uppgift 9:
Förklara varför 0,60 gram ättiksyra löses upp i 200 gram bensen för att bilda en lösning som sänker fryspunkten för bensen till 5,40oC.
Klicka här för att kontrollera ditt svar på Öva problem 9
![]()
Osmotiskt tryck
År 1784 upptäckte den franska fysikern och prästen Jean AntoineNollet att en grisblåsa fylld med en koncentrerad lösning av alkohol i vatten expanderade när den nedsänktes i vatten. Blåsan fungerade som ett semipermeabelt membran, vilket tillät vattenmolekyler att komma in i lösningen, men hindrade alkoholmolekyler från att röra sig i andra riktningen. Förflyttning av en komponent i en lösning genom ett membran för att späda lösningen kallas osmos, och trycket som produceras kallas det osmotiska trycket ().
Osmotiskt tryck kan demonstreras med apparaten som visas i figuren nedan. Ett semipermeabelt membran är bundet över den öppna änden av ett tistelrör. Röret fylls sedan delvis med en lösning av socker eller alkohol i vatten och nedsänks i ett mindre vatten. Vatten kommer att strömma in i röret tills trycket på vattenkolonnen på grund av tyngdkraften balanserar det kosmotiska trycket som driver vatten genom membranet.

Vatten rinner genom det semipermeabla membranet för att späda ut alkohollösningen tills tyngdkraften drar ner på kolonnen i denna lösning balanserar det osmotiska trycket som skjuter vattnet genom membranet.
Samma år som Raoult upptäckte förhållandet mellan ångtrycket i en lösning och ångtrycket hos ett puresolvent, Jacobus Henricus van ”t Hoff fann att det osmotiska trycket i en utspädd lösning () följde en ekvation som var analog med den ideala gasekvationen.
| |
= | nRT | ||
| V |
Denna ekvation antyder att osmotiskt tryck är ett annat exempel på en kolligativ egenskap, eftersom detta tryckberoende beror på förhållandet mellan antalet lösta partiklar och volymen av lösningen ![]() n / V
n / V ![]() inte identiteten på lösta partiklar. påminner oss också om storleken på osmotiskt tryck. Enligt denna ekvation, en 1,00 M s olution har ett osmotiskt tryck på 22,4 atm vid 0oC.
inte identiteten på lösta partiklar. påminner oss också om storleken på osmotiskt tryck. Enligt denna ekvation, en 1,00 M s olution har ett osmotiskt tryck på 22,4 atm vid 0oC.

Detta innebär att en 1,00 M-lösning ska kunna stödja en kolonn vatten 670 tum eller nästan 56 fot lång !
Biologer och biokemister utnyttjar ofta osmotiskt tryck när de isolerar komponenterna i en cell. När en cell tillsätts till en vattenlösning som innehåller en mycket högre koncentration av joner än vätskan i cellen, lämnar cellen vatten genom att strömma genom cellmembranet tills cellen krymper så mycket att membranet går sönder. Alternativt, när en cell placeras i en lösning som har en mycket mindre jonstyrka, häller vatten in i cellen och cellen expanderar tills cellmembranet spricker.
![]()