Polonium Element Fakta (Svenska)
Det kemiska grundämnet polonium klassas som en kalkogen och en metalloid. Det upptäcktes 1898 av Marie och Pierre Curie.

Datazon
| Klassificering: | Polonium är en kalkogen och en metalloid |
| Färg: | silvergrå |
| Atomvikt : | (209), inga stabila isotoper |
| Tillstånd: | solida |
| Smältpunkt: | 254 oC, 527 K |
| Kokpunkt: | 960 oC, 1233 K |
| Elektroner: | 84 |
| Protoner: | 84 |
| Neutroner i vanligast isotop: | 125 |
| Elektronskal: | 2,8 , 18,32,18,6 |
| Elektronkonfiguration: | 4f14 5d10 6s2 6p4 |
| Densitet @ 20oC: | 9,4 g / cm3 |
Visa mer, inklusive: Heats, Energies, Ox idation,
Reaktioner, föreningar, radier, konduktiviteter
| Atomvolym: | 22,23 cm3 / mol |
| Struktur: | enkel kubik |
| Hårdhet: | – |
| Specifik värmekapacitet | 0,12 J g-1 K-1 0,12 |
| Fusionsvärme | 13 kJ mol-1 |
| Förstörningsvärme | 142 kJ mol-1 |
| Förångningsvärme | 120 kJ mol-1 |
| första joniseringsenergi | 812 kJ mol-1 |
| andra joniseringsenergi | – |
| tredje joniseringsenergi | – |
| Elektronaffinitet | 180 kJ mol-1 |
| Lägsta oxidationsnummer | -2 |
| Min. gemensamt oxidationsnummer. | -2 |
| Maximalt oxidationsnummer | 6 |
| Max. vanlig oxidation nr. | 4 |
| Elektronegativitet (Pauling Scale) | 2.0 |
| Polariserbarhet volym | 6,8 Å3 |
| Reaktion med luft | mild, ⇒ PoO2 |
| Reaktion med 15 M HNO3 | – |
| Reaktion med 6 M HCl | mild, ⇒ PoCl2 |
| Reaktion med 6 M NaOH | ingen |
| Oxid (er) | PoO2, PoO2 |
| Hydrid (er) | PoH2 |
| Klorid (er) | PoCl2 |
| Atomradie | 190 pm |
| Jonisk radie (1+ jon) | – |
| Jonisk radie (2+ jon) | – |
| Jonisk radie (3+ jon) | – |
| Jonisk radie (1- jon) | – |
| Jonisk radie (2- jon) | – |
| Jonisk radie (3- jon) | – |
| Värmeledningsförmåga | 0.2 W m-1 K-1 |
| Elektrisk ledningsförmåga | 0,7 x 106 S m-1 |
| Frys- / smältpunkt: | 254 oC, 527 K |

Marie Curie 1883, 16 år gammal. Polonium var det första elementet hon upptäckte, 15 år senare.
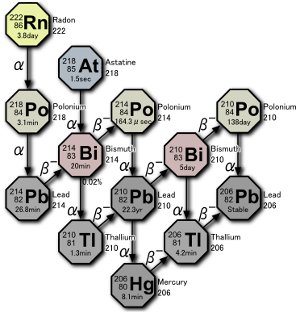
En del av uranförfallsserie. Tre isotoper av polonium produceras i naturen, antingen genom förfallet av själva radongasen eller genom förfallet av atomer som härrör från radons förfall. Bild av Tosaka.
Upptäckt av Polonium
Polonium var det första grundämnet som Marie och Pierre Curie upptäckte.
De upptäckte polonium och sedan radium 1898 i Paris, medan de undersökte radioaktivitet i pitchblende (uranoxid).
De skrev: ”Vi tror att ämnet vi har extraherat från pitchblende innehåller en metall som aldrig varit känd tidigare, liknar vismut i dess analytiska egenskaper. Om förekomsten av denna nya metall bekräftas föreslår vi att den borde vara kallas polonium efter namnet på ursprungslandet för en av oss. ”
I enlighet med Curies önskemål är polonium uppkallat efter Polen, där Marie Curie föddes och växte upp.
Farorna med att arbeta med radioaktiva ämnen kändes inte när Curies gjorde sina upptäckter. Deras laboratorieanteckningsböcker från den här tiden är så radioaktiva att de nu lagras i ett blyfodrat fodral. (1)
Utseende och egenskaper
Skadliga effekter: p>
Polonium är skadligt både genom sin kemiska toxicitet och dess radioaktivitet. Polonium-210 är en alfa-emitter och är därför mycket farlig vid förtäring eller inandning.Exponering för polonium ökar risken för att få olika cancerformer.
Egenskaper:
Polonium är en sällsynt, silvergrå, radioaktiv, lågsmältande metalloid.
Polonium reagerar lätt med utspädda syror, men bara lite med alkalier.
Alla dess isotoper är radioaktiva.
210Po avger en blå glöd, eftersom luften runt den är upphetsad av förfallet Produkter. 1 gram Po släpper ut så många alfapartiklar som 5 kg radium.
Energin som frigörs genom poloniums alfa-förfall är betydande och värmer upp utrymmet runt det. Den frigjorda energin är så stor (140 W / g) att en kapsel som innehåller ungefär ett halvt gram når en temperatur över 500 ° C.
Användning av polonium
De alfastrålar som emitteras av polonium kan användas för att eliminera statisk elektricitet som produceras under processer som rullpapper, tråd och plåt. Betastrålkällor används dock oftare eftersom de är mindre farliga.
210Po kan användas som en atomvärmekälla, men på grund av isotopens korta halveringstid (138,4 dagar) ger den inte ström för långvarig användning.
Polonium används också i antistatiska borstar för att eliminera damm på fotografisk film. Den är förseglad i borstar för att kontrollera radioaktiva utsläpp.
Överflöd och isotoper
Överflöd på jordskorpan: Av storleksordningen 1 del per kvadrillion.
Överflöd solsystem: försumbar
Kostnad , ren: per 100 g
Kostnad, bulk: per 100 g
Källa: Polonium är ett mycket sällsynt element på grund av den korta halveringstiden för alla dess isotoper. Det finns i uranmalmer i små mängder. Det kan erhållas genom att bombardera naturlig vismut, 209Bi, med neutroner för att ge 210Bi, som sedan förfaller till 210Po via β-sönderfall. Cirka 100 g polonium syntetiseras varje år.
Isotoper: Polonium har 29 isotoper vars halveringstid är känd, med massnummer 190 till 218. Ingen är stabil. Den mest stabila isotopen är 209Po, med en halveringstid på 102 år.

Citerar denna sida
För att länka online, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
eller
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
För att citera den här sidan i ett akademiskt dokument, använd följande MLA-kompatibla citat:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.