Tidskrifter | Policy | Tillstånd Gastroenterologiforskning
Förutsägbarhet av gastrisk tarmmetaplasi av fläckig fläckig erytem sett vid endoskopi
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
aAvdelningen för gastroenterologi och hepatologi, National Center for Global Health and Medicine (NCGM), Tokyo, Japan
bDepartment of Clinical Research and Informatics International Clinical Research Center Research Institute, NCGM, Tokyo, Japan
cDivision of Internal Medicine, Kosin University College of Medicine, Busan, Korea
dDepartment of Gastroenterology and Hepatology, Wakayama Medical University, Wakayama, Japan
eDepartment of Clinical Laboratory Pathological Division, NCGM, Tokyo, Japan
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Japan
gSvarande författare: Naoyoshi Nagata, Institutionen för G astroenterologi och hepatologi, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokyo 162-8655, Japan
Manuskript accepterat för publicering 26 september 2011
Kort titel: Endoskopisk diagnos av tarmmetaplasi
doi: https://doi.org/10.4021/gr357w
- Sammanfattning
- Inledning
- Metoder
- Resultat
- Diskussion
| Abstrakt | ▴Topp |
Bakgrund: Tarmmetaplasi (IM) betraktas som en premalignant lesion. Endoskopisk diagnos av IM har dock ansetts svår. Med hjälp av endoskopi hittade vi ett unikt erytemmönster, ”Mottled Patchy Erythema (MPE)”, som inkluderar svår IM. Helicobacter pylori (Hp) -infektion i sig kan orsaka erytem, vilket återspeglar histologiska förändringar i magslemhinnan. Därför registrerade vi Hp-utrotning. patienter för att validera sambandet mellan MPE och patologiska fynd.
Metoder: Vi registrerade patienter med kronisk gastrit som genomgick framgångsrik Hp-utrotning minst 6 månader före studien. Vi definierade MPE som flera platta eller deprimerade erytematösa lesioner. När vi stötte på MPE vid endoskopi utförde vi biopsi på både MPE-platsen och icke-MPE-platsen. Icke-MPE-platsen definierades som en angränsande slemhinna som ligger inom 3 cm från MPE-platsen. Alla biopsiprover utvärderades immunhistokemiskt för IM-subtyp MUC2-, MUC5AC-, MUC6-, CD10- och CDX2-fläckar. Graden av IM definierades enligt det uppdaterade Sydney-systemet. Diagnosnoggrannheten för MPE-resultaten för patologisk IM beräknades. sambandet mellan MPE och IM-subtyp bedömdes också.
Resultat: Totalt 102 patienter valdes ut för studien. Av dessa hade 55 (54%) patienter MPE. Biopsiprover togs från MPE-platserna och icke-MPE-platser från dessa 55 patienter. IM-procentsatserna och medianpoängen för IM var båda signifikant högre vid MPE-platserna (P < 0,001) än på de platser som inte var MPE. Känsligheten och specificiteten för MPE vid detektion av histologisk IM var 72,7% respektive 84,1%. Inga signifikanta föreningar observerades i uttrycket av MUC2, MUC5AC, MUC6, CD10 och CDX2 mellan MPE-ställena och icke-MPE-ställena. Det fanns inga signifikanta skillnader i förhållandena (fullständiga / ofullständiga) för IM-subtyper mellan de två grupperna.
Slutsatser: MPE är ett användbart endoskopiskt fynd för att detektera histologisk IM utan användning av kromoendoskopi och förstorande endoskopi. IM-undertypen är dock svår att identifiera. Under epoken med Hp-utrotning har MPE potential att bli ett förutsägbart resultat för risken för magcancer.
Nyckelord: Tarmmetaplasi; Förjusterad lesion; Endoskopisk upptäckt; Erytem; Endoskopi med vitt ljus; Undertyp, utrotning; Helicobacter pylori
| Inledning | ▴Top |
Man tror att utvecklingen av magcancer innefattar en flerstegsprocess, inklusive Helicobacter pylori (Hp) -infektion, kronisk gastrit, körtelatrofi, tarmmetaplasi (IM) och slutligen dysplasi. IM och gastrisk atrofi betraktas tillsammans som riskfaktorer för utveckling av magcancer i tarmtyp och betraktas som premaligna lesioner.Magatrofi kan kännas igen genom endoskopi och korrelerar med histologisk utvärdering. Diagnosen IM med hjälp av standard endoskopi med vitt ljus har dock ansetts vara svår på grund av IM som saknar skillnad i färg och dess närvaro som flera platta lesioner.
Nyligen , fann vi att ett unikt erytematöst resultat vid endoskopi kunde observeras även efter Hp-utrotning. Vi beskriver detta fynd som ”Mottled Patchy Erythema (MPE).” MPE kan kännas igen som flera platta eller lätt deprimerade erytematösa lesioner vid standard endoskopi med vitt ljus; patologiskt innefattar det svår IM. Hp-infektion i sig kan orsaka erytem, sett vid endoskopi, vilket återspeglar histologiska förändringar såsom infiltration av inflammatoriska celler och ödem. , vi registrerade patienter som genomgick Hp-utrotning för att validera sambandet mellan MPE och patologiska resultat.
| Metoder | ▴Topp |
Patientval
Patienter med kronisk gastrit som genomgick framgångsrik Hp-utrotning minst 6 månader före studien anmäldes prospektivt till studien vid National Center for Global Health and Medicine (NCGM) mellan januari 2008 och december 2008. Undantagskriterier i utesluter användningen av icke-steroida antiinflammatoriska läkemedel (NSAID), antacida och antitrombotiska läkemedel under de fyra veckorna före endoskopi. Vi utesluter också patienter med historia av gastrisk kirurgi, hemorragisk sjukdom, levercirros, njursvikt, hjärtsvikt och tidig eller avancerad magcancer. Skriftligt informerat samtycke erhölls från deltagarna i enlighet med Helsingforsdeklarationen och dess efterföljande revidering. Studieprotokollet godkändes av NCGMs etiska kommitté.
Helicobacter pylori-utrotning
Patienter med kronisk gastrit och magsårsjukdom inducerad av Hp-infektion genomgick utrotningsterapi. Patienterna behandlades med en 7-dagars regim bestående av amoxicillin, klaritromycin och en protonpumpshämmare (PPI) två gånger dagligen, vilket var standardregistret för första linjen godkänt i Japan. Om utrotning inte lyckades administrerades en andra behandling bestående av amoxicillin, metronidazol och PPI. Eradicering bekräftades genom negativ histologisk undersökning av gastriska biopsier, tillsammans med ett negativt 13C-urea-andningstest (13C-UBT) 2 till 3 månader efter avslutad utrotningsterapi. När alla tester var negativa definierades en patient som negativ för Hp-infektion.
Endoskopisk bedömning
Minst 6 månader efter utrotningen av Hp genomgick patienter endoskopisk undersökning. Vi använde ett högupplöst endoskop utan förstoring (Olympus videoscope, modell GIF-H260) för att observera förekomsten av MPE i magslemhinnan. Vi definierade MPE som flera platta eller lätt deprimerade erytematösa lesioner som kunde särskiljas från överbelastad slemhinna, blödning, angioektasi, fläckig erytem och linjär erytem (fig. 1A, B). Vi skilde också mellan MPE och rödaktig slemhinna med ett regenererande epitel åtföljd av sår eller sårärr.
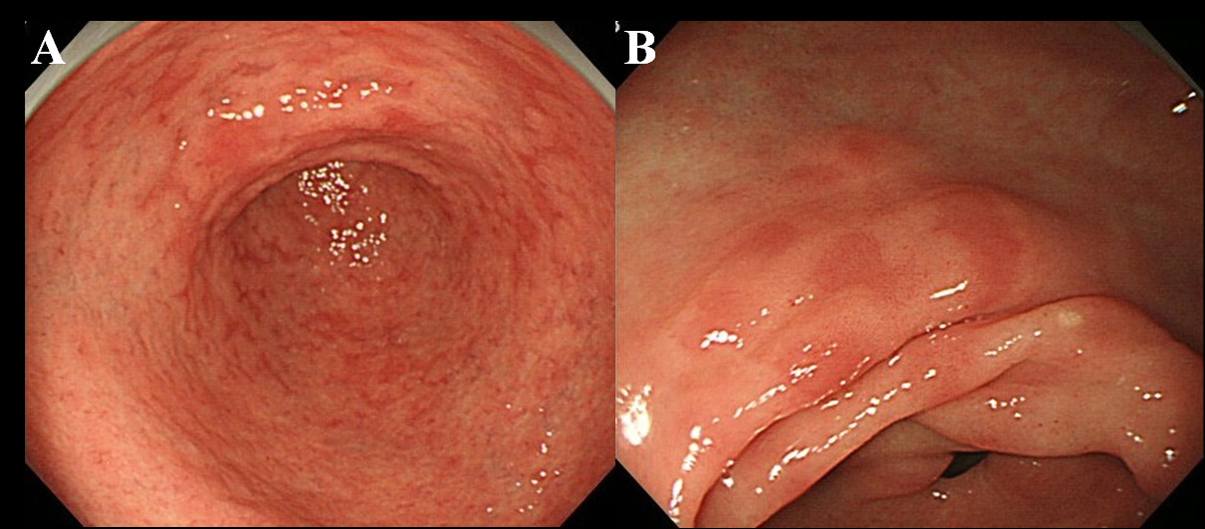 Klicka för stor bild |
Figur 1. Endoskopisk upptäckt av MPE. (A) multipel och platt erytem i antrummet; (B) Flat och deprimerad erytem i antrumets mindre krökning. |
När vi stöter på en upptäckt av MPE-fynd vid endoskopi utförde vi biopsi av både MPE-platsen och webbplatsen som inte är MPE. Icke-MPE-stället definierades som en intilliggande slemhinna belägen inom 3 cm från MPE-stället (fig. 2).
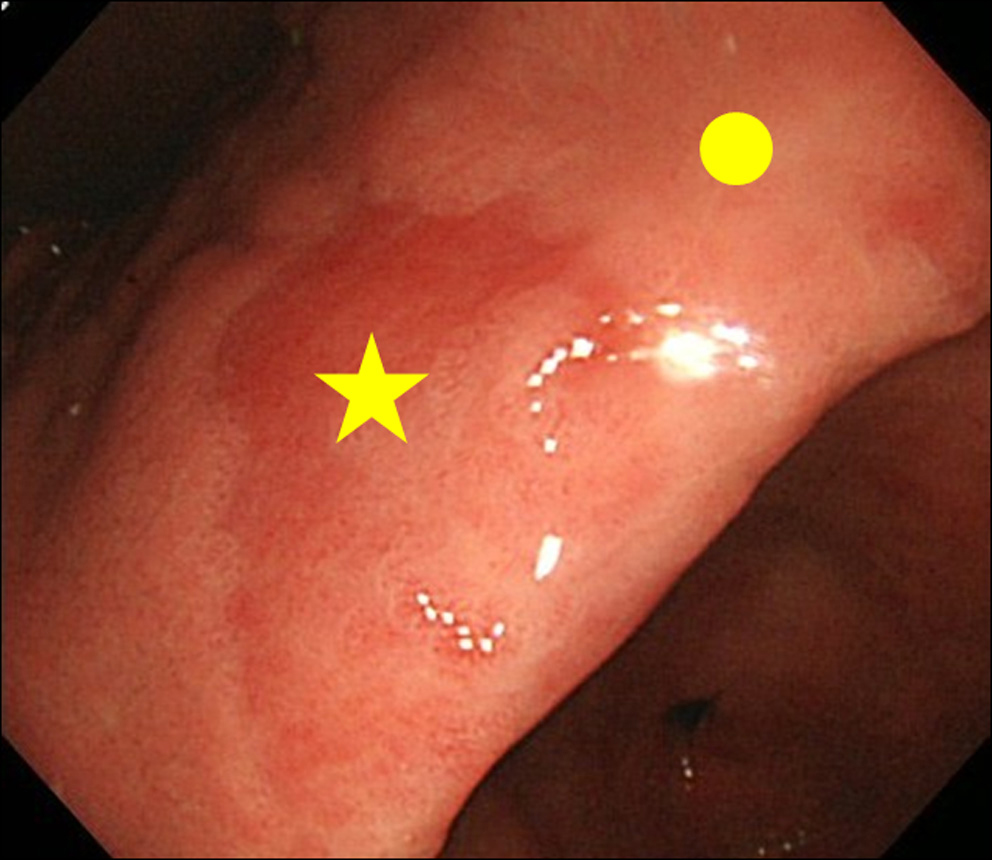 Klicka för stor bild |
Figur 2. Biopsisida. (★) Biopsisida för MPE; (•) Biopsisida för icke-MPE. Icke-MPE-plats definierades som en intilliggande slemhinna belägen inom 3 cm från MPE-plats. |
Omfattningen av den atrofiska gränsen klassificerades i tre steg: mild, måttlig och svår, enligt definition av Kimura och Takemoto.
Histologisk bedömning
Biopsiprover skickades till vårt laboratorium, fixerade i 10% buffrat formalin. Proverna bearbetades, inbäddades i paraffin och skars i 4 | im sektioner. Objektglas från varje prov färgades med hematoxylin-eosin (HE) (Fig.3A) och immunhistokemisk färgning. De immunhistokemiska fläckarna inkluderade följande: (1) MUC2, en markör för tarmslemhinnan som är användbar för att detektera bägge celler (fig. 3B), (2) MUC5AC, en markör för magslemhinnan, som uttrycks i slemhinneceller och foveolärt epitel (Fig. 3C), (3) MUC6, en markör för magslemhinnan, som uttrycks i slemhinneceller i kroppens halszon och pyloriska körtlar i antrumet (Fig. 3D), (4) CD10, en användbar markör för att detektera borstkanten i tunntarmen (fig. 3E) och (5) CDX2, en markör för närvaron av IM (fig. 3F). Vi använde CDX2 eftersom nya studier har visat att CDX2-uttryck kunde observeras i stor utsträckning i IM-körtlar och försvann inte efter utrotning av Hp. Närvaron av IM bekräftades av både HE och immunhistokemisk färgning.
Subtyperna av IM klassificerades som fullständiga eller ofullständiga typer. Den fullständiga typen definierades som minskat uttryck av gastrisk mucin (MUC5AC eller MUC6) och samuttryck av intestinal mucin (MUC2) och CD10 (Fig. 3A-F). Den ofullständiga typen definierades som uttrycket av gastrisk mucin (MUC5AC eller MUC6) och MUC2. Eftersom det inte finns några fastställda kriterier för att kategorisera ett ärende med både de fullständiga och ofullständiga typerna i ett avsnitt tilldelade vi IM-undertyperna som den vanligaste typen.
Graden av IM gjorde poäng baserat på det uppdaterade Sydney-systemet (0: ingen, 1: mild, 2: måttlig, 3: markerad).
Statistisk analys
Vi delade in patienterna i två grupper baserat på om patienterna var positiva eller negativa för MPE. Vi använde Student t-test för att jämföra ålder och period för utrotning. Chi-kvadrat-testet eller Fishers exakta sannolikhetstest användes för könsförhållandena och graden av endoskopisk atrofi i de två grupperna.
Vi jämförde också de histologiska resultaten mellan MPE-platserna och de icke-MPE-platserna. För att jämföra skillnaderna mellan de två biopsi-platserna använde vi Wilcoxon Matched-Pairs Signed-Ranks Test för IM medianpoäng och Fishers exakta test för prevalensen av IM, IM-subtyper och IM-fenotyper. Känslighet, specificitet, positiva och negativa prediktiva värden och positiva och negativa sannolikhetsförhållanden för MPE beräknas vid endoskopi för detektion av patologisk IM. P-värden < 0,05 ansågs signifikanta. Alla statistiska analyser utfördes med Stata-programvara, version 10 (StataCorp LP, College Station, TX, USA).
| Resultat | ▴Topp |
Patientegenskaper
Under studieperioden var 157 patienter som genomgick övre endoskopi och fick Hp-utrotning granskades. Vi utesluter 52 av de 157 patienterna från analys för något av följande kriterier: användning av antacida (31), antitrombotiska läkemedel (17) eller NSAID (3); eller levercirros (5), hjärtsvikt (1) eller tidig gastrisk cancer (2). Mer än ett uteslutningskriterium tillämpades på vissa patienter.
Totalt valdes 102 patienter för analys efter uteslutning. Av dessa fanns 55 (54%) patienter med MPE. Inga signifikanta skillnader noterades i medelålder och kön mellan MPE-positiva och negativa patienter (tabell 1). Det fanns inga signifikanta skillnader mellan de två grupperna efter HP-utrotningsperioden. Emellertid uppträdde gastrisk atrofi med högre svårighetsgrad (måttlig till svår) signifikant oftare i den MPE-positiva gruppen jämfört med den MPE-negativa gruppen (positiv 65,6% mot negativ 45,0%, P = 0,035).
 Klicka för att visa |
Tabell 1. Demografiska egenskaper hos patienter (n = 102) |
Endoskopiska resultat och patologiska egenskaper
 Klicka för att visa |
Tabell 2. Jämförelse av IM-poäng mellan MPE och icke-MPE-webbplats (n = 55) |
Inga signifikanta associationer observerades i uttrycket av MUC2, MUC5AC, MUC6, C D10 och CDX2 mellan MPE-platserna och icke-MPE-platserna (Tabell 3). Det fanns ingen signifikant skillnad i förhållandena (fullständiga / ofullständiga) IM-subtyper mellan de två grupperna (MPE: 18/30 kontra icke-MPE: 8/10, P = 0,778).
 Klicka för att visa |
Tabell 3. Fenotyper och undertyper av tarmmetaplasi |
| Diskussion | ▴Top |
I denna studie fokuserade vi på ett unikt erytematöst utseende som ses vid endoskopi efter Hp-utrotning. Vi kallade detta resultat ”MPE” och vi fann att närvaron av MPE sett vid endoskopi typiskt var karakteristisk för patologisk IM.
Diagnosen IM med konventionell endoskopi har ansågs svårt eftersom IM vanligtvis förekommer i platt slemhinna och uppvisar få morfologiska förändringar. Kaminishi et al rapporterade ”askfärgad nodulär förändring” som en indikator för IM; noggrannheten i dessa utredares resultat var hög, med en specificitet på 98-99%, men känsligheten var låg (6-12%). Kaminishi et al noterade att konventionell endoskopi är mindre användbar för att bekräfta diagnosen IM. Nya studier har framkommit angående endoskopisk upptäckt av IM med förstorande endoskopi. Det har rapporterats att de distinkta fynden från maggropar sett med metylenblå kromendoskopi och det ”villusliknande utseendet” sett med konfokal endoskopi har varit användbara för diagnos av IM. Uedo et al rapporterade att utseendet på ”en ljusblå topp” ( LBC) är ett exakt tecken på närvaron av IM, sett med smalbandavbildning (NBI) -förstorande endoskopi. På grund av de höga utrustningskostnaderna och de extra färdigheter och den tid som krävs för närmare undersökning med sådana specialverktyg som NBI eller förstorande endoskopi, är screening med denna utrustning dock inte praktisk i daglig klinisk praxis. Dessutom finns det en ökad risk för skada på DNA i mag-tarmslemhinnan vid användning av kromendoskopi med metylenblått följt av vitt ljus, vilket kräver försiktighet vid användning. Därför är det mer fördelaktigt att diagnostisera IM genom att hitta MPE utan användning av kromendoskopi och förstorande endoskopi. Våra studieresultat antyder att närvaron av IM kan diagnostiseras med standardendoskopi utan biopsi.
Varför kan MPE observeras även efter utrotning av Hp? Detta kan bero på histologiska förändringar i magslemhinnan. De anmärkningsvärda histologiska förändringarna efter utrotning inkluderar förbättringar i infiltration av inflammatoriska celler, epitelial hyperplasi och ödem. De endoskopiska bilderna av erytematös och ödemslemhinnan som verkar förbättras återspeglar dessa histologiska förändringar. Därför spekulerar vi i att MPE består av ett kvarvarande område med ihållande erytematös IM och ett snabbt återhämtat icke-IM-område som är resultatet av framgångsrik Hp-utrotning. Utrotningen av Hp gjorde att kontrasten mellan MPE-området och icke-MPE-områden blev tydligare. Det är dock okänt varför endast MPE-platsen observeras som en erytematös slemhinna. Man kan förmodligen dra slutsatsen att ett mycket tätt område av mikrokärl omger metaplastkörtlarna; detta har inte belysts i denna studie. Dessutom var IM-poängen på MPE-platsen signifikant högre än poängen på webbplatsen som inte var MPE. Vi spekulerar i att utseendet på erytematös slemhinna är förknippat med närvaron av många metaplastiska körtlar. . Subtyperna av IM har klassificerats i antingen den fullständiga eller ofullständiga typen; dessa är de mest använda undertyperna. Flera studier har visat att den fullständiga typen inte uppvisar någon ökad risk för att utveckla karcinom, medan den ofullständiga typen är förknippad med en ökad risk för malign transformation. Föreningen mellan undertyperna och risken för magcancer är dock inte allmänt accepterad. För närvarande är det svårt att identifiera någon av subtyperna med standardendoskopi.
Det har rapporterats att Hp-utrotningsterapi är effektiv för att förhindra både gastrointestinala sår såväl som utvecklingen av magcancer. Dessa användningar av Hp-utrotningsterapi kommer troligen att dyka upp i klinisk praxis inom en snar framtid. Men försiktighet bör iakttas mot risken för utveckling av magcancer efter Hp-utrotning. Karaktäristiken för gastrisk cancer efter utrotning har rapporterats inkludera patologiskt svår IM vid corpus och allvarlig gastrisk atrofi som detekterats vid endoskopi. Därför är det nödvändigt att noggrant observera närvaron av IM även efter Hp-utrotning.
Sammanfattningsvis är närvaron av MPE vid endoskopisk undersökning karakteristisk för patologisk IM.Det skulle vara fördelaktigt i klinisk praxis att kunna diagnostisera patologisk IM utan kromendoskopi eller förstorande endoskopi. MPE har potential att bli ett förutsägbart resultat för risken för magcancer i eran av Hp-utrotningen.
Bekräftelser
Vi erkänner Dr. Hidenobu Watanabe och Dr. Hiroyoshi Ota för deras konsulttjänster för denna studie om patologiska utvärderingar. Vi vill uttrycka vår tacksamhet till Hisae Kawashiro, klinisk forskningskoordinator, för hjälp med datainsamling.
Stöd för bidrag
Detta arbete stöddes av Grant of National Center for Global Health and Medicine (21-108).
Intressekonflikter
Författarna förklarar att de inte har några intressekonflikter.
| ▴Topp |
- Correa P. Human gastrisk karcinogenes: en multisteg och multifaktoriell process – First American Cancer Society Award Lecture on Cancer Epidemiologi och förebyggande. Cancer Res. 1992; 52 (24): 6735-6740.
publicerad - Leung WK, Sung JJ. Granskningsartikel: tarmmetaplasi och gastrisk karcinogenes. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Helicobacter pylori-infektion och utveckling av magcancer. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Ett endoskopiskt erkännande av den atrofiska gränsen och dess betydelse vid kronisk gastrit. Endoskopi. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Biopsisidor lämpliga för diagnos av Helicobacter pylori-infektion och bedömning av omfattningen av atrofisk gastrit. Jag är J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Endoskopisk klassificering av kronisk gastrit baserad på en pilotstudie från Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Gastrisk epitel dysplasi. Hur klinisk patologisk bakgrund relaterar till ledningen. Cancer. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Endoskopisk diagnos av magtarmmetaplasi efter Helicobacter pylori-utrotning. Endoskopi. 2009; 41 (suppl I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Klassificering och klassificering av gastrit. Det uppdaterade Sydney-systemet. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucin-genuttryck i normalt, preneoplastiskt och neoplastiskt humant gastrisk epitel. Cancer Res. 1995; 55 (12): 2681-2690.
publicerad - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. Slemhinnor som nyckelmolekyler för klassificering av tarmmetaplasi i magen. Virchows Arch. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. Intestinal metaplasi i magsäcken visar tydliga mönster av mucin (MUC1, MUC2, MUC5AC och MUC6) uttryck. Cancer Res. 1999; 59 (5): 1003-1007.
publicerad - Groisman GM, Amar M, Livne E. CD10: ett värdefullt verktyg för mikroskopisk diagnos av mikrovillös inkluderingssjukdom (familjär mikrovillös atrofi). Am J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. Ektopeptidaserna CD10, CD13, CD26 och CD143 regleras i magcancer. Int J Oncol. 2004; 25 (5): 1223-1232.
publicerad - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Ektopisk expression av homeodomainprotein CDX2 i tarmmetaplasi och magkarcinom. Cancer Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Avvikande uttryck av CDX2 i magslemhinnan med och utan tarmmetaplasi: effekt av utrotning av Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H, et al. Förstoringskromoendoskopi för diagnos av magtarmmetaplasi och dysplasi. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Extern validering av en klassificering för metylenblå förstoringskromoendoskopi i premaligna gastriska lesioner. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Endoskopiska mönster av magslemhinnan och dess kliniska patologiska betydelse. Världen J Gastroenterol. 2003; 9 (11): 2552-2556.
publicerad - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. En ny metod för att diagnostisera magsäcksmetaplasi: smalbandsavbildning med förstorande endoskopi. Endoskopi. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Förstoring endoskopi: förbättrar det slemhinnans ytanalys för diagnos av gastrointestinala neoplasier ?. Endoskopi. 2002; 34 (10): 819-822.
pubmed doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Kromendoskopi med metylenblått och därmed sammanhängande DNA-skador i Barretts matstrupe. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Femårig uppföljningsstudie om histologiska och endoskopiska förändringar i magslemhinnan efter Helicobacter pylori-utrotning. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Två till fyra år histologisk uppföljning av magslemhinnan efter Helicobacter pylori-utrotning. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. Slemprofilerna i normal gastrisk slemhinna, tarmmetaplasi och dess varianter och gastrisk karcinom. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al. Tarmmetaplasityper och risken för magsäcken cancer: en kohortstudie i Slovenien. Int J Cancer. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Detektion av ökad förekomst av tidig gastrisk cancer hos patienter med tarmmetaplasi typ III som följs upp noggrant. Mage. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Granskningsartikel: pre-neoplastiska tillstånd i magslemhinnan – ett praktiskt tillvägagångssätt för den förvirrade klinikern. Aliment Pharmacol Ther. 2001; 15 (Suppl 1): 43-50.
publicerad - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Effekt av utrotning av Helicobacter pylori på förekomsten av metakront gastrisk karcinom efter endoskopisk resektion av tidig gastrisk cancer: en öppen, randomiserad kontrollerad studie. Lansett. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Magcancer upptäckt efter Helicobacter pylori-utrotning. Matsmältningsendoskopi. 2007; 19: 167-173.
Detta är en artikel med öppen åtkomst som distribueras under villkoren i Creative Commons Attribution License, som tillåter obegränsad användning, distribution och reproduktion i vilket medium som helst, förutsatt att originalverket är korrekt citerat.
Gastroenterology Research publiceras av Elmer Press Inc.