Zeitschriften | Politik | Permission Gastroenterology Research
Vorhersagbarkeit der Magen-Darm-Metaplasie durch fleckiges fleckiges Erythem bei Endoskopie
Naoyoshi Nagataa, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf, Abteilung für Gastroenterologie und Hepatologie, Nationales Zentrum für globale Gesundheit und Medizin (NCGM), Tokio, Japan
Abteilung für klinische Forschung und Informatik Internationales Forschungsinstitut für klinisches Forschungszentrum, NCGM, Tokio, Japan
Abteilung für Innere Medizin, Kosin University College of Medicine, Busan, Korea
Abteilung für Gastroenterologie und Hepatologie, Wakayama Medical University, Wakayama, Japan
eDepartment der Abteilung für klinische Laborpathologie, NCGM, Tokio, Japan
fDepartment für Gastroenterologie und Hepatologie, NCGM, Kohnodai Hospital, Chiba, Japan
gKorrespondierender Autor: Naoyoshi Nagata, Abteilung für G Astroenterologie und Hepatologie, Nationales Zentrum für globale Gesundheit und Medizin, 1-21-1 Toyama, Shinjuku-ku, Tokio 162-8655, Japan
Manuskript zur Veröffentlichung angenommen 26. September 2011
Kurztitel: Endoskopische Diagnose der intestinalen Metaplasie
doi: https://doi.org/10.4021/gr357w
- Zusammenfassung
- Einführung
- Methoden
- Ergebnisse
- Diskussion
| Zusammenfassung | ▴Top |
Hintergrund: Die intestinale Metaplasie (IM) wird als prämaligne Läsion angesehen. Die endoskopische Diagnose von IM wurde jedoch als schwierig angesehen. Unter Verwendung der Endoskopie fanden wir ein einzigartiges Erythemmuster, „Mottled Patchy Erythema (MPE)“, das eine schwere IM umfasst. Eine Helicobacter pylori (Hp) -Infektion selbst kann ein Erythem verursachen, das histologische Veränderungen in der Magenschleimhaut widerspiegelt. Daher haben wir die HP-Eradikation eingeschlossen Patienten, um die Beziehung zwischen MPE und pathologischen Befunden zu validieren.
Methoden: Wir nahmen Patienten mit chronischer Gastritis auf, die mindestens 6 Monate vor der Studie eine erfolgreiche HP-Eradikation durchlaufen hatten. Wir definierten MPE als multiple flache oder depressive erythematöse Läsionen. Wenn wir bei der Endoskopie auf MPE stießen, führten wir eine Biopsie sowohl an der MPE-Stelle als auch an der Nicht-MPE-Stelle durch. Die Nicht-MPE-Stelle wurde als benachbarte Schleimhaut definiert, die sich innerhalb von 3 cm von der MPE-Stelle befindet MUC2-, MUC5AC-, MUC6-, CD10- und CDX2-Färbungen. Der Grad der IM wurde gemäß dem aktualisierten Sydney-System definiert. Die diagnostische Genauigkeit der MPE-Befunde für die pathologische IM wurde berechnet Die Beziehung zwischen MPE und IM-Subtyp wurde ebenfalls bewertet.
Ergebnisse: Insgesamt wurden 102 Patienten für die Studie ausgewählt. Von diesen hatten 55 (54%) Patienten MPE. Von diesen 55 Patienten wurden Biopsien von den MPE-Stellen und Nicht-MPE-Stellen entnommen. Die IM-Prozentsätze und der Medianwert der IM waren an den MPE-Stellen (P < 0,001) signifikant höher als an den Nicht-MPE-Stellen. Die Sensitivität und Spezifität für MPE beim Nachweis von histologischem IM betrug 72,7% bzw. 84,1%. Bei der Expression von MUC2, MUC5AC, MUC6, CD10 und CDX2 zwischen den MPE-Stellen und Nicht-MPE-Stellen wurden keine signifikanten Assoziationen beobachtet. Es gab keine signifikanten Unterschiede in den Verhältnissen (vollständig / unvollständig) der IM-Subtypen zwischen den beiden Gruppen.
Schlussfolgerungen: MPE ist ein nützlicher endoskopischer Befund zum Nachweis histologischer IM ohne Verwendung von Chromoendoskopie und Vergrößerungsendoskopie. Der IM-Subtyp ist jedoch schwer zu identifizieren. Im Zeitalter der HP-Eradikation kann MPE zu einem prädiktiven Befund für das Risiko von Magenkrebs werden.
Schlüsselwörter: Darmmetaplasie; Prämaligne Läsion; Endoskopischer Befund; Erythem; Weißlichtendoskopie; Subtyp, Ausrottung; Helicobacter pylori
| Einführung | opTop |
Es wird angenommen, dass die Entwicklung von Magenkrebs einen mehrstufigen Prozess umfasst, der eine Infektion mit Helicobacter pylori (Hp), chronische Gastritis, Drüsenatrophie, Darmmetaplasie (IM) und schließlich umfasst Dysplasie. IM und Magenatrophie werden zusammen als Risikofaktoren für die Entwicklung von Magenkrebs vom Darmtyp angesehen und als prämaligne Läsionen angesehen.Eine Magenatrophie kann endoskopisch erkannt werden und korreliert mit der histologischen Bewertung. Die Diagnose von IM unter Verwendung der Standard-Weißlichtendoskopie wurde jedoch als schwierig angesehen, da IM keine Unterscheidung in Farbe und Vorhandensein als mehrere flache Läsionen aufweist.
Kürzlich fanden wir, dass ein einzigartiger erythematöser Befund bei der Endoskopie auch nach HP-Eradikation beobachtet werden konnte. Wir beschreiben diesen Befund als „Mottled Patchy Erythema (MPE)“. MPE kann unter Standard-Weißlicht-Endoskopie als mehrere flache oder leicht depressive erythematöse Läsionen erkannt werden. Pathologisch umfasst es eine schwere IM. Eine HP-Infektion selbst kann ein Erythem verursachen, das bei der Endoskopie beobachtet wird und histologische Veränderungen wie die Infiltration von Entzündungszellen und Ödemen widerspiegelt Wir haben Patienten eingeschlossen, bei denen eine HP-Eradikation durchgeführt wurde, um die Beziehung zwischen MPE und pathologischen Befunden zu validieren.
| Methoden | opTop |
Patientenauswahl
Patienten mit chronischer Gastritis, die mindestens 6 Monate vor der Studie eine erfolgreiche HP-Eradikation durchlaufen hatten, wurden zwischen Januar 2008 und Dezember 2008 prospektiv für die Studie am Nationalen Zentrum für globale Gesundheit und Medizin (NCGM) aufgenommen. Ausschlusskriterien i Die Verwendung von nichtsteroidalen Antiphlogistika (NSAIDs), Antazida und Antithrombotika während der 4 Wochen vor der Endoskopie war ausgeschlossen. Wir haben auch Patienten mit Magenoperationen in der Vorgeschichte, hämorrhagischen Erkrankungen, Leberzirrhose, Nierenversagen, Herzinsuffizienz und frühem oder fortgeschrittenem Magenkrebs ausgeschlossen. Die Teilnehmer erteilten eine schriftliche Einverständniserklärung gemäß der Erklärung von Helsinki und ihrer anschließenden Überarbeitung. Das Studienprotokoll wurde von der Ethikkommission des NCGM genehmigt.
Ausrottung von Helicobacter pylori
Patienten mit chronischer Gastritis und Ulkuskrankheit, die durch eine HP-Infektion hervorgerufen wurden, wurden einer Eradikationstherapie unterzogen. Die Patienten wurden zweimal täglich mit einem 7-Tage-Regime behandelt, das aus Amoxicillin, Clarithromycin und einem Protonenpumpenhemmer (PPI) bestand. Dies war das in Japan zugelassene Standard-First-Line-Regime. Wenn die Eradikation nicht erfolgreich war, wurde ein zweites Regime bestehend aus Amoxicillin, Metronidazol und PPI verabreicht. Die Eradikation wurde durch negative histologische Untersuchung der Magenbiopsien zusammen mit einem negativen 13C-Harnstoff-Atemtest (13C-UBT) 2 bis 3 Monate nach Abschluss der Eradikationstherapie bestätigt. Wenn alle Tests negativ waren, wurde ein Patient als negativ für eine HP-Infektion definiert.
Endoskopische Beurteilung
Mindestens 6 Monate nach der Ausrottung von Hp wurden die Patienten einer endoskopischen Untersuchung unterzogen. Wir verwendeten ein hochauflösendes Endoskop ohne Vergrößerung (Olympus Videoskop, Modell GIF-H260), um das Vorhandensein von MPE in der Magenschleimhaut zu beobachten. Wir definierten MPE als multiple flache oder leicht depressive erythematöse Läsionen, die von verstopfter Schleimhaut, Blutung, Angioektasie, fleckigem Erythem und linearem Erythem unterschieden werden konnten (Abb. 1A, B). Wir haben auch zwischen MPE und rötlicher Schleimhaut mit einem regenerierenden Epithel unterschieden, das von Geschwüren oder Geschwürnarben begleitet wird.
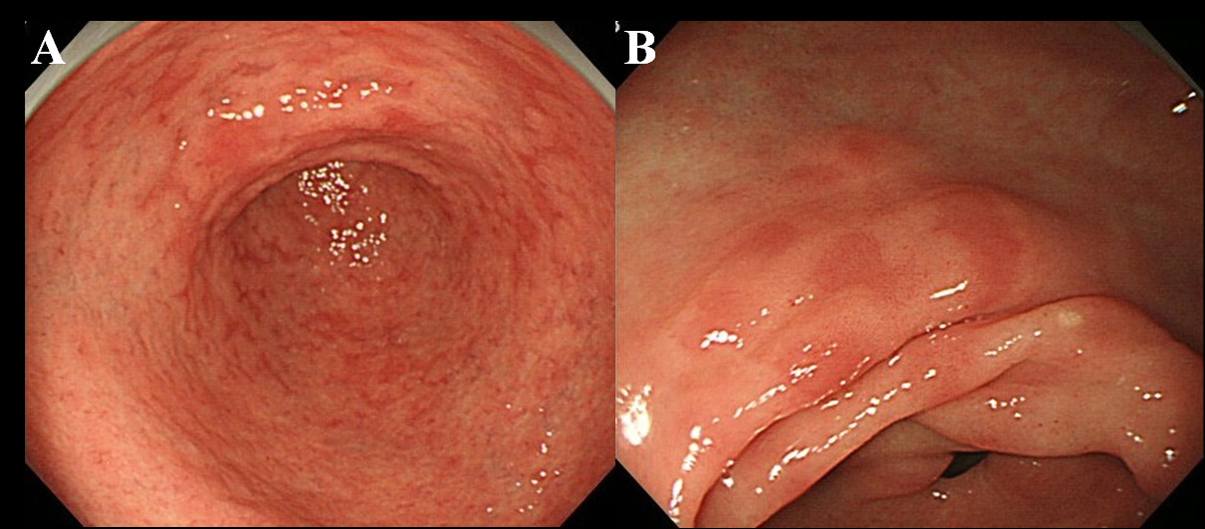 Klicken für großes Bild |
Abbildung 1. Endoskopischer Befund von MPE. (A) Multiples und flaches Erythem im Antrum; (B) Flaches und depressives Erythem in der geringeren Krümmung des Antrums. |
Als bei der Endoskopie ein MPE-Befund festgestellt wurde, führten wir eine Biopsie sowohl der MPE-Stelle als auch der Nicht-MPE-Stelle durch. Die Nicht-MPE-Stelle wurde als benachbarte Schleimhaut definiert, die sich innerhalb von 3 cm von der MPE-Stelle befindet (Fig. 2).
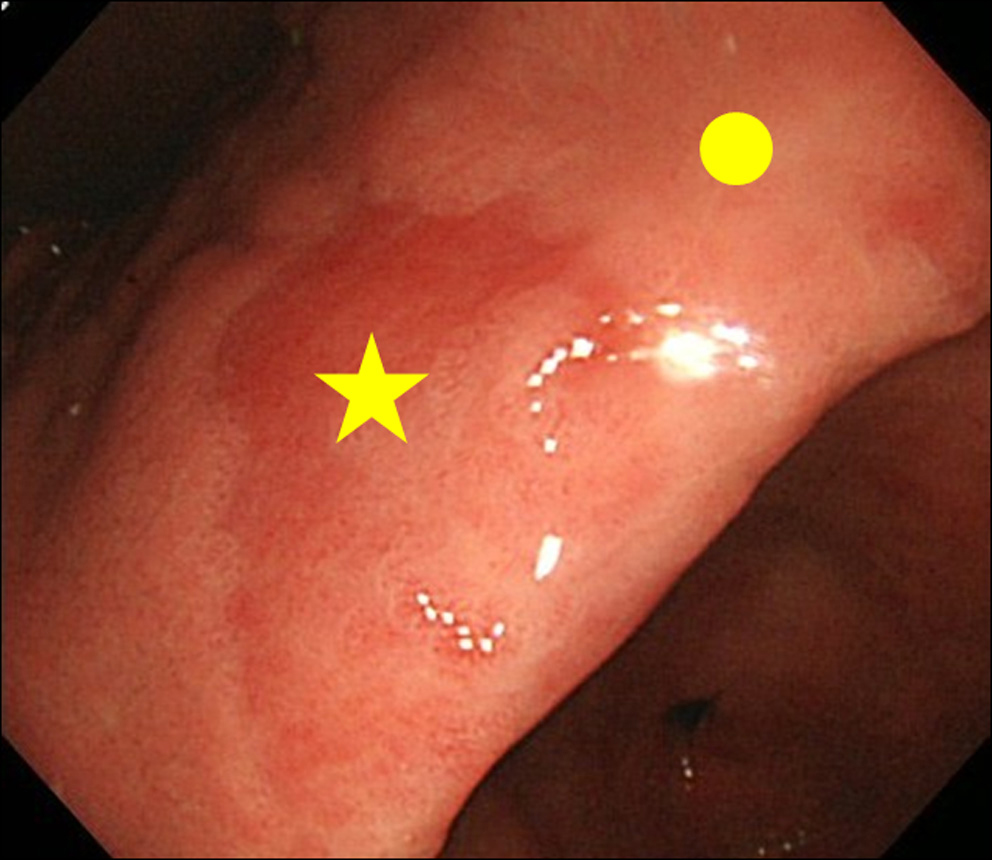 Klicken für großes Bild |
Abbildung 2. Biopsie-Site. (★) Biopsiestelle von MPE; (•) Biopsiestelle von Nicht-MPE. Eine Nicht-MPE-Stelle wurde als benachbarte Schleimhaut definiert, die sich innerhalb von 3 cm von der MPE-Stelle befindet. |
Das Ausmaß der atrophischen Grenze wurde in drei Stadien eingeteilt: leicht, mittelschwer und schwer, wie von Kimura und Takemoto definiert.
Histologische Beurteilung
Biopsieproben wurden an unser Labor geschickt und in 10% gepuffertem Formalin fixiert. Die Proben wurden verarbeitet, in Paraffin eingebettet und in 4 um-Schnitte geschnitten. Objektträger von jeder Probe wurden unter Verwendung von Hämatoxylin-Eosin (HE) gefärbt (Fig.3A) und immunhistochemische Färbung. Die immunhistochemischen Färbungen umfassten Folgendes: (1) MUC2, einen Marker für Darmmucin, der zum Nachweis von Becherzellen nützlich ist (Fig. 3B), (2) MUC5AC, einen Marker für Magenmucin, der in Schleimhalszellen exprimiert wird, und foveoläres Epithel (Fig. 3C), (3) MUC6, ein Marker für Magenmucin, der in Schleimzellen der Halszone des Körpers und der Pylorusdrüsen des Antrums exprimiert wird (Fig. 3D), (4) CD10, a nützlicher Marker zum Nachweis des Bürstenrandes des Dünndarms (Fig. 3E) und (5) CDX2, ein Marker für das Vorhandensein von IM (Fig. 3F). Wir verwendeten CDX2, weil neuere Studien gezeigt haben, dass die CDX2-Expression in IM-Drüsen weitgehend beobachtet werden konnte und nach Ausrottung von Hp nicht verschwand. Das Vorhandensein von IM wurde sowohl durch HE- als auch durch immunhistochemische Färbung bestätigt.
Die Subtypen von IM wurden als vollständige oder unvollständige Typen klassifiziert. Der vollständige Typ wurde als verminderte Expression von Magenmucin (MUC5AC oder MUC6) und Koexpression von Darmmucin (MUC2) und CD10 definiert (Fig. 3A-F). Der unvollständige Typ wurde als Expression von Magenmucin (MUC5AC oder MUC6) und MUC2 definiert. Da es keine festgelegten Kriterien gibt, um einen Fall in einem Abschnitt als vollständig und unvollständig zu kategorisieren, haben wir die IM-Subtypen als vorherrschenden Typ zugewiesen.
Der Grad von IM wurde basierend auf dem aktualisierten Sydney-System bewertet (0: keine, 1: mild, 2: moderat, 3: markiert).
Statistische Analyse
Wir haben die Patienten in zwei Gruppen eingeteilt, je nachdem, ob die Patienten positiv oder negativ für MPE waren. Wir haben den Student-t-Test verwendet, um Alter und Eradikationszeitraum zu vergleichen. Der Chi-Quadrat-Test oder der exakte Wahrscheinlichkeitstest nach Fisher wurden für die Geschlechtsverhältnisse und den Grad der endoskopischen Atrophie in den beiden Gruppen verwendet.
Wir haben auch die histologischen Befunde zwischen den MPE-Stellen und den Nicht-MPE-Stellen verglichen. Um die Unterschiede zwischen den beiden Biopsiestellen zu vergleichen, haben wir den Wilcoxon Matched-Pairs Signed-Ranks-Test für die IM verwendet Medianwert und genauer Fisher-Test für die Prävalenz von IM, IM-Subtypen und IM-Phänotypen. Die Sensitivität, Spezifität, positiven und negativen Vorhersagewerte sowie die positiven und negativen Wahrscheinlichkeitsverhältnisse von MPE, die bei der Endoskopie zum Nachweis pathologischer IM beobachtet wurden, wurden berechnet. P-Werte < 0,05 wurden als signifikant angesehen. Alle statistischen Analysen wurden mit Stata-Software, Version 10 (StataCorp LP, College Station, TX, USA) durchgeführt.
| Ergebnisse | opTop |
Patienteneigenschaften
Während des Studienzeitraums 157 Patienten Wer sich einer oberen Endoskopie unterzog und eine HP-Eradikation erhielt, wurde überprüft. Wir haben 52 der 157 Patienten nach einem der folgenden Kriterien von der Analyse ausgeschlossen: Verwendung von Antazida (31), Antithrombotika (17) oder NSAIDs (3); oder Vorgeschichte von Leberzirrhose (5), Herzinsuffizienz (1) oder frühem Magenkrebs (2). Bei einigen Patienten wurde mehr als ein Ausschlusskriterium angewendet.
Insgesamt 102 Patienten wurden daher nach dem Ausschluss für die Analyse ausgewählt. Von diesen gab es 55 (54%) Patienten mit MPE. Es wurden keine signifikanten Unterschiede im mittleren Alter und Geschlecht zwischen MPE-positiven und -negativen Patienten festgestellt (Tabelle 1). Es gab keine signifikanten Unterschiede zwischen den beiden Gruppen nach der HP-Eradikationsperiode. Eine Magenatrophie mit einem höheren Schweregrad (mittel bis schwer) trat jedoch in der MPE-positiven Gruppe signifikant häufiger auf als in der MPE-negativen Gruppe (positiv 65,6% gegenüber negativ 45,0%, P = 0,035).
 Zum Anzeigen klicken |
Tabelle 1. Demografische Merkmale der Patienten (n = 102) |
Endoskopische Befunde und pathologische Merkmale
 Klicken Sie hier, um |
Bei der Expression von MUC2, MUC5AC, MUC6, C wurden keine signifikanten Assoziationen beobachtet D10 und CDX2 zwischen den MPE-Stellen und den Nicht-MPE-Stellen (Tabelle 3). Es gab keinen signifikanten Unterschied in den Verhältnissen (vollständig / unvollständig) der IM-Subtypen zwischen den beiden Gruppen (MPE: 18/30 gegenüber Nicht-MPE: 8/10, P = 0,778).
 Klicken Sie hier, um |
anzuzeigen. Tabelle 3. Phänotypen und Subtypen der intestinalen Metaplasie |
| Diskussion | opTop |
In dieser Studie konzentrierten wir uns auf ein einzigartiges erythematöses Erscheinungsbild, das bei der Endoskopie nach HP-Eradikation beobachtet wurde. Wir nannten diesen Befund „MPE“ und fanden heraus, dass das Vorhandensein von MPE in der Endoskopie typischerweise für pathologische IM charakteristisch ist.
Die Diagnose von IM mit konventioneller Endoskopie hat wurde als schwierig angesehen, da IM normalerweise in der flachen Schleimhaut auftritt und nur wenige morphologische Veränderungen aufweist. Kaminishi et al. berichteten von einer „aschefarbenen Knotenänderung“ als Indikator für IM; Die Genauigkeit der Ergebnisse dieser Forscher war mit einer Spezifität von 98-99% hoch, aber die Sensitivität war gering (6-12%). Kaminishi et al. Stellten fest, dass die konventionelle Endoskopie zur Bestätigung der IM-Diagnose weniger nützlich ist. Jüngste Studien zum endoskopischen Befund von IM mittels Vergrößerungsendoskopie sind erschienen. Es wurde berichtet, dass die charakteristischen Befunde von Magengruben, die bei der Methylenblau-Chromoendoskopie beobachtet wurden, und das „zottenartige Erscheinungsbild“, das bei der konfokalen Endoskopie beobachtet wurde, für die Diagnose von IM nützlich waren. Uedo et al. Berichteten, dass das Auftreten eines „hellblauen Kamms“ ( LBC) ist ein genaues Zeichen für das Vorhandensein von IM, wie bei der Schmalband-Bildgebung (NBI) -vergrößernden Endoskopie zu sehen ist. Aufgrund der hohen Gerätekosten und der zusätzlichen Fähigkeiten und Zeit, die für eine genauere Untersuchung mit Spezialwerkzeugen wie NBI oder Vergrößerungsendoskopie erforderlich sind, ist das Screening mit diesem Gerät in der täglichen klinischen Praxis nicht praktikabel. Darüber hinaus besteht ein erhöhtes Risiko einer Schädigung der DNA in der Magen-Darm-Schleimhaut, wenn eine Chromoendoskopie mit Methylenblau gefolgt von weißem Licht durchgeführt wird, was bei der Verwendung Vorsicht erfordert. Daher ist es vorteilhafter, IM zu diagnostizieren, indem MPE ohne Verwendung von Chromoendoskopie und Vergrößerungsendoskopie gefunden wird. Unsere Studienergebnisse legen nahe, dass das Vorhandensein von IM mit einer Standardendoskopie ohne Biopsie diagnostiziert werden kann.
Warum kann MPE auch nach der Ausrottung von Hp beobachtet werden? Dies könnte auf die histologischen Veränderungen in der Magenschleimhaut zurückzuführen sein. Die bemerkenswerten histologischen Veränderungen nach der Eradikation umfassen Verbesserungen bei der Infiltration von Entzündungszellen, epitheliale Hyperplasie und Ödeme. Die endoskopischen Bilder der erythematösen und ödematösen Schleimhaut, die verbessert zu sein scheinen, spiegeln diese histologischen Veränderungen wider. Daher spekulieren wir, dass MPE aus einem verbleibenden Bereich persistierender erythematöser IM und einem schnell wiederhergestellten Nicht-IM-Bereich besteht, der aus einer erfolgreichen HP-Eradikation resultiert. Die Ausrottung von Hp führte dazu, dass der Kontrast zwischen dem MPE-Bereich und Nicht-MPE-Bereichen klarer wurde. Es ist jedoch nicht bekannt, warum nur die MPE-Stelle als erythematöse Schleimhaut beobachtet wird. Es kann wahrscheinlich gefolgert werden, dass ein hochdichter Bereich von Mikrogefäßen die metaplastischen Drüsen umgibt; Dies wurde in dieser Studie nicht aufgeklärt. Darüber hinaus war der IM-Score am MPE-Standort signifikant höher als der Score am Nicht-MPE-Standort. Wir spekulieren, dass das Auftreten einer erythematösen Schleimhaut mit dem Vorhandensein vieler metaplastischer Drüsen verbunden ist.
Die vorliegende Studie zeigte, dass der vollständige IM-Subtyp überwiegend in der Magenschleimhaut gefunden wurde . Die Subtypen von IM wurden entweder in den vollständigen oder den unvollständigen Typ klassifiziert. Dies sind die am häufigsten verwendeten Untertypen. Mehrere Studien haben gezeigt, dass der vollständige Typ kein erhöhtes Risiko für die Entwicklung eines Karzinoms aufweist, während der unvollständige Typ mit einem erhöhten Risiko einer malignen Transformation verbunden ist. Der Zusammenhang zwischen den Subtypen und dem Magenkrebsrisiko wird jedoch nicht allgemein akzeptiert. Gegenwärtig ist es schwierig, einen der Subtypen unter Verwendung der Standardendoskopie zu identifizieren.
Es wurde berichtet, dass die HP-Eradikationstherapie sowohl zur Vorbeugung von Magen-Darm-Geschwüren als auch wirksam ist die Entwicklung von Magenkrebs. Diese Anwendungen der HP-Eradikationstherapie werden wahrscheinlich in naher Zukunft in der klinischen Praxis auftreten. Es ist jedoch Vorsicht geboten gegenüber dem Risiko der Entwicklung von Magenkrebs nach HP-Eradikation. Es wurde berichtet, dass die Merkmale von Magenkrebs nach Eradikation pathologisch schwere IM am Korpus und schwere Magenatrophie umfassen, wie sie bei der Endoskopie festgestellt wurden. Daher ist es notwendig, das Vorhandensein von IM auch nach Hp-Eradikation sorgfältig zu beobachten.
Zusammenfassend ist das Vorhandensein von MPE bei der endoskopischen Untersuchung charakteristisch für pathologische IM.In der klinischen Praxis wäre es vorteilhaft, pathologische IM ohne Chromoendoskopie oder Vergrößerungsendoskopie diagnostizieren zu können. MPE hat das Potenzial, ein prädiktiver Befund für das Risiko von Magenkrebs im Zeitalter der HP-Eradikation zu werden.
Danksagung
Wir danken Dr. Hidenobu Watanabe und Dr. Hiroyoshi Ota für ihre beratenden Leistungen zu dieser Studie in Bezug auf die pathologischen Bewertungen. Wir möchten Hisae Kawashiro, Koordinator für klinische Forschung, für die Hilfe bei der Datenerfassung danken.
Unterstützung gewähren
Diese Arbeit wurde vom Grant des Nationalen Zentrums für globale Gesundheit und Medizin (21-108) unterstützt.
Interessenkonflikte
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
| opTop |
- Correa P. Menschliche Magenkarzinogenese: ein mehrstufiger und multifaktorieller Prozess – Erster Vortrag der American Cancer Society über Krebs Epidemiologie und Prävention. Cancer Res. 1992; 52 (24): 6735 & ndash; 6740.
pubmed - Leung WK, Sung JJ. Übersichtsartikel: Darmmetaplasie und Magenkarzinogenese. Aliment Pharmacol Ther. 2002; 16 (7): 1209 & ndash; 1216.
pubmed doi - Uemura N., Okamoto S., Yamamoto S., Matsumura N., Yamaguchi S., Yamakido M., Taniyama K. et al. Helicobacter pylori-Infektion und die Entwicklung von Magenkrebs. N Engl J Med. 2001; 345 (11): 784 & ndash; 789.
pubmed doi - Kimura K, Takemoto T. Eine endoskopische Erkennung der atrophischen Grenze und ihrer Bedeutung bei chronischer Gastritis. Endoskopie. 1969; 1: 1-3.
- Satoh K., Kimura K., Taniguchi Y., Kihira K., Takimoto T., Saifuku K., Kawata H. et al. Biopsiestellen, die zur Diagnose einer Helicobacter pylori-Infektion und zur Beurteilung des Ausmaßes einer atrophischen Gastritis geeignet sind. Am J Gastroenterol. 1998; 93 (4): 569 & ndash; 573.
pubmed doi - Kaminishi M., Yamaguchi H., Nomura S., Oohara T., Sakai S., Fukutomi H., Nakahara A. et al. Endoskopische Klassifikation der chronischen Gastritis basierend auf einer Pilotstudie der Forschungsgesellschaft für Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M., Leandro G., Farinati F., Di Mario F., Sonego F., Cassaro M., Guido M. et al. Magenepitheldysplasie. Wie der klinisch-pathologische Hintergrund mit dem Management zusammenhängt. Krebs. 1995; 76 (3): 376 & ndash; 382.
pubmed doi - Nagata N., Akiyama J., Uemura N. Endoskopische Diagnose der Magen-Darm-Metaplasie nach Helicobacter pylori-Eradikation. Endoskopie. 2009; 41 (Ergänzung I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Klassifizierung und Einstufung von Gastritis. Das aktualisierte Sydney-System. Internationaler Workshop zur Histopathologie der Gastritis, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161 & ndash; 1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucin-Genexpression in normalem, präneoplastischem und neoplastischem menschlichem Magenepithel. Cancer Res. 1995; 55 (12): 2681 & ndash; 2690.
pubmed - Silva E., Teixeira A., David L., Carneiro F., Reis CA, Sobrinho-Simoes J., Serpa J. et al. Mucine als Schlüsselmoleküle zur Klassifizierung der Darmmetaplasie des Magens. Virchows Arch. 2002; 440 (3): 311 & ndash; 317.
pubmed doi - Reis CA, David L., Correa P., Carneiro F., de Bolos C., Garcia E., Mandel U. et al. Die intestinale Metaplasie des menschlichen Magens zeigt unterschiedliche Muster der Mucinexpression (MUC1, MUC2, MUC5AC und MUC6). Cancer Res. 1999; 59 (5): 1003 & ndash; 1007.
pubmed - Groisman GM, Amar M., Livne E. CD10: Ein wertvolles Instrument für die lichtmikroskopische Diagnose von mikrovillösen Einschlusskrankheiten (familiäre mikrovillöse Atrophie). Am J Surg Pathol. 2002; 26 (7): 902 & ndash; 907.
pubmed doi - Carl-McGrath S., Lendeckel U., Ebert M., Wolter AB, Roessner A., Rocken C. Die Ektopeptidasen CD10, CD13, CD26 und CD143 sind bei Magenkrebs hochreguliert. Int J Oncol. 2004; 25 (5): 1223 & ndash; 1232.
pubmed - Bai YQ, Yamamoto H., Akiyama Y, Tanaka H., Takizawa T., Koike M., Kenji Yagi O. et al. Ektopische Expression des Homöodomänenproteins CDX2 bei Darmmetaplasien und Magenkarzinomen. Krebs Lett. 2002; 176 (1): 47 & ndash; 55.
pubmed doi - Satoh K., Mutoh H., Eda A., Yanaka I., Osawa H., Honda S., Kawata H. et al. Aberrante Expression von CDX2 in der Magenschleimhaut mit und ohne Darmmetaplasie: Wirkung der Eradikation von Helicobacter pylori. Helicobacter. 2002; 7 (3): 192 & ndash; 198.
pubmed doi - Dinis-Ribeiro M., da Costa-Pereira A., Lopes C., Lara-Santos L., Guilherme M., Moreira-Dias L., Lomba- Viana H. et al. Vergrößerungschromoendoskopie zur Diagnose von Magen-Darm-Metaplasie und Dysplasie. Gastrointest Endosc. 2003; 57 (4): 498 & ndash; 504.
pubmed doi - Areia M., Amaro P., Dinis-Ribeiro M., Cipriano MA, Marinho C., Costa-Pereira A., Lopes C. et al. Externe Validierung einer Klassifikation für die Chromoendoskopie mit Methylenblau-Vergrößerung bei prämalignen Magenläsionen. Gastrointest Endosc. 2008; 67 (7): 1011 & ndash; 1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Endoskopische Muster der Magenschleimhaut und ihre klinisch-pathologische Bedeutung. Welt J Gastroenterol. 2003; 9 (11): 2552 & ndash; 2556.
pubmed - Uedo N., Ishihara R., Iishi H., Yamamoto S., Yamada T., Imanaka K., Takeuchi Y. et al. Eine neue Methode zur Diagnose der Magen-Darm-Metaplasie: Schmalband-Bildgebung mit Vergrößerungsendoskopie. Endoskopie. 2006; 38 (8): 819 & ndash; 824.
pubmed doi - Kiesslich R, Jung M. Vergrößerungsendoskopie: Verbessert sie die Analyse der Schleimhautoberfläche zur Diagnose von gastrointestinalen Neoplasien?. Endoskopie. 2002; 34 (10): 819 & ndash; 822.
pubmed doi - Olliver JR, Wild CP, Sahay P., Dexter S., Hardie LJ. Chromoendoskopie mit Methylenblau und damit verbundenen DNA-Schäden im Barrett-Ösophagus. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y. , Miwa J., Kaise M., Matsubara Y., Hatahara T., Ohta Y. Fünf-Jahres-Follow-up-Studie zu histologischen und endoskopischen Veränderungen der Magenschleimhaut nach Helicobacter pylori-Eradikation. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Zwei- bis vierjährige histologische Nachuntersuchung der Magenschleimhaut nach Helicobacter Pylori-Ausrottung. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. Die Mucinprofile des normalen Magens Schleimhaut, Darmmetaplasie und ihre Varianten und Magenkarzinom. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N. Matko I., Kato I., Pompe-Kirn V., Jutersek A., Teuchmann S. et al., Intestinale Metaplasietypen und das Magenrisiko Krebs: eine Kohortenstudie in Slowenien. Int J Cancer. 1994; 57 (3): 324 & ndash; 329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Erkennung einer erhöhten Inzidenz von Magenkrebs im Frühstadium bei Patienten mit intestinaler Metaplasie Typ III, die engmaschig überwacht werden. Darm. 1991; 32 (10): 1110 & ndash; 1113.
pubmed doi - Genta RM, Rugge M. Übersichtsartikel: Präneoplastische Zustände der Magenschleimhaut – ein praktischer Ansatz für den verwirrten Kliniker. Aliment Pharmacol Ther. 2001; 15 (Suppl 1): 43 & ndash; 50.
pubmed - Fukase K., Kato M., Kikuchi S., Inoue K., Uemura N., Okamoto S., Terao S. et al. Einfluss der Eradikation von Helicobacter pylori auf die Inzidenz von metachronem Magenkarzinom nach endoskopischer Resektion von Magenkrebs im Frühstadium: eine offene, randomisierte, kontrollierte Studie. Lanzette. 2008; 372 (9636): 392 & ndash; 397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Magenkrebs nach Eradikation mit Helicobacter pylori nachgewiesen. Verdauungsendoskopie. 2007; 19: 167-173.
Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Attribution License vertrieben wird erlaubt die uneingeschränkte Verwendung, Verbreitung und Reproduktion in jedem Medium, sofern das Originalwerk ordnungsgemäß zitiert wird.
Gastroenterology Research wird von Elmer Press Inc.
veröffentlicht